双氯芬酸钠缓释片的体外释放度研究
2016-08-10杨艾玲殷义霞杜松云魏启兵
杨艾玲 ,殷义霞,杜松云,罗 敏,魏启兵
(1.武汉理工大学华夏学院 化学与制药工程系,湖北 武汉 430223;2.武汉理工大学 材料复合新技术国家重点实验室,湖北 武汉 430070)
0 引言
双氯芬酸钠为邻氨基苯甲酸类非甾体解热镇痛抗炎药,临床可用于治疗风湿和类风湿性关节炎、骨性关节炎、强直性脊柱炎及多种原因引起的疼痛和发热等[1].双氯芬酸钠对释放介质pH值的变化比较敏感,血浆半衰期为1~2 h,作用维持时间短[2],胃肠道反应是其常见不良反应[3-4].因此,为延长给药时间间隔,维持稳定血药浓度,减少副作用,许多厂家将双氯芬酸钠制成缓释制剂,并且双氯芬酸钠也成为国内外多种缓释或控释系统研究中较为理想的模型药物[5].
相比较速释制剂,缓释制剂更有利于提高病人的服药依从性和增强治疗效果.目前,国内市场上双氯芬酸钠缓释制剂品种较多,而且各厂家的药品质量差异也较大[6],导致药物的最佳疗效出现差异,增加了临床上医生和患者选用该类药物的难度.释放度是口服药物从缓释制剂、控释制剂或肠溶制剂在规定溶剂中释放的速度和程度,体外释放度考察是评价缓释制剂质量的一个重要指标.本文建立体外释放度的测定方法,随机选取市售两个不同厂家的双氯芬酸钠缓释片进行释放度测定,采用Weibull方程计算释放参数,并对释放参数进行方差分析,为设计疗效更佳的双氯芬酸钠缓释制剂处方和提高缓释制剂体外释放度评价标准提供理论参考.
1 实验部分
1.1 仪器与药品
TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;ZRS-8G溶出度测试仪,天津大学精密仪器厂.双氯芬酸钠缓释片A,深圳某药厂,规格0.1 g/片;双氯芬酸钠缓释片B,上海某药厂,规格0.1 g/片;双氯芬酸钠对照品,中国食品药品检定研究院,批号100334-200302;磷酸二氢钾、无水磷酸氢二钠均为分析纯.
1.2 方法
1.2.1 检测波长的选择 称取双氯芬酸钠对照品约10 mg于50 mL容量瓶中,用pH6.8磷酸盐缓冲溶液稀释,定容至刻度,精密量取上述溶液5 mL置于50 mL容量瓶中,加pH6.8磷酸盐缓冲溶液稀释至刻度,摇匀,制成双氯芬酸钠对照品溶液.以pH6.8磷酸盐缓冲溶液为空白,取对照品溶液适量于比色皿中,照紫外—可见分光光度法,在200~400 nm间进行扫描,结果表明双氯芬酸钠对照品溶液在276 nm处有最大吸收,而辅料在此波长处无吸收,故选定276 nm为检测波长.
1.2.2 标准曲线的建立 精密称取双氯芬酸钠对照品12.0 mg,置于100 mL的量瓶中,加pH6.8磷酸盐缓冲液稀释至刻度,摇匀.精密量取上述溶液2、3、4、5、6、7、8、9 mL置于50 mL容量瓶中,用pH6.8磷酸盐缓冲液稀释至刻度,配制成浓度分别为4.8、7.2、9.6、12.0、14.4、16.8、19.2、21.6 mg/L 的溶液,分别在276 nm处测定吸光度,并以吸光度A为纵坐标,浓度C(mg/L)为横坐标,进行线性回归,得回归方程A=4.34×10-2C-8.80×10-2(r= 0.991 9,n=8),双氯芬酸钠浓度在4.8~21.6 mg/L范围内与吸光度线性关系良好.
1.2.3 精密度 配制20 mg/L的双氯芬酸钠对照品溶液,在最大吸收波长276 nm处重复测定5次吸光度,RSD为0.13%,表明精密度良好.
1.2.4 稳定性 配制20 mg/L的双氯芬酸钠对照品溶液,分别于0、2、6、8、12 h在276 nm处测定吸光度,吸光度值分别为0.699、0.720、0.705、0.731、0.716,RSD为1.76%,说明稳定性良好.
1.2.5 加样回收率实验 精密称取已知含量的双氯芬酸钠缓释片适量,按标示量用pH6.8磷酸盐缓冲液配制成14.4 mg/L的样品溶液,取样品溶液10 mL,共9份,准确测定其浓度,分别置于50 mL容量瓶中.另精密称取双氯芬酸钠对照品适量,用pH6.8磷酸盐缓冲液配制成14.4 mg/L的对照品溶液,取对照品溶液8、10、12 mL各3份,分别加入9份样品溶液中,用pH6.8磷酸盐缓冲液定容至刻度,于276 nm处测定吸光度,计算回收率,结果见表1.
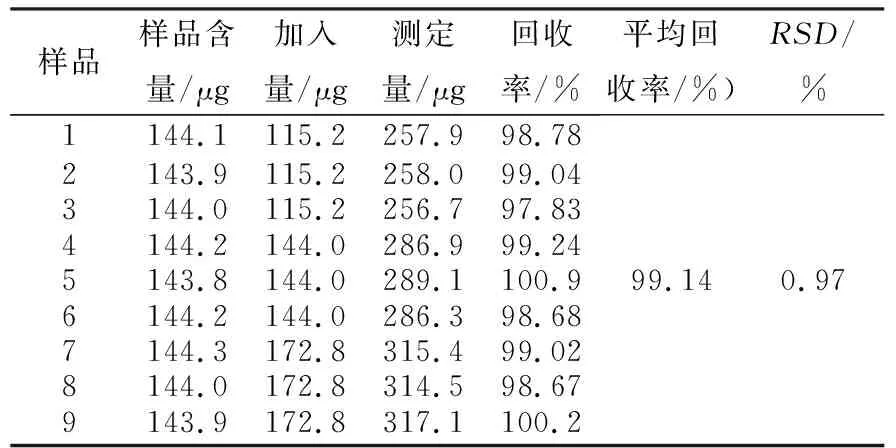
表1 双氯芬酸钠缓释片加样回收率实验结果Tab. 1 The addition standard recovery results of diclofenac sodium sustained-release tablets
2 结果与讨论
2.1 释放度的测定
参照2015版《中国药典》第四部中《溶出度与释放度测定方法》[7]和《日本橙皮书》中收载的双氯芬酸钠缓释片的溶出度测定方法,以pH6.8磷酸盐缓冲液900 mL为释放介质,温度为(37 ℃±0.5 ℃),转速为100 r/min,分别于0.25、0.75、2、4、6、8、10、12 h各取样时间点处取样10 mL,同时立即补充相同温度、相同体积的释放介质,并用0.8μm微孔滤膜滤过,精密量取续滤液1 mL于10 mL容量瓶中,并用释放介质稀释至刻度,作为供试品溶液.另精密称定双氯芬酸钠对照品0.010 g,加释放介质制成每1 mL约含10 μg的溶液,作为对照品溶液.分别取上述两种溶液在276 nm波长处测定吸光度,并计算累积释放百分率,结果见图1.
根据《中国药典》2015版第四部中《缓释、控释和迟释制剂指导原则》[8],由累积释放率-时间曲线(图1)可以看出,A厂药品在取样时间点2 h,累积释放率约30%,存在突释点,在中间取样点6 h,累积释放率约50%,在最后的取样时间点12 h,累积释放率大于75%,可认为释药完全,B厂药品在中间取样点6 h时,累积释放率约80%,释药过快,A厂药品和B厂药品释药速率存在明显差异.
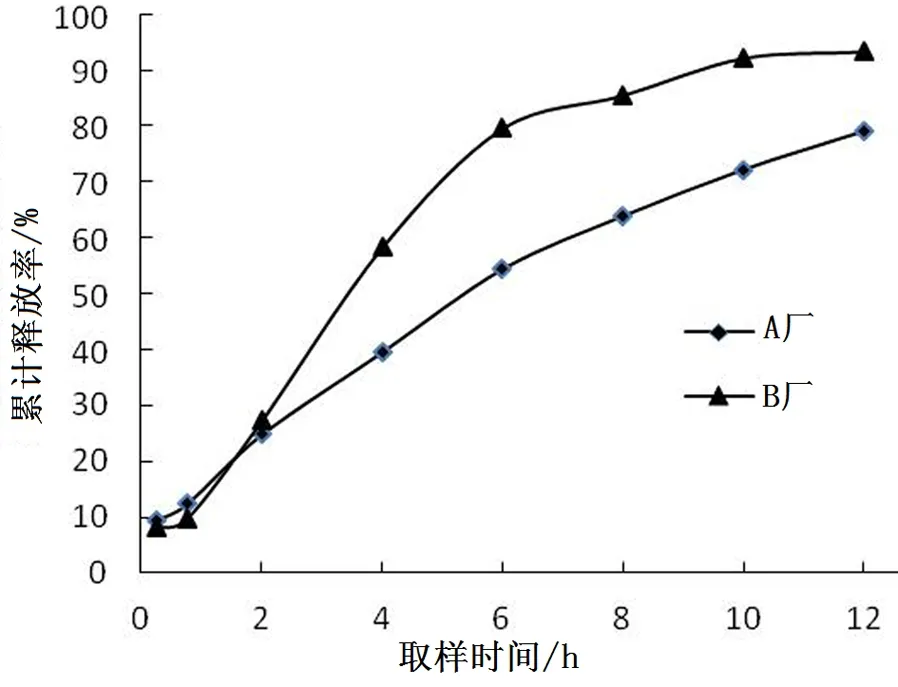
图1 两厂家双氯芬酸钠缓释片的释放曲线Fig. 1 The release curve of diclofenac sodium sustained-release tablets from two different pharmaceutical factories
2.2 释放参数计算和方差分析
利用Weibull分布模型原理,用Excel处理释放度数据[9],计算两厂家双氯芬酸钠缓释片的形状参数m、累积释放50%所需时间T50和累积释放63.2%所需时间Td,结果见表2;对表2中两厂家双氯芬酸钠缓释片的T50、Td、m进行方差分析,结果见表3.

表2 两厂家双氯芬酸钠缓释片的释放参数Tab. 2 The release parameters of diclofenac sodium sustained-release tablets from two different pharmaceutical factories
结果表明,A厂家药品释药速率较快,其T50,Td值均明显小于于B厂家,A、B两厂家药品的溶出参数之间有显著性差异(P< 0.01),释放曲线的形态和释放速率均存在差异.
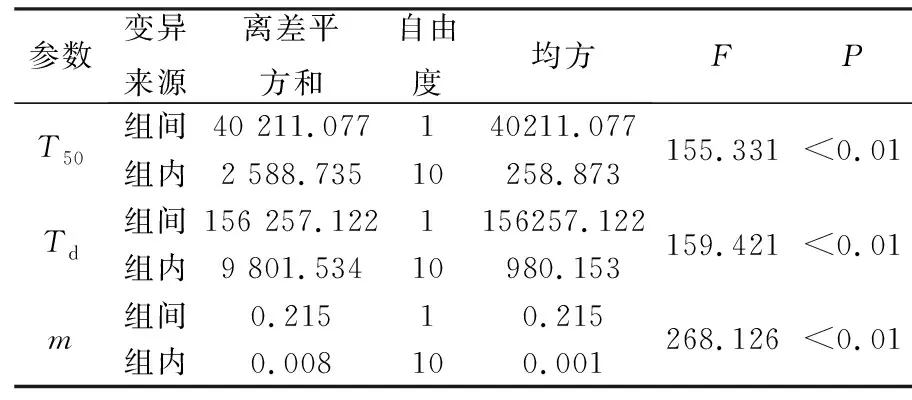
表3 两厂家双氯芬酸钠缓释片的释放参数方差分析结果Tab. 3 The variance results of diclofenac sodium sustained-release tablets from two different pharmaceutical factories
3 结论
研究表明:双氯芬酸钠对照品在pH6.8磷酸盐缓冲液中的最大吸收波长为276 nm, 双氯芬酸钠浓度在4.8~21.6 mg/L范围内与吸光度线性关系良好,精密度、稳定性良好,回收率为99.14%,准确度高,则所建立双氯芬酸钠缓释片体外释放度测定方法可行;两厂家的释放参数T50、Td、m存在显著性差异.不同厂家相同规格的双氯芬酸钠缓释片释放程度存在较大区别,可能是由于原辅料来源、处方配比、生产工艺条件、溶胀崩解特性[10]等的不同,此差异有可能影响到制剂的临床疗效.因此,测定缓释制剂的释放度并提高释放度测定要求,对保证制剂的临床疗效是非常有必要的.在后续研究中,将着重探讨具体是哪一种因素导致双氯芬酸钠缓释片的释放度出现差异.
