柑橘砧木枳橙和香橙B O R 2基因的克隆与缺硼胁迫下的表达分析
2016-08-10颜廷帅潘志勇刘永忠彭抒昂华中农业大学园艺植物生物学教育部重点实验室湖北武汉430070金正大生态工程集团股份有限公司国家缓控释肥工程技术研究中心山东临沭276700
颜廷帅,罗 庆,潘志勇,刘永忠,彭抒昂(.华中农业大学 园艺植物生物学教育部重点实验室,湖北 武汉 430070;2.金正大生态工程集团股份有限公司 国家缓控释肥工程技术研究中心,山东 临沭 276700)
柑橘砧木枳橙和香橙B O R 2基因的克隆与缺硼胁迫下的表达分析
颜廷帅1,2,罗 庆1,潘志勇1,刘永忠1,彭抒昂1
(1.华中农业大学 园艺植物生物学教育部重点实验室,湖北 武汉 430070;2.金正大生态工程集团股份有限公司 国家缓控释肥工程技术研究中心,山东 临沭 276700)
以耐缺硼胁迫的枳橙((Citrus sinens(L.)Osb.×Poncirus trifoliata(L.)Raf.)和不耐缺硼胁迫的香橙(Citrus junos Sieb.ex Tanaka)为材料,克隆了拟南芥硼运输基因AtBOR2的同源基因枳橙CPBOR2和香橙CjBOR2,进行相关生物信息学分析和缺硼胁迫下的表达分析。结果表明,CPBOR2和CjBOR2的ORF长度分别为2133bp和2073bp,CpBOR2和CjBOR2蛋白都具有7个跨膜区域,且具有细胞膜极性定位和内吞降解的保守氨基酸位点;缺硼胁迫下,CjBOR2表达量与对照相比无显著变化,在前期降低,后期升高。
枳橙;香橙;BOR2;缺硼;克隆;qPCR
文献著录格式:颜廷帅,罗庆,潘志勇,等.柑橘砧木枳橙和香橙B O R 2基因的克隆与缺硼胁迫下的表达分析[J].浙江农业科学,2016,57(1):65-68.
我国柑橘主产区主要位于南方多雨的山地丘陵地区,土壤多为酸性的红黄壤,土壤状况较差,同时南方湿润多雨,硼酸极易因淋溶作用而流失,因此土壤缺硼的现象较普遍[1-2]。土壤缺硼易造成柑橘老叶叶脉木栓化,树势早衰,果实产量和品质下降,使产区农民遭受严重的经济损失[3]。
柑橘树体主要通过砧木根系吸收和转运硼,不同的砧木可以影响树体的营养状况[4]。目前柑橘砧木吸收和运输硼的机制还不清楚,最近在模式植物拟南芥中发现AtBOR2在缺硼胁迫下硼的转运过程中有重要作用:AtBOR2定位于根部,转运共质体的硼到质外体,促进细胞壁硼糖复合物的形成,从而保证根部延长区细胞的正常伸长和硼向地上部的转运,缺硼胁迫下AtBOR2表达量上升[5]。而柑橘砧木中AtBOR2的同源基因在缺硼胁迫下的作用目前还不清楚,为了确定缺硼胁迫下不同柑橘砧木中AtBOR2的同源基因表达量的变化,本试验所用材料为耐缺硼胁迫的柑橘砧木枳橙和不耐缺硼胁迫的柑橘砧木香橙[6],克隆枳橙 CPBOR2和香橙CjBOR2,并在缺硼胁迫下对水培条件下的枳橙和香橙进行缺硼胁迫处理,通过 qPCR技术,测定CPBOR2和CjBOR2表达量的变化,为进一步确定柑橘吸收和转运硼的机制奠定基础。
1 材料与方法
1.1 材料
试验材料为生长3个月的枳橙和香橙幼苗。
选取长势一致的枳橙和香橙幼苗转入1/2Hoag1and和Aron(全浓度)溶液培养,每2 h通气15 min,在光周期为16 h/8 h(L/D)和昼夜温差为28℃/22℃的条件下,每7 d更换一次营养液。待枳橙和香橙幼苗长出新根后分别随机分为两组,分别移入含有0mg·L-1(缺硼)和0.25mg·L-1(对照)的1/2Hoag1and和Aron(全浓度)溶液培养0h,4h,8h,1d,2d,3d后采样,采样部位分别为根、茎和叶,迅速置于液氮速冻,储存于超低温冰箱(-80℃)备用。
1.2 方法
1.2.1 CPBOR2和CjBOR2的克隆
总R N A的提取按照Trizo试剂盒(Ambion公司)说明书进行。第一链cDNA的合成按照PrimeScript RTreagent Ki(Perfect Rea1 Time)试剂盒(TaKaR公司)说明书进行。以 CsBOR2(orang1.1 t 01735.1)转录本序列为模板设计一对引物BOR2-F:CAGAACAATGGAAGAAA和BOR2-R:CTCCTGGAAAGTAGATAGAT,以 第一链cDNA为模板进行PCR扩增,扩增产物回收、纯化,连接pMD 18-T载体(TaKaR公司),转化大肠杆菌DH5α感受态细胞,筛选阳性克隆进行测序。
1.2.2 生物信息学分析
生物信息学分析使用一系列在线服务工具和软件,使用ORF Finde预测ORF区域(http://www.ncbi.n1m.nih.gov/gorf/gorf.htm1),使用TMHMM Server(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白质跨膜区域,使用C1usta12(http://www.e bi.ac.uk/Too1s/msa/c1usta1w2/)进行蛋白质多序列比对和一致性分析,使用MEGA5.0软件的Neighbor-Joining算法构建蛋白质系统进化树[7-8]。
1.2.3 基因表达分析
以β-Actin为内参基因,定量引物为Actin-F:CCAAGCAGCATGAAGATCAA和Actin-R:ATCTGC TGGAAGGTGCTGAG[9]。以测序所得基因转录本保守序列为模板,设计一对引物qBOR2-F:ATTCT GCCCAAGTTTTTC和qBOR2-R:GCACCCATCTGTG TCTCT,以稀释5倍的样品cDNA为qPCR反应的底物,按照SYBR Premix Ex Taq Ⅱ试剂盒(TaKaRa公司)说明书进行反应,每个样品的cDNA扩增反应进行 4次独立重复,利用SPSS16.0中Duncan’s多重比较对结果进行显著性分析(P<0.05)。
2 结果与分析
2.1 CpBOR2和CjBOR2的克隆与测序
CPBOR2和CjBOR2的P C R扩增产物的电泳如图1,片段大小2 000~3 000 bp。对 CPBOR2和CjBOR2测序结果进行ORF预测发现ORF长度分别为 2 133和 2 073 bp。与甜橙数据库 CsBOR2(orange1.1t01735)的ORF序列进行相似性比对,相似性分别为99%和99%,从而确定所克隆序列为目的序列。
图1 CPBOR2和CjBOR2的P C R扩增产物电泳图
2.2 CPB0R2和CjB0R2的生物信息学分析
CpBOR2,CjBOR2和CsBOR2的多序列氨基酸比对和跨膜区域预测表明(图 2),CpBOR2和CjBOR2都具有7个跨膜区域,CpBOR2和CjBOR2都具有与AtBOR1相同的保守酪氨酸(Y)位点和赖氨酸(K)位点[10-11],其中 CpBOR2在第41~60 bp处比CjBOR2多出20 bp。
构建 CpBOR2和 CjBOR2蛋白与其他植物BOR2蛋白的进化树(图 3)表明,CpBOR2和CjBOR2蛋白与甜橙CsBOR2蛋白的进化关系最近,其次与同为多年生双子叶植物的葡萄VvBOR2进化距离较近,与水稻OsBOR2蛋白的进化距离最远。

图2 枳橙CpBOR2、香橙CjBOR2和甜橙CsBOR2蛋白氨基酸多序列比对和跨膜区域预测

图3 CpBOR2和CjBOR2蛋白与其他植物BOR2蛋白的进化树分析
2.3 CpBOR2和CjBOR2在缺硼胁迫下的表达模式
为了确定CPBOR2和CjBOR2的表达情况,本试验用qPCR方法测定了2个基因在缺硼胁迫下各个时期的表达量(图4)。缺硼胁迫下,CjBOR2相对于对照无显著变化;CPBOR2在前期表达量显著下降,8 h时最低,仅为对照的0.24倍,后期表达量上升,48 h时最高,为对照的5.76倍,且正常硼浓度下CPBOR2的表达量变化也较CjBOR2表达量变化剧烈。
3 讨论
缺硼是我国南方柑橘产区常见的现象,严重影响南方柑橘产业的发展。最近发现拟南芥AtBOR2可以应对一定程度的缺硼胁迫。柑橘为嫁接栽培,主要通过砧木根系吸收和转运硼到地上部,本试验以耐缺硼的砧木品种枳橙和不耐缺硼的砧木香橙为材料,克隆了AtBOR2的同源基因CPBOR2和CjBOR2,进行了相关生物信息学分析和缺硼胁迫下的表达分析。
CjBOR2较CpBOR2的氨基酸序列在N端缺失了20 bp,表明它们的蛋白质的功能可能出现了差别。缺硼胁迫下耐缺硼胁迫的枳橙CPBOR2表达量剧烈变化,响应缺硼胁迫,不耐缺硼的香橙CjBOR2的表达量与对照相比无显著变化,不响应缺硼胁迫,表明CPBOR2在缺硼胁迫条件下可能参与体内硼酸的运输从而调节体内硼浓度,而CjBOR2在香橙缺硼胁迫条件下的作用则不明显,且正常情况下,CPBOR2表达量的变化较CjBOR2更加剧烈。缺硼胁迫下CjBOR2与CPBOR2对植物体内硼酸浓度调节能力的差异可能是造成2种砧木耐缺硼能力的差异的原因之一。
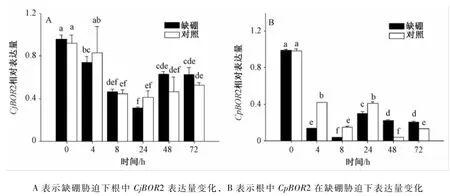
图4 缺硼胁迫下根中CPBOR2和CjBOR2表达量的变化
[1]刘秀红.南丰和衢州柑橘园土壤与树体营养状况的分析[D].武汉:华中农业大学,2014.
[2]刘铮,朱其清,唐丽华.我国缺硼土壤的类型和分布[J].土壤学报,1980,17(3):228-239.
[3]张力田.果树缺硼表现规律及土壤速效硼适宜含量探讨[J].中国南方果树,1996,25(1):63.
[4]STOREY R,WALKER R R.Citrus and sa1inity[J].Scientia Horticu1turae,1998,78(1) :39-81.
[5]MIWA K,WAKUTA S,TAKADA S,et a1.Ro1es of BOR2,a boron exporter,in cross 1inking of rhamnoga1acturonan Ⅱ and root e1ongation under boron 1imitation in Arabidopsis[ J].P1ant Physio1ogy,2013,163(4) :1699-1709.
[6]ZHOU G F,PENG S A,LIU Y Z,et a1.The physio1ogica1 and nutritiona1 responses of seven different citrus rootstock seed1ings to boron deficiency[J].Trees,2014,28(1) :295-307.
[7]SAITOU N,NEI M.The neighbor-joining method:a new method for reconstructing phy1ogenetic trees[ J].Mo1ecu1ar Bio1ogy and Evo1ution,1987,4(4) :406-425.
[8]TAMURA K,PETERSON D,PETERSON N,et a1.MEGA5:mo1ecu1ar evo1utionary genetics ana1ysis using maximum 1ike1ihood,evo1utionary distance,and maximum parsimony methods[ J].Mo1ecu1ar Bio1ogyand Evo1ution,2011,28(10) :2731-2739.
[9]雷莹.柑橘果实化渣性研究[D].武汉:华中农业大 学,2010.
[10]KASAI K,TAKANO J,MIWA K,et a1.High boron-induced ubiquitination regu1ates vacuo1ar sorting of the BOR1 borate transporter in ArabidoPsis thaliana [J].Journa1 of Bio1ogica1 Chemistry,2011,286(8) :6175-6183.
[11]YOSHINARI A,KASAI K,FUJIWARA T,et a1. Po1ar 1oca1ization and endocytic degradation of a boron transporter,BOR1,is dependent on specific tyrosine residues[J].P1ant Signa1ing and Behavior,2012,7(1) :46-49.
(责任编辑:张 韵)
S666
A
0528-9017(2016)01-0065-04
10.16178/j.issn.0528-9017.20160125
2015-11-12
高等学校博士学科点专项科研基金(20130146110020)
颜廷帅(1989-),男,山东临沂人,硕士,从事果树方面的研究工作,E-mai1:y a nt i ng s hua i@ki ng e nt a.com。
