马鞍列岛褐菖鲉Sebasticusmarmoratus栖息地适宜性评价
2016-08-09章守宇汪振华
曾 旭,章守宇,汪振华,林 军,王 凯
上海海洋大学海洋科学学院,上海 201306
马鞍列岛褐菖鲉Sebasticusmarmoratus栖息地适宜性评价
曾旭,章守宇*,汪振华,林军,王凯
上海海洋大学海洋科学学院,上海201306
摘要:为了评估趋礁鱼类在岛礁海域的生境适宜度,选取马鞍列岛的褐菖鲉(Sebasticus marmoratus)为指示物种,以2009年获取的水深、盐度、叶绿素a、浊度和底质数据作为褐菖鲉春、冬季栖息地指示因子,建立栖息地适宜度曲线,并计算各站点的栖息地适宜性指数(HSI)。结果显示:1)绿华、花鸟、嵊山沿岸站点HSI普遍较低,枸杞岛、三横山、东库山沿岸站点褐菖鲉HSI相对较高,其中最大值1.0出现在枸杞岛沿岸的站点;2)春季褐菖鲉幼鱼的适宜水深在6 m左右,成鱼适宜在8—12 m的水深处生存; 冬季褐菖鲉对8—12 m的水深适宜性良好;3)春季所有褐菖鲉的适宜盐度为30PSU,冬季幼鱼的适宜盐度为27—31PSU,成鱼的适宜盐度为27PSU、31PSU;4)随着叶绿素a和浊度值的增大,褐菖鲉适宜性逐渐降低。底质类型为岩时最适合褐菖鲉生存。5)相关分析显示,褐菖鲉丰度与底质类型相关性最大,而与叶绿素a、浊度呈显著负相关。研究结果表明,初级生产力和浑浊程度越高对褐菖鲉丰度抑制越明显。底质类型是褐菖鲉丰度分布的重要影响因子,其中分布有较多大型海藻的岩礁生境是其最适宜的栖息地。利用2010年春、冬季环境调查和渔获数据进行HSI模型验证,资源丰度随HSI值升高而增加,因此构建的模型可用于趋礁鱼类在岛礁海域的栖息地适宜性分析。
关键词:环境因子;褐菖鲉;适宜度曲线;适宜性指数
基于生态系统的管理方法已经成为渔业资源可持续利用的有效途径[1],该方法的重要内容之一就是了解各种生物的栖息地选择和利用规律,即环境因素在不同时空尺度上如何影响这些物种在不同生活史阶段的分布模式[2]。因此研究生物与环境因子间的相互关系可为栖息地的修复和渔业资源可持续利用提供理论依据。而该研究一个重要的实现途径就是利用栖息地适宜性指数(Habitat Suitability Index,HSI)来综合评价一种生物对复杂的动态环境中各种因子的偏好。栖息地适宜性指数模型由美国渔业与野生动物局提出,依据生态学理论构建生境变量与物种间的函数关系,可以量化物种对生态环境变化的响应[3]。HSI在海洋渔业中主要用于渔场预报、资源量评估及生态管理[4- 8]。其中多数研究的时空尺度选择都比较大,这主要与研究对象的长距离大范围洄游性和关键水文遥感数据的可获得性有关。目前国内外对于生境条件较为复杂的群岛水域的水生生物HSI的研究案例并不多见,且已有的案例在评估鱼类栖息地时大多集中于水文条件[9],针对底质和水质因子的研究较少。此外,现有研究在建立鱼类不同生长阶段的单因子适宜度曲线时大多参考已有文献的结果,没有充分考虑时间和空间尺度的差异,必然会对HSI计算结果的准确性产生影响[10]。
马鞍列岛位于浙江省舟山群岛东北部,是舟山渔场的核心部位。该岛群岛礁众多,形成了以岛礁自然地貌和潮间带湿地为主体的岛群海洋生态系统,其较高的空间异质性和生物多样性使一些趋礁性鱼类在此索饵、栖息和繁育[11]。从海洋栖息地的角度来讲岛礁海域属于典型的近岸湿地生境。该生境往往受到多种人类活动的影响,如海岛开发、海水养殖和使用破坏性底拖网捕捞等,使得该海域内局部生境受到严重干扰。近几年,嵊泗海域褐菖鲉(Sebasticusmarmoratus)的种群结构已出现个体小型化趋势[12-13]。虽然褐菖鲉属于定居种,但在区域尺度上,其丰度分布却有较大的空间差异[14]。每年冬春季,褐菖鲉分批在岩礁附近产出仔鱼,繁殖期间,亲鱼、仔鱼不仅受到环境因子的影响,还受到敌害及人类活动的严重损害[15]。因此本研究以褐菖鲉为模式物种,通过分析多种环境因子,建立其春季、冬季对关键环境因子的适宜度曲线并计算各站点的HSI, 由此初步评估其对马鞍列岛岩礁生境的栖息地偏好。并对适宜性模型进行验证,以期为褐菖鲉为代表的趋礁性鱼类的栖息地的保护和修复,以及资源的可持续利用提供理论参考。
1材料与方法
1.1研究区域和站点分布
于2009、2010年春季(3—5月)、冬季(12、1—2月)在马鞍列岛近岸水域进行渔业资源逐月调查,整个研究区域共设置了36个站位(图1),覆盖了马鞍列岛岩礁生境的主要部分。
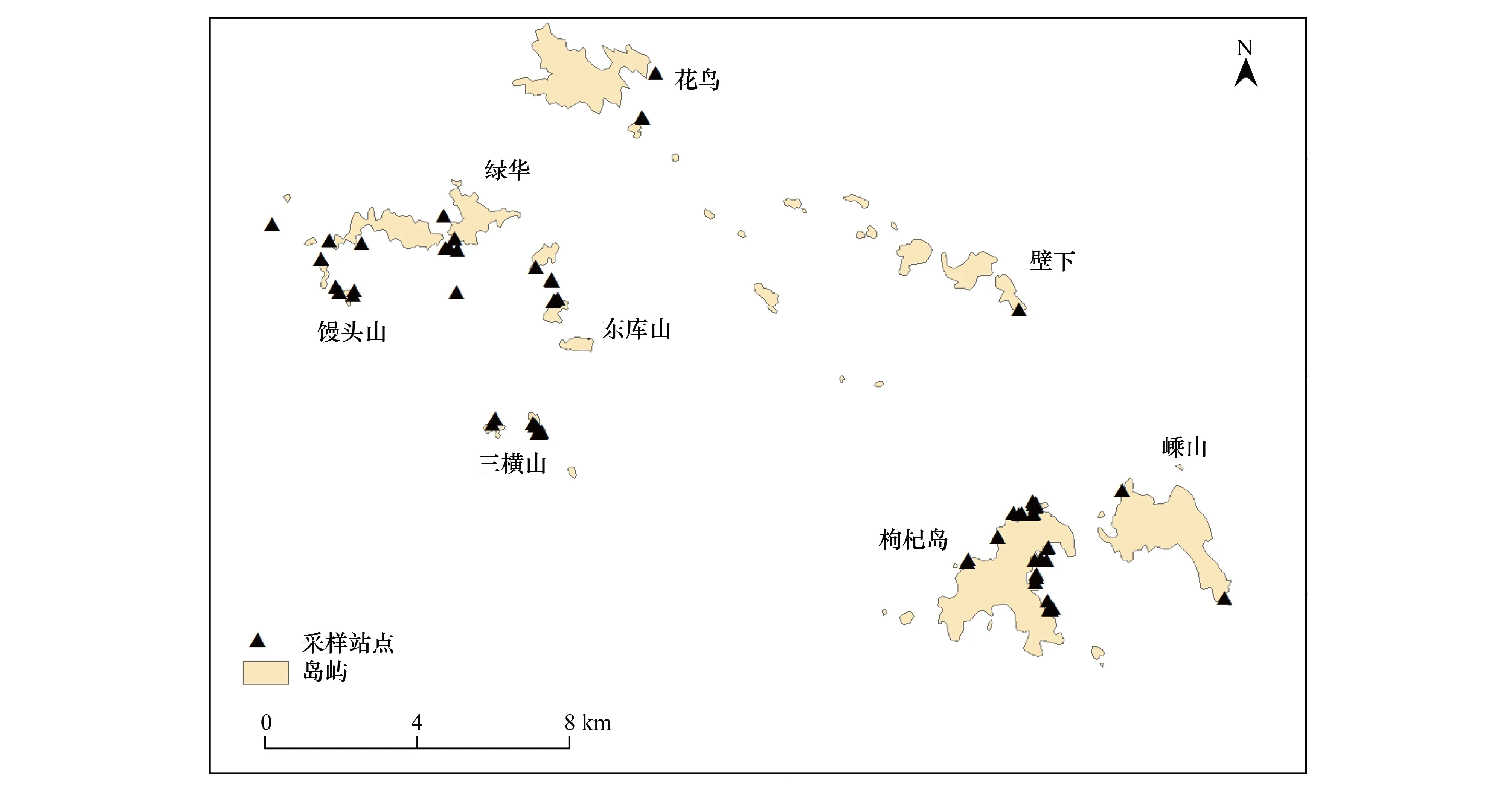
图1 马鞍列岛渔业资源调查采样站点Fig.1 Sampling stations of the fishery survey in the Ma′an Archipelago
1.2数据采集
渔业资源调查网具为定置底层刺网,每个站点随机放置2组。网具参数和组合方法参考汪振华等[16]的研究,其中一组由网高1.5 m,单片网衣长15 m,网目大小25—58 mm的小网;另一组由网高2.4 mm,单片网衣长30 m,网目大小分别为50、60、70 mm和80 mm的中大型网目刺网随机连接而成。网具主要放置在与基岸平行离岸5—30 m的站位。每月进行一次调查,网具放置时间为24 h左右。每次调查时对各站点的褐菖鲉数量计数并测量体长。由于现场采样条件的限制,各站点不同网次放置的时间不同,因此采用每个站点24 h的平均尾数(尾数/站点)表示各站点褐菖鲉的丰度。各站点的水深、水温、盐度、叶绿素a、浊度、溶解氧利用多参数水质测定仪(AAQ1183)与渔业资源调查同步测定。由于褐菖鲉喜栖居于岩礁底层,因此所有水质数据取距底层2 m的平均值[17]。底质现场采集样品,带回实验室自然风干。对于底质为粗大的砾石的站点采用直接测量法测量其底质粒径;对于其他样品,研磨后采用MS2000激光粒度仪测量其粒径。
1.3数据分析
1.3.1环境因子
参考海道测量规范[18]中底质粒径大小,将底质分为沙、泥、粘土、淤泥、石、砾、圆砾、卵石和岩9种类型(表1)。研究表明,温度、盐度、pH、溶氧等环境因子会影响鱼类的性腺发育和仔稚鱼成活率[19],从而影响其丰度。基于此并结合统计分析对2009年调查数据中的上述7个环境因子进行初步筛选,去除没有相关性的环境因子。利用主成分分析(principal component analysis,PCA)筛选剩余因子,选取累积方差贡献率大于75%的主成分,在主成分中选择方差贡献率大于0.5的因子。以上分析均在SPSS 19.0统计建模软件中完成。
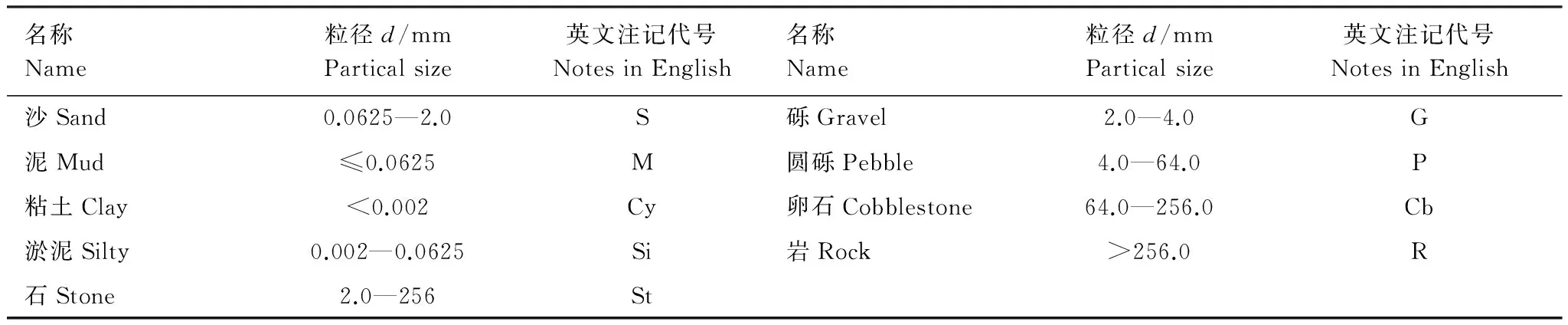
表1 海底底质类型划分
1.3.2栖息地适宜度曲线
栖息地适宜度曲线是物理栖息地特征与某物种在该条件下适合程度的定量描述,该方法被全球超过90%的鱼类栖息地模型所采用[20]。栖息地适宜度曲线的建立依据为历史资料与专家知识或二者结合、数理统计知识[21]。其中由历史资料与专家知识构建的适宜度曲线凭借经验而非数据,可信度不高;而使用测量数据通过数理统计构建的适宜度曲线具有较高的实用性和操作性,因此本研究采用实测数据构建褐菖鲉的栖息地使用模型。吴祖立[22]在研究中指出马鞍列岛褐菖鲉体长大于80 mm开始性成熟,为了分析褐菖鲉不同生长时期对环境因子的适宜性,因此在构建栖息地使用模型时分为幼鱼(体长≤80 mm)和成鱼(体长>80 mm)两个生长阶段。
1.3.3栖息地适宜性模型
由于不同环境因子对褐菖鲉的丰度分布影响程度不同,因此HSI模型采用加权平均法建立[23]:
HSI=K1f1+K2f2+...+Kifi
(1)
式中,Ki为第i个环境因子的权重;fi为第i个环境因子的适宜度SI,SI值从0—1,站点平均丰度最高时,SI为1,表示该范围内的环境最适宜褐菖鲉生存;平均丰度为0时,SI为0,表示该范围内的环境不适合褐菖鲉生存。根据专家经验和调查数据间的相关性大小构建指示因子的判断矩阵[24-25],利用AHP法确定各指示因子的权重。AHP法中现有的标度方法,其“标度”太粗且标度值不能反映方案间的重要程度和关系[26],因此本文采用比例标度构造判断矩阵。
1.3.4HSI模型验证
利用2010年春季和冬季获取的马鞍列岛调查站点的环境资料,计算其HSI值,并与当年研究区域内褐菖鲉丰度分布情况进行比较分析,以验证HSI值越高的站点褐菖鲉丰度越大。
2结果与分析
2.1褐菖鲉丰度分布
2009年春季、冬季调查区域刺网调查渔获物中,褐菖鲉的生物量百分比均占第一位[12],表明褐菖鲉在马鞍列岛的群落格局中占绝对优势,且春季各岛礁周围站点的褐菖鲉丰度大于冬季。图2为褐菖鲉春、冬季在调查站点的丰度平面分布示意图。
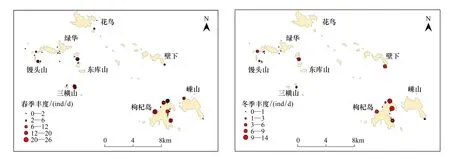
图2 马鞍列岛褐菖鲉春、冬季丰度分布示意图Fig.2 The distribution of abundance for Sebasticus marmoratus in Ma′an Archipelago in the spring and winter
2.2环境因子的选取
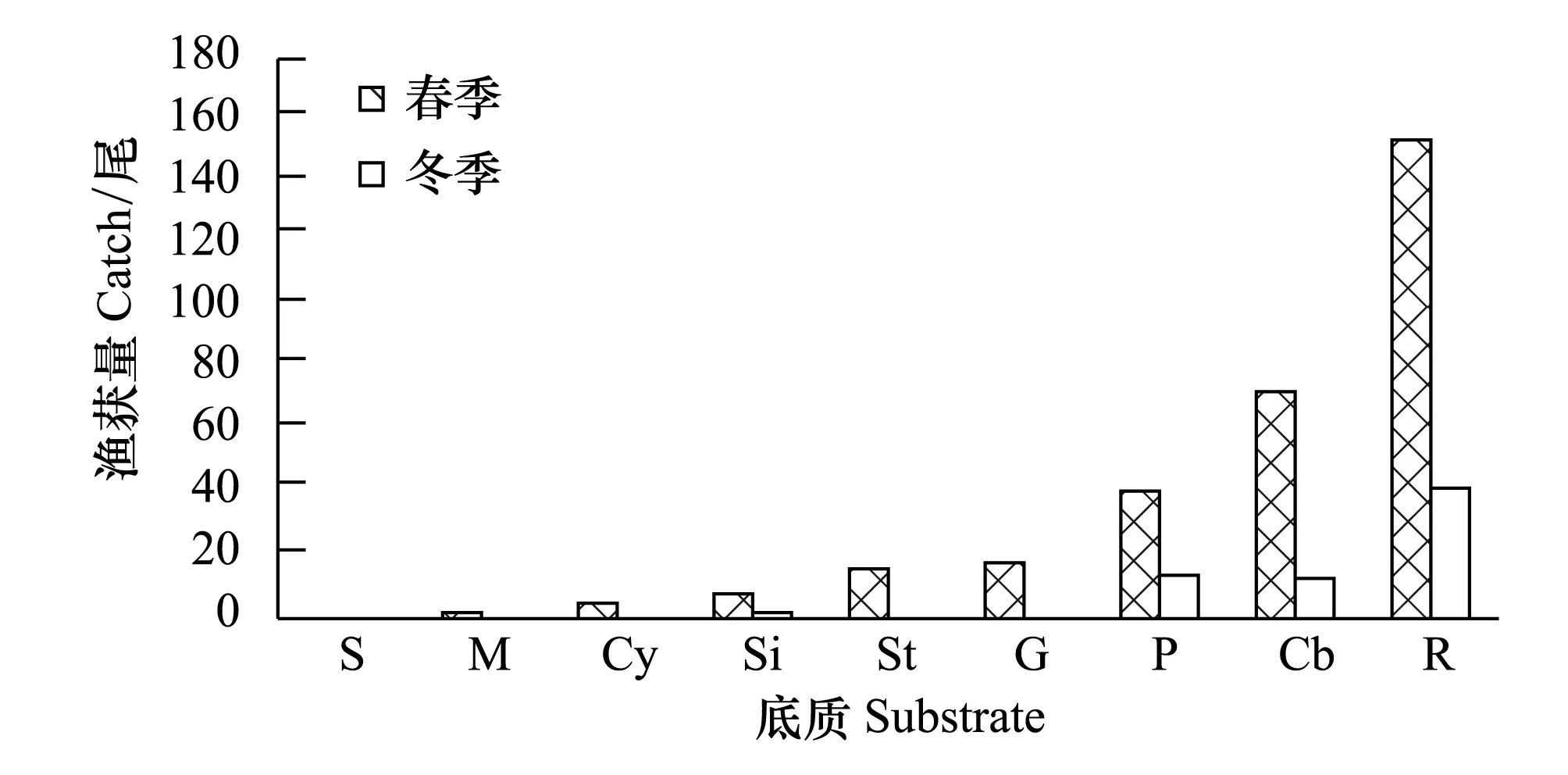
图3 褐菖鲉渔获量分布与底质关系 Fig.3 The relationship between the catch of Sebasticus marmoratus and substrate type
由调查结果显示,研究区域内环境因子具有较大的空间差异,尤其是底质粒径的分布,范围为0.001—300 mm。图3显示了褐菖鲉在不同底质类型中的频数分布。
对褐菖鲉的丰度分布数据进行正态性检验,结果表明其分布不符合正态分布(P<0.05),因此采用Spearman秩相关分析环境因子与褐菖鲉丰度的相关性。由表3可知,除溶解氧外,水深、水温、盐度、叶绿素a、浊度、底质这6个环境因子与褐菖鲉丰度都有显著相关性。
对春季、冬季的6个环境因子进行主成分分析,得到KMO值分别为0.518和0.505,Bartlett球形度检验的sig值均为0,适合作主成分分析。分析结果显示春季、冬季环境因子的前3个主成分的累积贡献率分别达到81.575%和81.805%。因此选取第一、二、三主成分,并对前3个主成分进行正交旋转,得到各个环境因子的贡献率(表4)。结果显示水深、盐度、叶绿素a、浊度和底质5个因子的贡献率大于0.5。水深对鱼类的生存有直接影响,是目前栖息地适宜性评估中最常用的指标[27- 29];在马鞍列岛约550 km2的区域中,褐菖鲉的繁殖和补充会受到盐度差异的影响[14];叶绿素的分布(通常为叶绿素a)是反映海洋生态系统中初级生产力的最简便有效的指标[30];浊度数值的大小反映的是水中分散颗粒的数量,表示一种光学性质[31];褐菖鲉对底质类型又有独特的偏好。综上所述,本文最终选取水深、盐度、叶绿素a、浊度、底质表征褐菖鲉的栖息地。
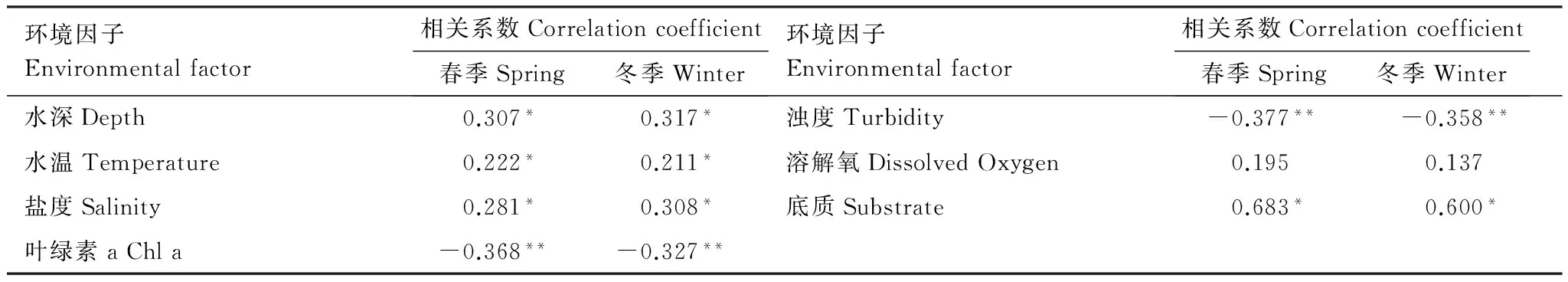
表3 褐菖鲉丰度与环境因子的相关性分析
*P<0.05;**P<0.01
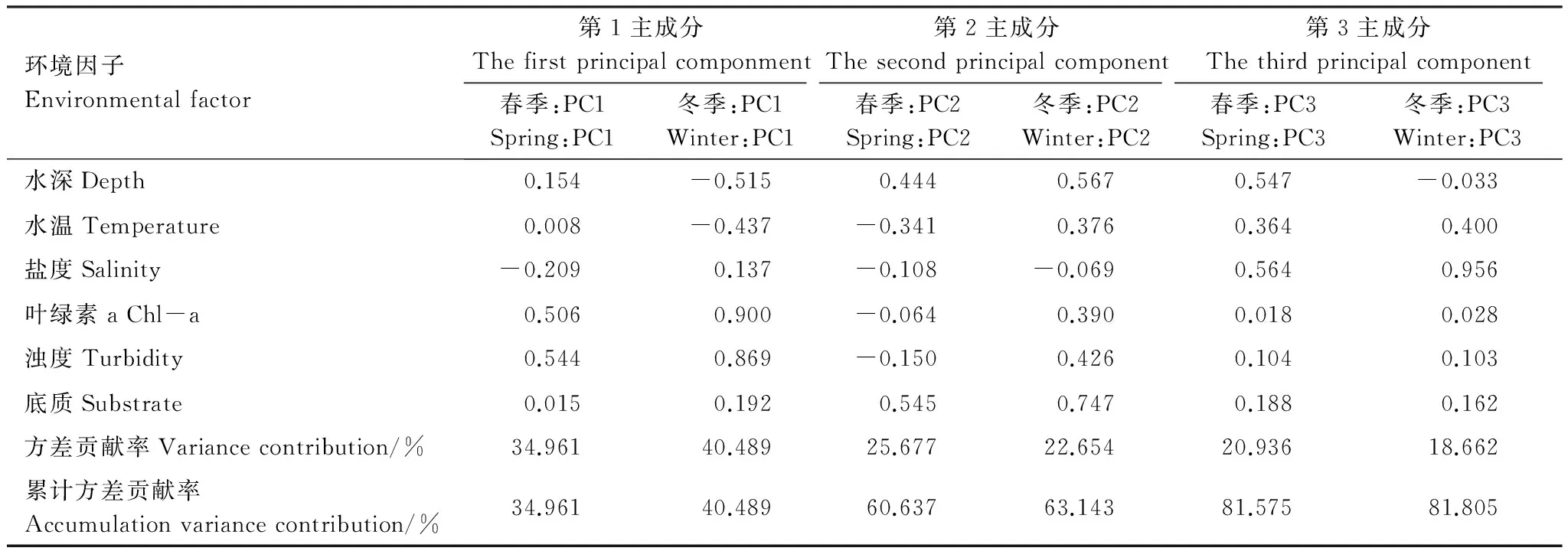
表4 环境因子的主成分分析
2.3栖息地适宜度曲线构建
由实测数据利用频率分布对应褐菖鲉丰度建立其春季、冬季对水深、盐度、叶绿素a、浊度、底质的单因子适宜度曲线(图4)。
1)调查的水深范围为4—18 m,春季褐菖鲉成鱼适宜在8—12 m的范围内生长,而幼鱼的适宜水深在6 m左右;冬季褐菖鲉对8—12 m的水深适宜性较好。
2)春季所有褐菖鲉的适宜盐度为30PSU,冬季褐菖鲉幼鱼的适宜盐度为27—31PSU,成鱼适宜盐度为27PSU、31PSU。
3)叶绿素a范围为20—140mg/L,春季随着其值的增大,褐菖鲉适宜性逐渐降低,达到140mg/L之后没有捕获到褐菖鲉,且幼鱼适宜度指数始终大于成鱼。冬季当叶绿素a值达到40mg/L后,褐菖鲉的适宜性也逐渐降低,大于80mg/L之后,褐菖鲉的适宜性很低。
4)浊度范围为20—300NTU,春季褐菖鲉的适宜性随着浊度值增大而减小,达到300NTU后褐菖鲉不再捕获到。冬季浊度为60NTU时最适合褐菖鲉生长,当其值大于60之后褐菖鲉的适宜性总体逐渐减小。且在春季和冬季,幼鱼的适宜度指数大于成鱼。
5)在春季和冬季,底质类型为岩时最适合褐菖鲉生长,其次是卵石。春季成鱼的适宜度指数大于幼鱼,冬季则相反。
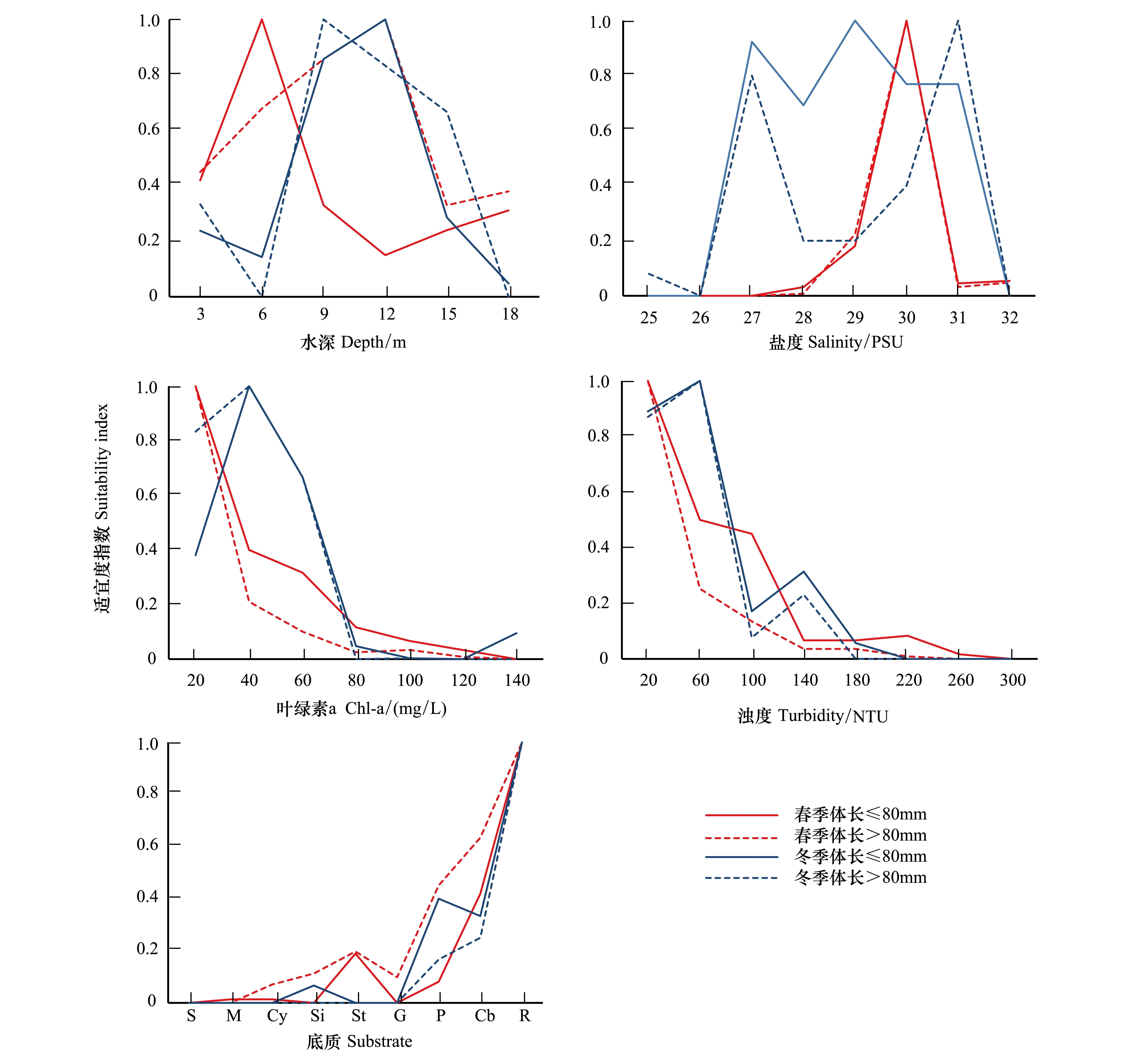
图4 褐菖鲉春季、冬季丰度对水深、盐度、叶绿素a、浊度、底质的适宜度曲线Fig.4 Suitability curves of depth,salinity,chlorophyll a,turbidity and substrate type for Sebasticus marmoratus in the spring and winter
2.4栖息地适宜度指数计算
在相关性分析中,底质与褐菖鲉丰度相关系数最大,因此赋予底质最大的权重;根据表3中的结果,相关性系数浊度>叶绿素a>水深>盐度。因此赋予浊度仅次于底质的权重,叶绿素a的权重次于浊度,水深权重仅次于叶绿素a,盐度权重最小。构建的指示因子判断矩阵如表5所示。矩阵的一致性比率CR=-0.0003<0.1,说明判断矩阵通过了一致性检验。经计算得出,盐度、水深、叶绿素a、浊度、底质的权重依次为0.14、0.17、0.2、0.22、0.28。采用加权平均法计算得出各调查站点的HSI,由图5可知,春季HSI的最大值出现在枸杞岛(GQ)礁周边的站点,其余较高的HSI值出现在三横山(SH)和东库山(DK)周边的站点。冬季HSI的最大值出现在枸杞(GQ)岛礁周边的站点,其余较高HSI出现在壁下(BX)和东库(DK)沿岸站点。
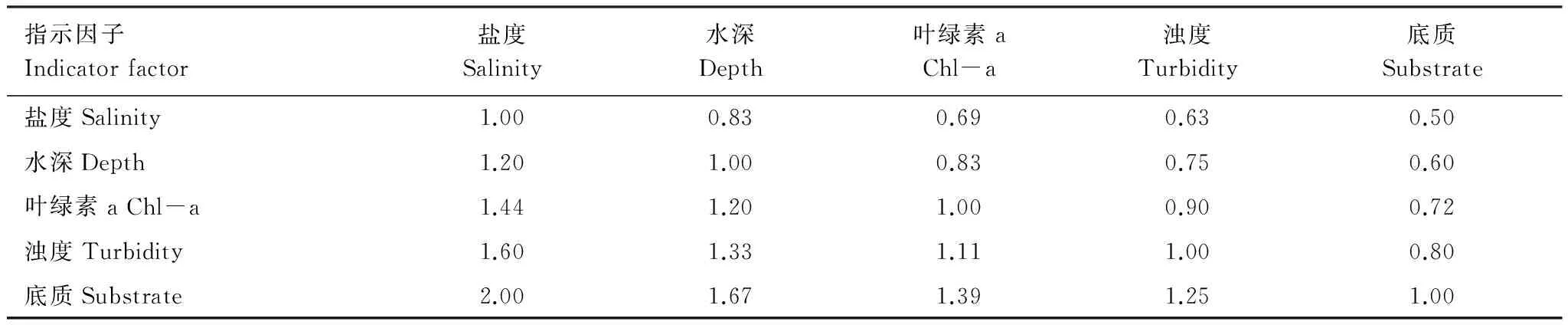
表5 指示因子判断矩阵
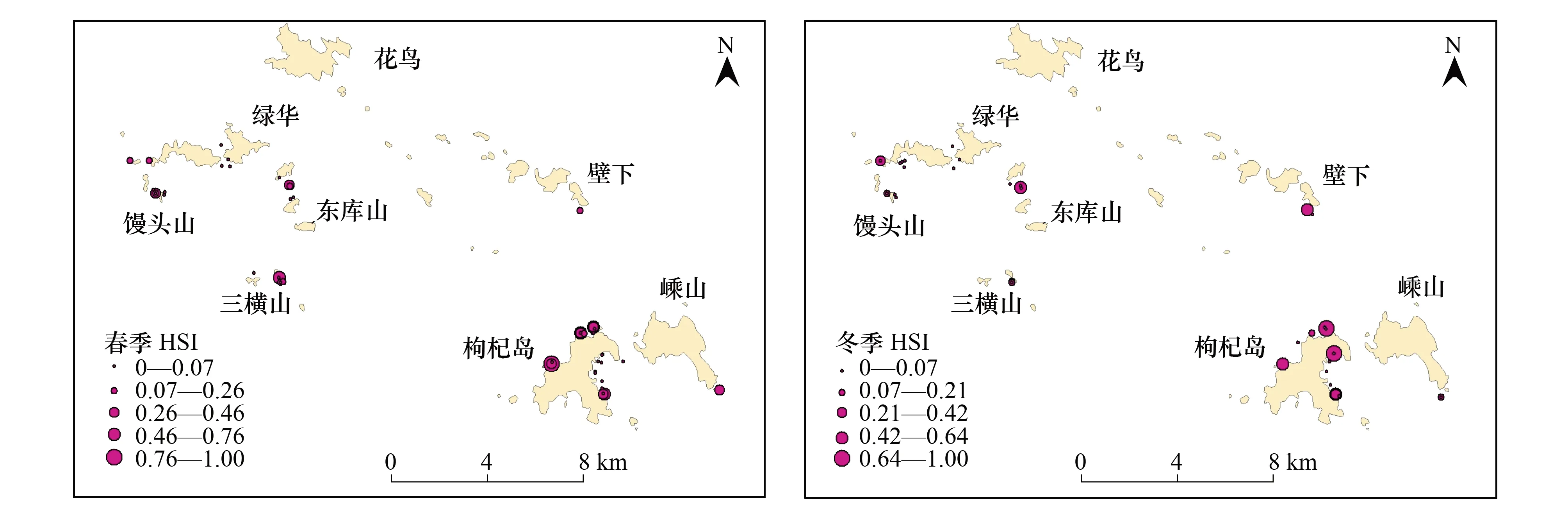
图5 春季、冬季褐菖鲉HSI平面分布图Fig.5 Distribution of Sebasticus marmoratus HSI in the spring and winter
2.5HSI模型验证
利用加权平均法计算2010年春季、冬季各站点的HSI值,各站点HSI与褐菖鲉实际资源丰度相关关系(图6)。分析认为两个季度褐菖鲉资源丰度均与HSI值呈正相关关系,符合本文的假设。春季HSI值在0—1的范围内分布较为均匀,而冬季HSI值主要集中在0—0.6的范围内,且冬季的资源丰度明显低于春季。

图6 2010年春季、冬季褐菖鲉HSI与实测资源丰度间关系Fig.6 The relationship between the HSI and the catch of Sebasticus marmoratus in the spring and winter of 2010
3讨论
3.1栖息地适宜度曲线
本文根据褐菖鲉与环境因子关系的研究[13- 15,19,22, 24-25,32- 36]、专家经验以及褐菖鲉的相关生态习性,利用数理统计筛选出与褐菖鲉丰度分布相关的环境因子。底质类型是解释褐菖鲉空间分布最重要的因子,岩礁底质类型最适合褐菖鲉栖息。底质的差异会对水生动物的生长、捕食[37- 39]等行为造成重要影响。研究发现多数珊瑚礁鱼类的幼鱼在迁徙较长距离后到达近岸栖息地(珊瑚、红树林),可利用栖息地的遮蔽物躲避捕食者[39]。马鞍列岛海域近岸地形结构各异,形成结构十分复杂的微生境,且岩礁底质上着生有绿藻门、褐藻门和红藻门3个门类的底栖海藻,出现的百分比分别为11.8%—22.3%、6.3%—35.3%、52.6%—75%,该底质区域中的褐菖鲉幼鱼可利用岩礁微生境和海藻作为遮蔽物。端足类是褐菖鲉最重要的摄食种类[34],底栖海藻不仅为端足类提供了良好的附着场所,以枸杞岛海藻场为例,夏季附着在铜藻上的端足类数量可达到427个/株,且海藻场中大量的浮游生物和碎屑等可为端足类等底栖生物提供充足的食物。
海洋系统中浊度可能会影响群体之间的互动、觅食行为和躲避捕食者的能力[40]。褐菖鲉幼鱼游泳能力及竞争能力有限,当浊度变大时可能其移动至清水区的速度小于成鱼。另一方面,褐菖鲉幼体在浊度较大的水体中更难被捕食,这可能导致了褐菖鲉成鱼在春季、冬季对浊度的适宜性低于幼鱼。褐菖鲉丰度与叶绿素a呈负相关,这可能是由褐菖鲉饵料生物与初级生产力间相互作用引起的。马鞍列岛海域由长江冲淡水、台湾暖流、浙江沿岸上升流等多种水系交融混合,初级生产力高,有研究发现随着初级生产力的增加,一系列的上升流区浮游植物与食植动物间的转换效率下降[30],意味着褐菖鲉饵料生物端足类对初级生产力的利用效率可能较低。因此较高的初级生产力可能导致了本研究区域中褐菖鲉的饵料生物端足类减少,从而限制褐菖鲉的丰度。
本文研究结果显示春季褐菖鲉幼鱼的适宜水深(6 m)小于成鱼适宜水深(12 m)。底栖海藻的分布受到水深的限制,且主要集中在潮间带低潮区和潮下带浅水区,这造成了以海藻场为主要栖息地的褐菖鲉幼鱼在水深小的区域适宜度高。随着褐菖鲉逐渐性成熟,成鱼移动至离岸深水区产卵。目前褐菖鲉的人工繁育成功率较低,笔者发现饲养者均未考虑水深这一要素的影响。根据本文的研究结果推测,由水深增大而增大的压力或许对卵胎生鱼类的繁殖有益。冬季适宜度模型显示褐菖鲉的适宜水深在8—12 m内,相较于春季更深。这可能是由于春夏季海藻场处于增长繁盛期,可为褐菖鲉提供索饵和避敌场所;而冬季海藻凋亡,褐菖鲉需向深水区寻找新的索饵场造成的。
刘恩生等[41]指出,水质对鱼类栖息地具有重要的影响,在评估鱼类栖息地时,多数学者会将水温和溶解氧作为其中的指示因子。其他大尺度栖息地适宜性模型中[5- 6,8,21,27],水温等环境因子变化梯度大,而本文研究区域大小仅为550 km2,水温空间差异较小(春季(13.7±2)℃;冬季(11.9±1)℃)。而溶解氧各站点平均为8.69 mg/L,符合海水水质一类标准(6 mg/L)[42]。因此水温和溶解氧并未成为表征褐菖鲉栖息地适宜度的指示因子。由于调查时并未测量各站点的流速,而Valentina等[43]在研究中指出流速将对鱼类的生境偏好产生一定的影响,因此HSI的结果可能存在一定的偏差。但是总体来看,栖息地指示因子的选取和适宜度曲线具有良好的指导意义。
3.2栖息地适宜度指数
2009年的数据研究结果显示,花鸟(HN)、壁下(BX)、绿华(LH)、馒头山(MT)和嵊山(SS)沿岸站点褐菖鲉的HSI平均值为0.17,主要是由于这些区域的底质多为沙、泥、石等非岩礁类型,且以上站点浊度和叶绿素a值较高,根据适宜度曲线可以看出不适合褐菖鲉栖息。枸杞岛(GQ)、三横山(SH)和东库山(DK)沿岸站点HSI平均值为0.47,表明褐菖鲉更加偏好这3个区域作为栖息地。一方面,枸杞岛(GQ)、三横山(SH)和东库山(DK)沿岸站点的底质类型主要为岩礁;另一方面,枸杞岛周边存在由铜藻、鼠尾藻、瓦氏马尾藻等大型底栖海藻构成的海藻场。茂盛期海藻总生物量为7.94×106株[44],海藻上附着以海藻和碎屑为食物的麦秆虫、跳钩虾等饵料生物。在海藻场茂盛期和衰退期可供褐菖鲉摄取的食物种类和数量都相对较多[34]。三横山、东库山海域于2004年投放了人工鱼礁[45],鱼礁投放营造的独特生境特征可为褐菖鲉提供栖息摄食环境,对其有一定的诱集效果。由栖息地指示因子的适宜度曲线可以看出,水深9—12 m、盐度30—31 PSU、浊度和叶绿素a越小以及底质类型为岩的站点适合繁殖期褐菖鲉生长,与枸杞岛(GQ)、三横山(SH)和东库山(DK)的生境相符,也与HSI的空间分布相似。冬季马鞍列岛沿岸褐菖鲉HSI空间分布与春季基本一致,但总体上其值比春季小,说明褐菖鲉丰度呈季节性分布。
HSI 模型在使用过程中具有一定的缺陷,不考虑各环境变量的权重便是其中一点[46]。为了更好地分析褐菖鲉栖息地适宜性,本文通过确定各变量权重后建立HSI模型。由2010年数据的实证分析表明,本文建立的HSI模型预测的HSI值与实测渔获量具有良好的正相关关系,也证明了褐菖鲉丰度呈季节性分布的规律。在模型的应用过程中需要注意的是当HSI值为0—0.8时,模型预测效果较好,而当HSI值为0.8—1时模型预测的褐菖鲉丰度将会大于实际丰度。这可能HSI计算结果大部分集中在0—0.8之间,且0.8—1间样本数量较少有关。但总体上本文建立的栖息地适宜性模型能较好地分析褐菖鲉在马鞍列岛的栖息地适宜性,对于保护趋礁性鱼类栖息地具有实际意义。
致谢:赵静、许敏、陈清满提供调查数据,梁金玲、陈亮然、徐胜南帮助撰写,特此致谢。
参考文献(References):
[1]Link J S.Ecological considerations in fisheries management:When does it matter?. Fisheries, 2002,27(4):10- 17.
[2]Mcconnaughey R A,Smith K R.Associations between flatfish abundance and surficial sediments in the eastern Bering Sea.Canadian Journal of Fisheries and Aquatic Sciences, 2000, 57(12): 2410- 2419.
[3]金龙如,孙克萍,贺红士,周宇飞.生境适宜度指数模型研究进展.生态学杂志,2008,27(5): 841- 846.
[4]Fu B H, Guillaume J H A. Assessing certainty and uncertainty in riparian habitat suitability models by identifying parameters with extreme outputs. Environmental Modelling & Software, 2014,60(10):277- 289.
[5]Lee P F, Chen I C, Tzeng W N. Spatial and temporal distribution patterns of bigeye tuna(Thunnusobesus) in the Indian Ocean.Zoological Studies,2005,44(2):260- 270.
[6]冯波,田思泉,陈新军.基于分位数回归的西南太平洋阿根廷滑柔鱼栖息地模型研究.海洋湖沼通报,2010,(1):15- 22.
[7]Nishida T, Bigelow K, Mohri M, Marsac F. Comparative study on japanese tuna longline cpue standardization of yellowfin tuna(Thunnusalbacares) in the indian ocean based on two methods:General linear model(GLM) and habitat-based model(HBM)/GLM combined-(1958- 2001).IOTC Proceedings,2003,(6):48- 69.
[8]Uenaka T, Sakamoto N, Koyamada K. Visual analysis of habitat suitability index model for predicting the locations of fishing grounds // 2014 IEEE Pacific Visualization Symposium (PacificVis).Yokohama:IEEE,2014:306-310.
[9]杨刚,张涛,庄平,侯俊利,王妤,宋超,章龙珍.长江口棘头梅童鱼幼鱼栖息地的初步评估.应用生态学报,2014,25(8):2418- 2424.
[10]康鑫,张远,张楠,丁森,孟伟,李向东.太子河洛氏鱥幼鱼栖息地适宜度评估.生态毒理学报, 2011,6(3):310- 320.
[11]Aarnio K, Mattila J. Predation by juvenilePlatichthysflesus(L.) on shelled prey species in a bare sand and a drift algae habitat.Hydrobiologia,2000,440(1/3):347- 355.
[12]汪振华,章守宇,陈清满,许强,王凯.马鞍列岛岩礁生境鱼类群落生态学.I.种类组成和多样性.生物多样性,2012,20(1):41- 50.
[13]章守宇,汪振华,林军,王伟定.枸杞岛海藻场夏、秋季的渔业资源变化.海洋水产研究,2007, 28(1):45- 52.
[14]汪振华,赵静,王凯,章守宇.马鞍列岛岩礁生境鱼类群落结构时空格局.生态学报,2013, 33(19):6218- 6226.
[15]吴常文.若干环境因子对褐菖You仔鱼存活率的影响.浙江海洋学院学报:自然科学版, 2000,19(1):12- 16.
[16]汪振华,王凯,赵静,章守宇.枸杞岛潮下带沙地生境鱼类群落结构和季节变化.应用生态学报,2011,22(5):1332- 1342.
[17]Parasiewicz P.MesoHABSIM:A concept for application of instream flow models in river restoration planning.Fisheries,2001,26(9):6- 13.
[18]国家质量技术监督局.GB12327- 1998海道测量规范.北京:中国标准出版社,2004.
[19]高明良.褐菖鲉早期仔鱼的生态因子最适范围研究[D].福州:福州大学,2006.
[20]易雨君.长江水沙环境变化对鱼类的影响及栖息地数值模拟[D].北京:清华大学,2008.
[21]龚彩霞,陈新军,高峰,官文江,雷林.栖息地适宜性指数在渔业科学中的应用进展.上海海洋大学学报,2011,20(2):260- 269.
[22]吴祖立,汪振华,王凯,章守宇.马鞍列岛趋礁鱼类褐菖生物学特性初步研究.广东农业科学, 2012,(12):133- 137.
[23]Brown S K, Buja K R, Jury S H, Monacoa M E, Bannerb A. Habitat suitability index models for eight fish and invertebrate species in Casco and Sheepscot Bays, Maine. North American Journal of Fisheries Management,2000,20(2):408- 435.
[24]沈庞幼,徐善良,邱成功,王腾飞.温度和盐度对褐菖鲉仔鱼心率和成活率的影响.河北渔业, 2014,(10):4- 6.
[25]王志铮,吴常文,侯伟芬,严世强.褐菖鲉仔、稚鱼生长特性及其关键变态期的研究.海洋科学, 2002,26(5):1- 4.
[26]黄德才,胥琳.AHP法中判断矩阵的比例标度构造法.控制与决策,2002,17(4):484- 486.
[27]Monaghan K A, Soares A M V M. The bioassessment of fish and macroinvertebrates in a Mediterranean-Atlantic climate:Habitat assessment and concordance between contrasting ecological samples.Ecological Indicators,2010,10(2):184- 191.
[28]李凤清,蔡庆华,傅小城,刘建康.溪流大型底栖动物栖息地适合度模型的构建与河道内环境流量研究:以三峡库区香溪河为例.自然科学进展,2008,18(12):1417- 1424.
[29]郑丙辉,张远,李英博.辽河流域河流栖息地评价指标与评价方法研究.环境科学学报,2007, 27(6):928- 936.
[30]唐尧基,游文玮,陈莹,李耀群.同步荧光法测定海水中叶绿素a的含量.分析仪器,2004,(3): 24- 26.
[31]张晓晶,李畅游,贾克力,邬铁梅,李卫平.乌梁素海水体透明度分布及影响因子相关分析. 湖泊科学,2009,21(6):879- 884.
[32]杜佳垠.褐菖鮋生态学特点与增养殖进展.海鲜世界,2005,(6):54- 58.
[33]汪振华,章守宇,王凯.三横山鱼礁生境鱼类和大型无脊椎动物群落特征.生态学报,2010, 30(8):2026- 2035.
[34]王凯,章守宇,汪振华,许敏,赵静,王蕾.枸杞岛海藻场褐菖鲉的摄食习性.水产学报,2010, 34(2):227- 235.
[35]许明海.褐菖鲉渔业生物学初步研究.福建水产,1999,(2):42- 48.
[36]周永东,金海卫,张洪亮,蒋日进,潘国良.浙江南部沿岸产卵场春、夏季鱼卵、仔稚鱼种类组成与分布.海洋与湖沼,2013,44(3):590- 598.
[37]Nakamura Y, Shibuno T, Lecchini D, Watanabe Y. Habitat selection by emperor fish larvae. Aquatic Biology,2009,6(1/3):61- 65.
[38]Martin S D, Harris B A,Collums J R, Bonett R M. Life between predators and a small space: substrate selection of an interstitial space-dwelling stream salamander.Journal of Zoology,2012, 287(3):205- 214.
[39]Horstkotte J, Plath M. Divergent evolution of feeding substrate preferences in a phylogenetically young species flock of pupfish (Cyprinodonspp.).Naturwissenschaften,2008, 95(12):1175- 1180.
[40]Aksnes D L, Nejstgaard J, Soedberg E, Sørnes T. Optical control of fish and zooplankton populations.Limnology and Oceanography,2004,49(1):233- 238.
[41]刘恩生.鱼类与水环境间相互关系的研究回顾和设想.水产学报,2007,31(3):391- 399.
[42]国家ZF境保护局.GB 3097- 1997海水水质标准.北京:环境科学出版社,1997.
[43]Lauria1 V, Vaz1 S, Martin1 C S, Mackinson S, Carpentier1 A. What influences European plaice(Pleuronectesplatessa) distribution in the eastern English Channel? Using habitat modelling and GIS to predict habitat utilization.ICES Journal of Marine Science,2011,68(7):1500- 1510.
[44]孙宏超.枸杞岛海藻场生态系统初步研究[D].上海:上海水产大学,2006.
[45]王伟定,梁君,章守宇.人工鱼礁建设对浙江嵊泗海域营养盐与水质的影响.水生生物学报, 2010,34(1):78- 87.
[46]Eastwood P D, Meaden G J. Introducing greater ecological realism to fish habitat models. GIS/spatial analyses in fishery and aquatic science, 2003,2:181- 198.
基金项目:国家自然科学基金项目(41176110,41406153)
收稿日期:2015- 06- 01;
修订日期:2016- 02- 01
*通讯作者
Corresponding author.E-mail: Syzhang@shou.edu.cn
DOI:10.5846/stxb201506011097
Habitat suitability assessment ofSebasticusmarmoratusin the rocky reef region of the Ma′an Archipelago
ZENG Xu, ZHANG Shouyu*, WANG Zhenhua, LIN Jun, WANG Kai
CollegeofMarineSciences,ShanghaiOceanUniversity,Shanghai201306,China
Abstract:In this study, we selected Sebasticus marmoratus as an indicator species to evaluate the habitat suitability of rocky reef fishes in the Ma′an Archipelago. Indicator factors of S. marmoratus′s habitat (i.e. water depth, salinity, chlorophyll a, turbidity, and substrate) were obtained in the spring and winter of 2009. Subsequently, a suitability curve was developed and the Habitat Suitability Index (HSI) of S. marmoratus at each sampling site was calculated. It is shown from the results that: 1) The HSI of alongshore sites around the Lvhua, Huaniao, and Shengshan Islands are generally low, while those around the Gouqi, Sanheng, and Dongku Islands are relatively high, with the maximum (1.0) recorded at the sites around the Gouqi Island; 2) The most suitable water depths in spring are 6 and 8—12 m for the juvenile and adult S. marmoratus, respectively, while during winter, the latter depth is mostly inhabited by S. marmoratus; 3) For spring, the suitable salinity was 30 PSU for all size groups, whereas in winter, it ranges from 27 to 31 PSU for juveniles,and appear to be 27 and 31 PSU for adults; 4) The suitability decreases with increasing chlorophyll a and turbidity, noting the most suitable substrate type as rocky bottom; 5) Correlation analysis shows that the abundance of S. marmoratus is highest correlated with sediment type but negatively correlated with both chlorophyll a and turbidity. The results imply that high primary productivity and turbidity may significantly reduce the S. marmoratus population size. Substrate type is the most important factor for S. marmoratus distribution. In particular, the rocky reef habitat occupied by kelp was the best living environment for S. marmoratus. Finally, we verified the HSI model with data from our surveys and fishery production in spring and winter of 2010, which shows that S. marmoratus abundance increases with higher HSI values. Therefore, we are confident that the HSI model we constructed is applicable for assessing the habitat suitability of rocky fishes in rocky reef areas.
Key Words:environmental factors; Sebasticus marmoratus; suitability curve; HSI
曾旭,章守宇,汪振华,林军,王凯.马鞍列岛褐菖鲉Sebasticusmarmoratus栖息地适宜性评价.生态学报,2016,36(12):3765- 3774.
Zeng X, Zhang S Y, Wang Z H, Lin J, Wang K.Habitat suitability assessment ofSebasticusmarmoratusin the rocky reef region of the Ma′an Archipelago.Acta Ecologica Sinica,2016,36(12):3765- 3774.
