酸敏感离子通道在过敏性紫癜肾炎和IgA肾病肾组织中的表达及意义
2016-08-09彭启迪袁丽萍
彭启迪,袁丽萍,邓 芳,胡 波,鹿 玲,桂 明
酸敏感离子通道在过敏性紫癜肾炎和IgA肾病肾组织中的表达及意义
彭启迪,袁丽萍,邓 芳,胡 波,鹿 玲,桂 明
目的 观察酸敏感离子通道(ASICs)在过敏性紫癜肾炎(HSPN)、IgA肾病(IgAN)肾组织中的表达及其与肾脏病理损伤的关系。方法 收集HSPN患者13例、IgAN患者11例、正常对照组7例,肾穿刺取肾组织进行蜡块包埋处理。采用免疫组化法观察HSPN、IgAN患者肾脏组织中ASIC1、ASIC2、ASIC3的表达情况,采用平均积分光密度(IOD)值分析ASICs在肾组织中的表达情况,同时分析ASICs表达与肾脏病理损伤的关系。结果 ①免疫组化显示HSPN、IgAN患者肾脏组织中ASIC1、ASIC2、ASIC3主要表达在肾小管,少量表达于肾小球;②HSPN与IgAN组肾脏组织ASIC1、ASIC2、ASIC3表达量较正常对照组明显增多(P<0.01),IgAN组较HSPN组ASIC1、ASIC2表达量增多(P<0.05);③HSPN组和IgAN组ASICs表达量、24 h尿蛋白定量在病理分级Ⅲ级比Ⅱ级显著增多(P<0.01);④HSPN组
网络出版时间:2016-3-8 8:29:02 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.056.htm l中ASIC1表达量与24 h尿蛋白定量呈正相关性(r=0.788,P<0.05);IgAN组中ASIC1表达量与24 h尿蛋白定量呈正相关性(r=0.716,P<0.05)。结论 ASICs在HSPN、IgAN肾组织均有表达,尤其是肾小管,其表达量与病理损伤和尿蛋白有一定关系,推测其可能参与了HSPN、IgAN肾脏病理损伤过程。
过敏性紫癜肾炎;IgA肾病;酸敏感离子通道;肾组织
酸敏感离子通道(acid-sensing ion channels,ASICs)是一类由胞外酸化所激活的阳离子通道,属于上皮钠通道/退行素(Deg/EnaC)超家族,在神经系统、骨、心血管、膀胱中广泛表达。迄今已发现由4个不同基因编码的6个亚基即ASIC1a、ASIC1b、ASIC2a、ASIC2b、ASIC3、ASIC4,亚基之间可形成同聚体或异聚体并表现出不同的通道特性、电流表型、离子选择性[1-2]。研究[3]证实炎症刺激可促进多种ASICsmRNA的表达。过敏性紫癜(Henoch-Schnlein purpura,HSP)是由IgA介导的小血管炎,HSP引起的肾损害,称为紫癜性肾炎(Henoch-Schönlein purpura nephritis,HSPN),是常见的继发性肾脏病,为免疫复合物的沉积和补体活化引起肾小球和间质的一系列炎症反应。IgA肾病(IgA nephropathy,IgAN)是最常见的原发性肾小球疾病,主要是肾小球系膜区IgA或IgA为主的免疫复合物沉积。IgAN存在炎症因子增加,且能进一步加重其肾脏损伤的程度[4]。HSP皮肤血管内皮细胞存在ASIC1a和ASIC3的表达[5],但是ASICs在肾脏组织中的表达的报道甚少。该研究拟用免疫组化法观察ASICs在HSPN、IgAN肾脏组织中的表达,初步探讨ASICs是否参与了HSPN、IgAN肾脏损伤的病理过程。
1 材料与方法
1.1 病例资料 选取安徽医科大学第一附属医院2014年1月~12月住院的HSPN患者13例(HSPN组),其中男5例,女8例;年龄8~29(20.08± 6.96)岁;IgAN患者11例(IgAN组),其中男4例,女7例;年龄10~31(25.27±3.58)岁;正常对照组7例(我院病理科正常肾组织标本),其中男5例,女2例;年龄8~28(21.57±7.98)岁,各组间年龄、性别构成差异无统计学意义。用2%利多卡因进行分层浸润麻醉,肾穿针在B超引导下进针达肾表面,连接穿刺枪获取1 cm长肾组织小柱。肾穿组织进行蜡块包埋处理。
1.2 试剂与仪器 兔抗ASIC1、ASIC2、ASIC3多克隆抗体(英国abcam公司);免疫组化试剂盒和DAB显色剂(北京中杉金桥生物技术有限公司)。
1.3 方法
1.3.1 免疫组化法检测肾脏组织中ASICs表达
按免疫组化试剂盒操作说明检测HSPN、IgAN患者肾脏组织中ASIC1、ASIC2、ASIC3的表达。用已知阳性反应片做阳性对照,设PBS替代一抗做阴性对照。以肾小管上皮细胞胞质和胞膜呈棕黄色为阳性细胞,每张切片随机观察5个400倍物镜视野。应用Image-Pro Plus图像分析软件系统(美国Media Cybernetics公司)对免疫组化结果进行图像分析。400倍视野下每张切片随机选取5个视野(每个视野包含1个肾小球)。应用Image-Pro Plus图像分析软件测定每个视野中肾小球及肾小管间质区ASICs积分光密度(integral optical density,IOD)值,计算其平均值,即该患儿肾组织ASICs表达水平。
1.3.2 临床及病理分级标准 HSPN组临床分型参考国内2009年试行指南[6]:①孤立性血尿型;②孤立性蛋白尿型;③血尿和蛋白尿型;④急性肾炎型;⑤肾病综合征型;⑥急进性肾炎型;⑦慢性肾炎型;HSPN组ISKDC病理分级按中华医学会儿科学分会肾脏病学组修订的国际儿童肾脏病研究中心(ISKDC)分类标准[6];IgAN组病理诊断和分型标准主要参照Lee分级[7]。临床分型分为肾炎综合征、肾病综合征、单纯血尿(包括镜下血尿和肉眼血尿)和肾功能不全(≥CKD 3期)。
1.4 统计学处理 采用SPSS 16.0软件进行分析,计量资料采用±s表示。不同病理级别组间ASICs表达量、24 h尿蛋白定量比较采用t检验,各组间年龄、ASICs表达量采用方差分析,各组间性别构成比较采用χ2检验,相关性分析采用Pearson相关分析。
2 结果
2.1 各组性别、年龄构成比较情况 各组间年龄、性别构成差异无统计学意义(F=1.805,χ2= 2.530)。
2.2 各组肾脏组织ASICs表达情况 HSPN组肾脏组织中可以看到ASIC1、ASIC2、ASIC3在肾小管上皮细胞胞质和胞膜及肾小球表现为染成棕褐色的颗粒,染色强度明显加深,阳性肾小管数明显增多。IgAN组肾脏组织中可以看到ASIC1、ASIC2、ASIC3在肾小管上皮细胞胞质和胞膜及肾小球表现为染成棕褐色的颗粒,染色强度显著加深,阳性肾小管数显著增多。正常对照组肾脏组织中可以看到ASIC1、ASIC2、ASIC3在肾小管细胞胞质和胞膜表现为染成浅棕色或者黄色的颗粒,染色强度较HSPN及IgAN组浅,阳性肾小管数也较之少。见图1。HSPN、IgAN组中ASIC1、ASIC2、ASIC3表达量均较正常对照组明显增多,差异有统计学意义(P<0.01),IgAN组较HSPN组ASIC1、ASIC2表达量也增多,差异有统计学意义(P<0.05),见表1。
2.3 HSPN和IgAN组的临床及病理分型 HSPN
组临床分型主要为血尿和蛋白尿型13例,急性肾炎型5例及慢性肾炎型8例;病理分型主要为ISKDCⅡ和Ⅲ级,其中ISKDCⅡ级 7例,Ⅲ级6例。IgAN组临床分型主要为肾炎综合征8例,肾病综合征1例,肾功能不全2例;病理类型为LeeⅡ和Ⅲ级,其中LeeⅡ级2例,Ⅲ级9例。
2.4 ASICs表达量、24 h尿蛋白定量在不同病理类型的区别
2.4.1 ASICs表达与病理的关系 HSPN组ASIC1表达量、24 h尿蛋白定量在ISKDCⅢ级比ISKDCⅡ级显著增多,差异有统计学意义(P<0.01),见表2。IgAN组ASIC1、ASIC2、ASIC3表达量、24 h尿蛋白定量在LeeⅢ级较LeeⅡ级显著增多,差异有统计学意义(P<0.01),见表2。
2.4.2 ASICs表达量与24 h尿蛋白定量的关系HSPN组中ASIC1表达量与24 h尿蛋白定量呈正相关性(r=0.788,P<0.05),IgAN组中ASIC1表达量与24 h尿蛋白定量呈正相关性(r=0.716,P<0.05),见图2。
表1 肾组织中 ASICs表达定量分析(±s)

表1 肾组织中 ASICs表达定量分析(±s)
与正常对照组比较:**P<0.01;与 HSPN组比较:#P<0.05
项目 正常对照组(n=7) HSPN组(n=13) IgAN组(n=11) F值 P值ASIC1 17.171±7.047 82.804±37.724** 123.390±45.045**#17.942 0.000 ASIC2 29.032±15.532 66.345±35.582** 131.210±49.405**# 16.861 0.000 ASIC3 19.307±11.038 100.810±58.558** 124.660±53.661**9.845 0.001
表2 不同病理类型的肾组织 ASICs表达量、24 h尿蛋白定量分析(±s)
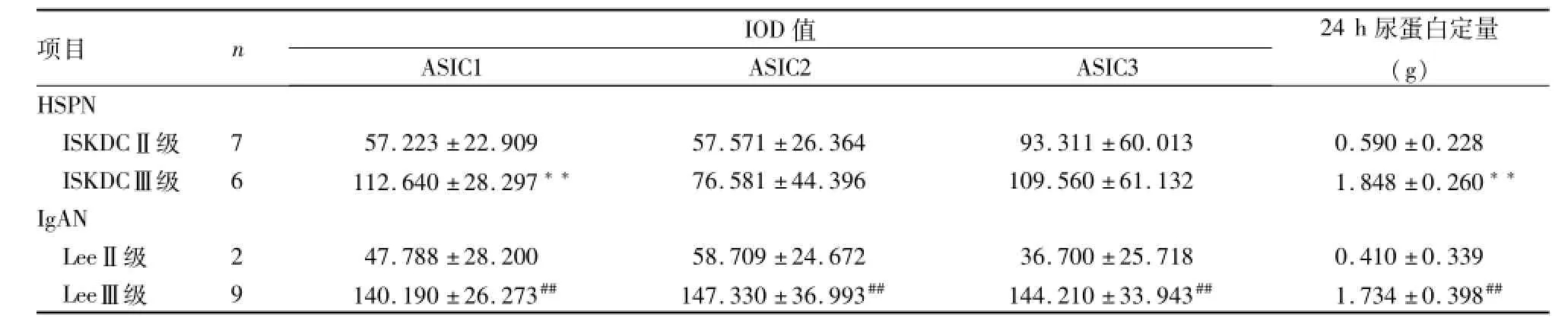
表2 不同病理类型的肾组织 ASICs表达量、24 h尿蛋白定量分析(±s)
与ISKDCⅡ级比较:**P<0.01;与 LeeⅡ级比较:##P<0.01
项目 n IOD值ASIC1 ASIC2 ASIC3 24 h尿蛋白定量(g)HSPN ISKDCⅡ级 7 57.223±22.909 57.571±26.364 93.311±60.013 0.590±0.228 ISKDCⅢ级 6 112.640±28.297** 76.581±44.396 109.560±61.132 1.848±0.260**IgAN LeeⅡ级 2 47.788±28.200 58.709±24.672 36.700±25.718 0.410±0.339 LeeⅢ级 9 140.190±26.273## 147.330±36.993## 144.210±33.943## 1.734±0.398##
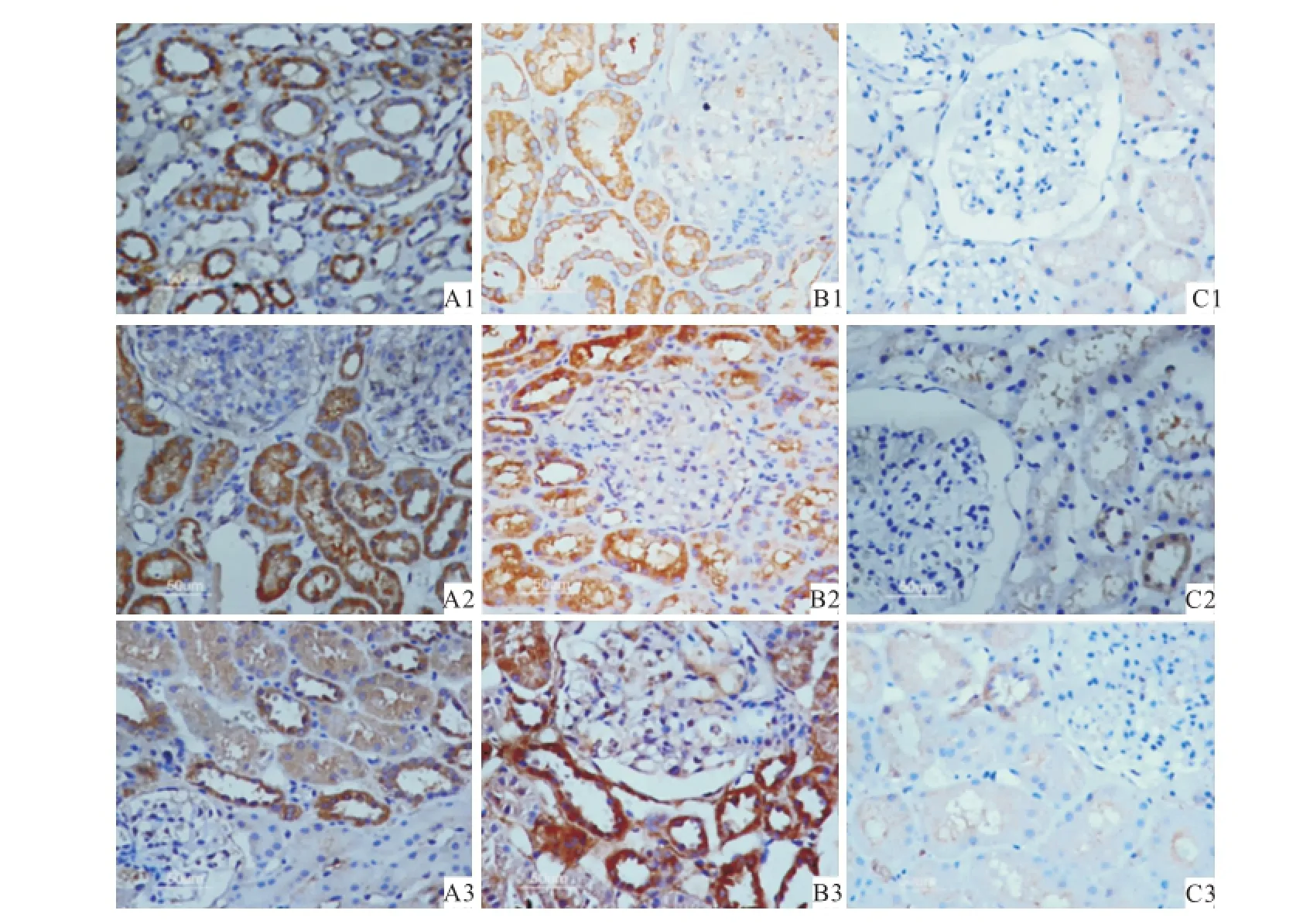
图1 肾组织ASIC1、ASIC2、ASIC3的表达 免疫组化×400A:HSPN组;B:IgAN组;C:正常对照组;1:ASIC1;2:ASIC2;3:ASIC3
3 讨论
HSPN是HSP的主要表现之一,是儿科最常见的继发性肾小球疾病之一,儿童较成人自限性及预后较好,但仍可能呈现慢性进展,最终发展为终末期肾脏病而要接受肾脏替代治疗。
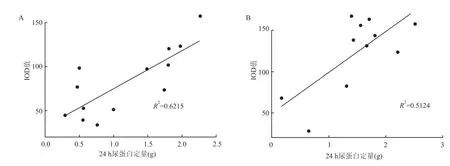
图2 ASIC1与24 h尿蛋白定量的关系A:HSPN组;B:IgAN组
IgAN是一种常见的肾小球疾病,在我国其发病率约占原发肾小球肾炎的25%~33%,也是引起终末期肾脏功能衰竭最常见原因之一。研究[8]表明,其是一组进展性疾病,约有15%~40%患者发展为终末期肾脏病而不得不接受肾脏替代治疗。
IgA在肾小球系膜区的沉积引起系膜细胞增生及上皮细胞新月体形成是两者共同的病理变化特点,两者临床表现多种多样,研究[9]报道IgAN可以进展为HSPN,甚至认为两者是同一种疾病的不同临床表现,但是两者在临床表现、病理类型等方面仍有差别[10],研究[11]表明HSPN是急性病理过程及预后与肾小球损害程度有关,而 IgAN是慢性进展性肾小球疾病,两者均伴有不同程度的肾小管病变,但以IgAN更多见、更严重,且是肾脏损伤潜在的机制,尚未完全阐明。
ASICs表达于多种器官及组织,其在脑缺血、肿瘤等伴有局部组织酸化的病理过程中发挥重要作用。炎症常伴有组织酸化,HSP皮肤血管内皮细胞存在ASIC1a和ASIC3表达,其可能参与了皮肤血管损伤的过程[5]。肾脏组织是对酸碱度变化非常敏感的器官并且能够通过一系列机制来感受和精准地调节机体酸碱度来维持系统和局部组织的酸碱平衡,HSPN、IgAN肾脏组织都发生了炎症改变,IgA的沉积加重了炎症细胞浸润,炎症介质分泌量增加,局部组织pH值下降,Brown etal[12]认为ASICs可能是肾小管感受pH变化的感受器之一,另外Tilmann et al[13]认为肾脏肽能传入神经元与肾炎的肾脏损伤有关,而神经元上的ASICs感受胞外pH下降进而将信号传入神经元后引起肾脏的损伤。众多学者研究[14]已经证实蛋白尿水平是评估肾脏损伤严重程度及预后的重要指标,病理类型与病情严重程度存在一定相关性,本文也证实病理类型级别高的蛋白尿定量水平高于病理类型级别较低者。本研究显示ASIC1、ASIC2、ASIC3在HSPN、IgAN肾脏组织中均有表达,以肾小管为主,少量表达于肾小球,较正常肾组织表达量显著增多,并且病理类型越重,ASICs表达量越多;IgAN组比HSPN组ASIC1和ASIC2表达量多,差异有统计学意义,由此笔者推断ASICs也可能参与了HSPN、IgAN肾脏损伤的过程。
体外研究显示,肾小球受损滤过的尿蛋白进入肾小管,血浆蛋白里的成分可刺激肾小管上皮细胞产生单核细胞趋化蛋白1、内皮素1和白介素-8等物质,诱导核转录因子-κB活化,诱导发生肾间质炎症反应,促进肾小管间质纤维化,从而影响肾小管功能[15]。本研究显示ASICs在肾小管表达量较多并且ASIC1的表达量与24 h尿蛋白定量存在相关性,肾间质发生炎症反应导致局部组织酸化,极有可能通过激活ASICs引起肾小管的损伤。
[1] Waldmann R,Champigny G,Bassilana F,et al.A proton-gated cation channel involved in acid-sensing[J].Nature,1997,386 (6621):173-7.
[2] Xiong Z G,Pignataro G,Li M,et al.Acid-sensing ion channels (ASICs)as pharmacological targets forneurodegenerative diseases [J].Curr Opin Pharmacol,2008,8(1):25-32.
[3] Voilley N,deWeille J,Mamet J,et al.Nonsteroid anti-inflammatory drugs inhibit both the activity and the inflammation-induced expression of acid-sensing ionchannels in nociceptors[J].JNeurosci,2001,21(20):8026-33.
[4] Lai K N,Leung JC,Chan L Y,et al.Activation of podocytes by mesangial-derived TNF-alpha:glomerulo-podocytic communication in IgA nephropathy[J].Am J Physiol Renal Physiol,2008,294 (4):F945-55.
[5] 费文君,袁丽萍,吴 琳,等.酸敏感离子通道在过敏性紫癜血管内皮细胞中的表达[J].安徽医科大学学报,2012,47 (2):189-93.
[6] 中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南(二):紫癜性肾炎的诊治循证指南(试行)[J].中华儿科杂志,2009,47(12):911-3.
[7] Lee SM,Rao VM,Franklin W A,et al.IgA nephropathy:morphologic predictors of progressive renal disease[J].Hum Pathol,1982,13(4):314-22.
[8] Li L S,Liu Z H.Epidemiologic data of renal diseases from a single unit in china:analysis based 13 159 renal biopsies[J].Kidney Int,2004,66(3):920-3.
[9] Araque A,Sánchez R,Alamo C,et al.Evolution of immunoglobulin A nephropathy into Henoch-Schölein purpura in an adult patient [J].Am JKidney Dis,1995,25(2):340-2.
[10]Mao S,Xuan X,Sha Y,et al.Clinico-pathological association of Henoch-Schoenlein purpura nephritis and IgA nephropathy in children[J].Int JClin Exp Pathol,2015,8(3):2334-42.
[11]Yoshikawa N,Ito H,Yoshiya K,et al.Henoch-Schoenlein nephritis and IgA ne-phropathy in children:a comparison of clinical course [J].Clin Nephrol 1987,27(5):233-7.
[12]Brown D,Wagner C A.Molecularmechanisms of acid-base sensing by the kidney[J].JAm Soc Nephrol,2012,23(5):774-80.
[13]Tilmann D,Gisa T,Kristina R,etal.Do distinctpopulations of dorsal root ganglion neurons account for the sensory peptidergic innervation of the kidney[J].Am J Physiol Renal Physiol,2009,297 (5):F1427-34.
[14]涂 娟,陈朝英,曹 力.紫癜性肾炎伴大量蛋白尿患儿临床病理相关性分析[J].中华儿科杂志,2015,53(5):379-82.
[15]刘春蓓,胡伟新.蛋白尿加重肾小管间质损伤的机制[J].肾脏病与透析肾移植杂志,2007,16(1):57-63.
①The HSPN and IgAN patients’ASICs were widely expressed in kidney tubules,only few were expressed in glomeruli;②The HSPN and IgAN patients’ASICs expressionsweremore than thatof the control group(P<0.01),ASIC1 and ASIC2 expressions of IgAN tissue weremore than that of the HSPN group(P<0.05);③The relationship between ASICs expression and 24 h urinary protein quantity with pathological gradeⅢwas significantly more than pathological gradeⅡboth in HSPN and IgAN(P<0.01);④ASIC1 expression was positively correlated with 24 h urinary protein quantity both in HSPN and IgAN.Conclusion ASICs express in both HSPN and IgAN patients’renal tissues,especially in their renal tubules.The expression is related to pathological grade and urinary protein production,which suggests that ASICs could participate in the pathological process of kidney damage.
Expression and significance of acid-sensing ion channels of renal tissue from Henoch-Schönlein purpura nephritis and IgA nephropathy patients
Peng Qidi,Yuan Liping,Deng Fang,et al
(Dept of Pediatrics,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To observe the expression of acid-sensing ion channels(ASICs)of renal tissue from Henoch-Schönlein purpura nephritis(HSPN)and IgA nephropathy(IgAN)patients and its relationship with pathological damages.Methods The study was based on the paraffin-embedded renal tissues from 13 Henoch-Schönlein purpura nephritis patients,11 IgA nephropathy patients and the 7 nomal persons.The expression of ASICs in the tissues from HSPN and IgAN patients was examined by immunohistochemical staining,while the expression of ASICs in the renal tissueswas observed undermicroscope light by integral optical density(IOD).And then,the relationship was analyzed between ASICs expressions and pathological damages according to the outcome.Resu lts
Henoch-Schönlein purpura nephritis;IgA nephropathy;acid-sensing ion channels;renal tissue
2015-12-08接收
国家自然科学基金面上项目(编号:81471617)
安徽医科大学第一附属医院儿科,合肥 230022
彭启迪,女,硕士研究生;
胡 波,男,主任医师,教授,硕士生导师,责任作者,E-mail:hubo3218@sohu.com
R 725.9
A
1000-1492(2016)04-0578-05
