依达拉奉对SAH大鼠海马区神经细胞自噬的影响
2016-08-09徐继伟赵雅宁李建民付爱军薛承景刘俊杰
徐继伟,赵雅宁,李建民,付爱军,薛承景,赵 旭,刘俊杰
依达拉奉对SAH大鼠海马区神经细胞自噬的影响
徐继伟1,赵雅宁2,李建民3,付爱军3,薛承景3,赵 旭3,刘俊杰1
目的 探讨依达拉奉对蛛网膜下腔出血(SAH)大鼠海马区神经细胞自噬的影响。方法 将72只健康雄性清洁级SD大鼠随机均等分为假手术组(Sham组)、SAH模型组(SAH组)、SAH结合依达拉奉治疗组(依达拉奉)。Sham组只进行造模手术不注血,SAH组利用经典枕大池二次注血法制成大鼠SAH动物模型,依达拉奉组在建模成功30 min后给予依达拉奉(5 mg/kg体重)腹腔注射,每12 h注射1次,用药至处死的各时相点。SAH组注射生理盐水时间方法同依达拉奉组(5 mg/kg体重)。Sham组注射生理盐水(5 mg/kg体重),每次间隔12 h。每组又按6、24、72、144 h时间点分为4个亚组(1个亚组6只SD大鼠)。观察3组大鼠的行为学变化,并检测细胞自噬的特异性标志物LC3-Ⅱ和Beclin-1在大鼠海马区的表达。结果 SAH组抓力明显减弱,海马区细胞LC3-Ⅱ、Beclin-1的表达增高。依达拉奉组抓力恢复明显,海马区细胞LC3-Ⅱ、Beclin-1的表达显著增高。结论 依达拉奉的干预可显著激活SAH的SD大鼠海马区细胞自噬表达。
蛛网膜下腔出血;依达拉奉;自噬
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.032.htm l
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是各种因素所导致的对人类生命有严重威胁的一种破坏性神经系统疾病,在急性脑血管病中大概占10%,发病率和死亡率超过50%以上[1]。研究[2]表明,SAH后逐渐增加的氧自由基在早期继发性的脑损害中起着比较重要的作用。研究[3]显示,适当活化的自噬可能衰减大鼠SAH模型的早期脑损害的发展。临床上依达拉奉能够有效的清除氧自由基、防止氧化应激和神经细胞凋亡以减少神经元损伤从而提供保护作用。依达拉奉在SAH中已经逐渐应用,但潜在的保护作用机制尚不完全清楚。该研究拟探讨依达拉奉对涉及细胞凋亡过程中自噬表达的影响,为临床提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD大鼠72只,320~420 g(北京维通利华实验动物技术有限公司)。饲养于华北理工大学动物实验中心,室温维持在25℃,湿度控制在(50±10)%,正常光照,通风良好,自由进食饮水。
1.1.2 药物和试剂 依达拉奉注射液(5 mg/kg),购自先声药业公司;一抗兔抗Beclin-1、LC3-Ⅱ购自北京博奥森生物技术有限公司。
1.1.3 主要仪器 820-Ⅱ型切片机(德国Leica公司);OLYMPUS摄像显微镜(日本奥林巴斯公司);图像采集及分析系统(北京航空航天大学)。
1.2 方法
1.2.1 模型建立 实验开始前1周适应环境。将大鼠随机分为假手术(Sham组)、SAH模型(SAH组)、SAH结合依达拉奉治疗(依达拉奉组),每组24只。通过经典的枕大池二次注血的方法制备大鼠模型组,大鼠成功麻醉后经手术区(头部及单侧股动脉区)备皮、常规消毒铺巾,常规消毒铺巾采取俯卧位姿势,采用颅脑定位仪定位枕骨环椎以及环枕筋膜。随后采取仰卧位于手术台,用1 m l注射器(提前用肝素钠盐水冲洗)抽取非抗凝约0.3 ml新鲜股动脉血,在3 min内缓缓将血液注入枕大池,使用骨蜡和少量医用明胶海绵密封穿刺点。取头低30°俯卧位30 min,有助于血液均匀分散于蛛网膜下腔,大鼠呼吸平稳后放回笼中正常饲养,48 h后重复上述操作。治疗组在建模成功30 min后给予依达拉奉(5 mg/kg体重)腹腔注射,每次注射间隔12 h,用药至处死的相应时间点。模型组在相应时间点给予等量注射生理盐水。以具备确定在无脑实质损害的SAH或有血凝块而作为模型制备成功的判断标准。
1.2.2 抓力实验 抓力实验是将大鼠自由放置于抓力测试仪上恰当位置,用脚踩下踏板将显示器读数归零,用手拉住鼠尾向后下方轻微施加力量,待大鼠握紧抓力杆时,继续增加力道,直至大鼠肢体无法抵抗外力且听到“滴”的响声时,记录数值为本次拉力值。在正式实验前每只大鼠需行2~3次预实验。然后每只大鼠行3次测试,每次间隔5 min,取平均值作为最终结果。
1.2.3 HE染色 切片常规脱蜡入水:二甲苯Ⅰ5 min、二甲苯Ⅱ 5 min,入100%Ⅰ,100%Ⅱ,95%、90%、80%酒精各5 min;流水冲洗5 min;苏木精染液1 min后,清洁水水化30 s,1%盐酸酒精分化5~8 s,洁净水冲洗30 min以上,直至细胞核及核内染色质清晰之后,0.5%的伊红染色2 min;然后依次在80%、90%、95%、100%酒精中各5 min常规梯度酒精脱水,二甲苯透明(2次,每次2 min);用滤纸吸去组织周围多余二甲苯,滴加中性树胶,加盖玻片封固,在光学显微镜(400倍)下观察,应用Motic-6.0图像采集及图像分析系统观察海马CA1区神经元形态变化并计数单位高位视野下的存活的神经细胞数。
1.2.4 免疫组织化学染色 标准SABC法。一抗分别为LC3-Ⅱ、Beclin-1多克隆抗体(均1∶200稀释)。用高压热修复2min,用PBS缓冲液(pH=7.2 ~7.4)。前期脱蜡脱水,分别滴加LC3-Ⅱ、Beclin-1(均1∶200稀释),在湿盒中温育4℃过夜,然后洗涤在PBS中,二抗是山羊抗兔IgG(稀释1∶200)。37℃温箱30 min,DAB显色,脱水、透明、封片。采用PBS代替一抗进行阴性对照。每个步骤之间切片均置于PBS中。自噬标记物阳性表达率的定量分析:每个标本取4张切片,200倍光镜下每张切片在海马随机选取4个视野,在显微镜(× 400)中观察海马CA1区阳性细胞的变化,并计数(×400)倍视野下的阳性细胞数量。
1.3 统计学处理 采用SPSS 19.0软件进行分析,计量资料以±s表示。采用Excel建立数据库,各组间比较采用方差分析进行均数的两两比较。
2 结果
2.1 抓力实验结果 与Sham组比较,SAH组在各时间点(6、24、72、144 h)抓力测定分值显著降低,其中6 h拉力值最低,呈现出明显的神经功能损伤,差异有统计学意义(P<0.01);与 SAH组比较,依达拉奉组各时间点分值有所升高,差异有统计学意义(P<0.01)。从SAH疾病的发展趋势来看,拉力测定数值在SAH组、依达拉奉组均呈现时间依赖性,随时间延长,呈逐渐增高的趋势,神经功能损伤症状逐渐恢复。见表1。
2.2 形态学结果Sham组海马神经元进行密集排列,神经元的细胞体较大,细胞核大而圆,核清晰和胞质色浅且均匀。SAH组海马区细胞轮廓模糊,排列紊乱,胞体收缩呈多边形或呈不规则改变,部分胞质出现自溶;各时间点存活神经元密度均明显减少(P<0.01);依达拉奉组中海马区神经元结构相对SAH组损伤减轻,胞质自溶现象减轻,每个时间相神经元细胞存活密度得到提高(P<0.01),存活神经细胞数量较模型组明显增多(P<0.01)。见图1、表2。
2.3 LC3免疫组化染色结果 Sham组可见少量LC3-Ⅱ阳性表达;与Sham组比较,SAH组和依达拉奉组LC3-Ⅱ表达明显增加(P<0.01);与Sham组比较,SAH组LC3-Ⅱ表达显著增多(P<0.01),且在24 h时表达达高峰;与SAH组比较,依达拉奉组LC3-Ⅱ表达显著增多(P<0.01),各时间点呈递减趋势。见表3、图2。
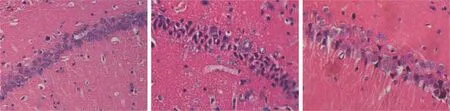
图1 各组大鼠海马区24 h神经细胞形态学变化 HE×400 A:Sham组;B:SAH组;C:依达拉奉组
2.4 Beclin-1免疫组化染色结果 Sham组可见少量Beclin-1阳性表达;与Sham组比较,SAH组和依达拉奉组Beclin-1表达均不同程度增多(P<0.01);与Sham组比较,SAH组Beclin-1表达显著增多(P <0.01),于24 h时表达达高峰;与SAH组比较,依达拉奉组Beclin-1表达显著增多(P<0.01),各时间点呈递减趋势。见表4、图3。
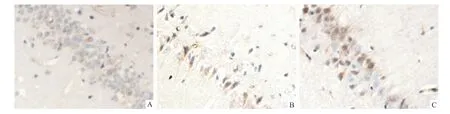
图2 各组大鼠海马区LC3-Ⅱ的24 h表达情况 免疫组化×400 A:Sham组;B:SAH组;C:依达拉奉组
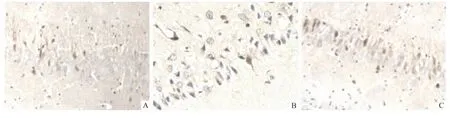
图3 各组大鼠海马区 Beclin-1的24 h表达情况 免疫组化×400 A:Sham组;B:SAH组;C:依达拉奉组
表1 各组大鼠抓力实验拉力值比较(n=24,±s)
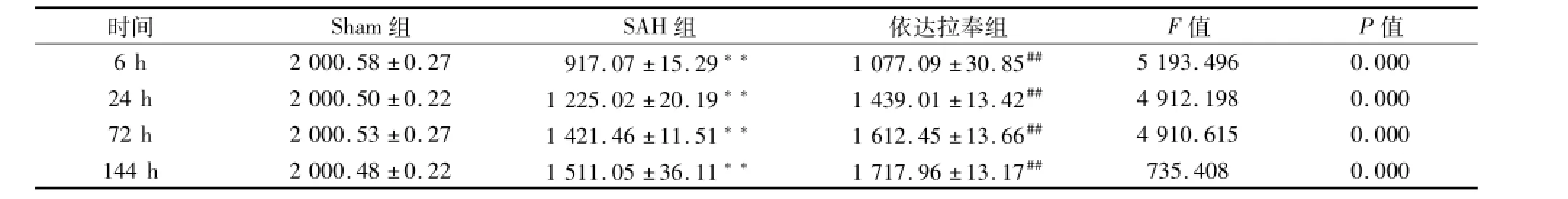
表1 各组大鼠抓力实验拉力值比较(n=24,±s)
与Sham组比较:**P<0.01;与SAH组比较:##P<0.01
时间 Sham组 SAH组 依达拉奉组 F值 P值6 h 2 000.58±0.27 917.07±15.29** 1 077.09±30.85##735.408 0.000 5 193.496 0.000 24 h 2 000.50±0.22 1 225.02±20.19** 1 439.01±13.42## 4 912.198 0.000 72 h 2 000.53±0.27 1 421.46±11.51** 1 612.45±13.66## 4 910.615 0.000 144 h 2 000.48±0.22 1 511.05±36.11** 1 717.96±13.17##
表2 各组大鼠海马区神经细胞数量比较(个/高倍视野,n=24,±s)

表2 各组大鼠海马区神经细胞数量比较(个/高倍视野,n=24,±s)
与Sham组比较:**P<0.01;与SAH组比较:##P<0.01
时间 Sham组 SAH组 依达拉奉组 F值 P值6 h 132.05±1.91 75.18±1.95** 87.01±2.82##268.615 0.000 1 052.278 0.000 24 h 132.51±1.38 87.53±2.58** 103.18±1.46## 877.737 0.000 72 h 132.85±2.25 96.01±2.18** 109.82±2.32## 410.260 0.000 144 h 132.85±2.13 103.18±1.95** 114.35±2.59##
表3 各组大鼠海马区不同时间点LC3-Ⅱ表达(个/高倍视野,n=24,±s)

表3 各组大鼠海马区不同时间点LC3-Ⅱ表达(个/高倍视野,n=24,±s)
与Sham组比较:**P<0.01;与SAH组比较:##P<0.01
时间 Sham组 SAH组 依达拉奉组 F值 P值6 h 13.11±0.97 28.02±1.65** 31.86±1.17##191.704 0.000 350.903 0.000 24 h 13.65±0.82 34.52±1.07** 42.05±1.66## 852.075 0.000 72 h 13.51±0.86 30.32±2.36** 35.16±2.27## 202.770 0.000 144 h 13.03±0.89 22.68±1.23** 26.28±1.45##
表4 各组大鼠海马区不同时间点 Beclin-1蛋白表达(个/高倍视野,n=24,±s)

表4 各组大鼠海马区不同时间点 Beclin-1蛋白表达(个/高倍视野,n=24,±s)
与Sham组比较:**P<0.01;与SAH组比较:##P<0.01
时间 Sham组 SAH组 依达拉奉组 F值 P值6 h 23.84±1.35 31.01±1.42** 42.18±1.95##71.748 0.000 201.220 0.000 24 h 24.35±1.05 45.35±2.33** 58.01±0.65## 748.186 0.000 72 h 23.67±1.38 37.18±2.15** 49.51±2.18## 266.574 0.000 144 h 23.51±1.06 30.35±2.60** 37.16±1.95##
3 讨论
SAH带来许多生理紊乱如颅内压增高、脑血液流动下降、全脑缺血。这些事件引发二次伤害,如血脑屏障破坏、炎症和氧化级联[4]、早期的脑血管痉挛[5]以及大量生成的氧自由基[6]最终导致细胞死亡。据文献[7]统计,SAH后24 h并持续至48 h氧自由基水平开始升高,致使神经细胞损伤和脑水肿加重。随着对SAH的逐步认识和有效的早期干预,大多数入院的患者未出现再次出血,但是目前却尚未找到一种可以有效预防或减轻脑组织细胞的早期损伤,研究[8]表明SAH后随着脑损伤的发生自噬被激活,而氧自由基的及时清除可显著减轻SAH后的进一步脑损害。海马细胞由于对脑组织缺血、低氧最为敏感,因此依达拉奉系一种能够清除羟自由基(·OH)的抗氧化药物[9],在体内以阴离子的形式存在,一个电子转移到氧自由基和自由基,阻断脂质过氧化链和保护神经细胞[10]。以往主要用于治疗缺血性脑病,疗效得到肯定[11]。近年来,其已逐渐用于SAH的早期治疗。研究[12]表明依达拉奉具有对氧自由基的清除以及对毒性有较强的抑制作用,可减轻由于氧自由基导致的一系列级联反应,发挥脑保护作用。缺血、低氧是神经细胞凋亡的重要原因。SAH后由于血液积聚在颅内造成缺血低氧,进而氧自由基逐渐增加从而导致大量神经细胞出现凋亡。本实验从自噬层面上证实了依达拉奉早期及时有效的干预能够激活自噬从而弱化SAH后早期脑损伤,从而发挥对脑的保护作用。
自噬是一个自我降解过程,能够去除错误折叠或聚集的蛋白质,以及受损的细胞器,消除细胞内病原体,有维持细胞稳态、保护细胞生存的作用,与人体生理过程和疾病有着密切联系。自噬特异性标志蛋白LC3-Ⅱ是定位在自噬体膜上的蛋白质,主要用于反映细胞内自噬体的数量[13];作为酵母自噬基因Atg6同系物的Beclin1,是调控哺乳动物自噬体形成的关键因子[14]。本研究通过检测各组大鼠大脑海马区特异性自噬标记物LC3-Ⅱ和Beclin1的表达,以反映自噬在各组之间的表达差异。本研究表明,Sham组自噬表达维持在较低水平,而SAH组较Sham组的自噬标记物表达明显,经过依达拉奉的干预后相比SAH组的自噬标记物表达水平又有所提高。本次实验结果表明,自噬活性增强对SD大鼠神经元具有保护作用,依达拉奉治疗可显著增加自噬活性,从而发挥神经保护作用。
综上所述,依达拉奉对SAH大鼠海马区脑保护作用可能与激活自噬并上调LC3-Ⅱ和Beclin1等自噬基因的表达有关。在细胞中,自噬无论是有害还是保护作用,取决于在病理过程中的具体情况和阶段[15]。依达拉奉对SAH的疗效,涉及相当复杂的分子机制和信号通路的转导,有待于进一步研究。
[1] Bakke S J,Lindegaard K F.Subarachniod haemorrhage-diagnosis and management[J].Tidsskr Nor Laegeforen,2007,127(8):1074-8.
[2] Mori T,Nagata K,Town T,et al.Intracisternal increase of superoxide anionproduction in a canine subarachnoid hemorrhagemodel [J].Stroke,2001,32(3):636-42.
[3] Lee JY,He Y,Sagher O,etal.Activated autophagy pathway in experimental subarachnoid hemorrhage[J].Brain Res,2009,1287:126-35.
[4] Cahill J,Zhang JH.Subarachnoid hemorrhage:is it time for a new direction?[J].Stroke,2009,40(3 Suppl):S86-7.
[5] Yamawaki M,Sasaki N,Shimoyama M,et al.Protective effect of edaravone against hypoxia-reoxygenation injury in rabbit cardiomyocytes[J].Br JPharmacol,2004,142(3):618-26.
[6] 丁宏岩,董 强.自由基清除剂依达拉奉对脑缺血的治疗作用[J].国外医学(脑血管疾病分册),2004,12(7):491-3.
[7] Mocco J,Prickett C S,Komotar R J,et al.Potentialmechanisms and clinicalsignificance of global cerebral edema following aneurysmal subarachnoid hemorrhage[J].Neurosurg Focus,2007,22 (5):E7.
[8] Jing C H,Wang L,Liu P P,et al.Autophagy activation is associated with neuroprotection against apoptosis via a mitochondrial pathway in a rat model of subarachnoid hemorrhage[J].Neuroscience,2012,213:122-53.
[9] Yoshida H,Sasaki K,Namiki Y,et al.Edaravone,a novel radical scavenger,inhibits oxidativemodification of low-density lipoprotein(LDL)and reverses oxidizedLDL-mediated reduction in the expression of endothelial nitric oxide synthase[J]Atherosclerosis,2005,179(1):97-102.
[10]Amemiya S,Kamiya T,Nito C,et al.Anti-apoptotic and neuroprotective effects of edaravone following transient focal ischemia in rats[J].Eur JPharmacol,2005,516(2):125-30.
[11]Shichinohe H,Kuroda S,Yasuda H,et al.Neuroprotec-tive effects of the free radicalscavenger Edaravone(MCI-186)inmice permanent focal brain ischemia[J].Brain Res,2004,1029(2):200-6.
[12]Abe K,Yuki S,Kogure K.Strong attenuation of ischemic and postischemicbrain edema in rats by a novel free radical scavenger[J]. Stroke,1988,19(4):480-5.
[13]Kroemer G,Levine B.Autophagic cell death:the story of amisnomer[J].Nat Rev Mol Cell Biol,2008,9(12):1004-10.
[14]Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mam-malian homologue ofyeastApg8p,is localized in autophagosomemembranesafter processing[J].EMBO J,2000,19(21):5720-8.
[15]赵明明,赵永博,罗 鹏,等.PI3K/Akt信号通路对神经元机械性损伤诱导的自噬调节作用[J].中华神经外科疾病研究杂志,2012,11(6):491-4.
M ain effect of edaravone on autophagy in hippocampal neurons of SAH rats
Xu Jiwei1,Zhao Yaning2,Li Jianmin3,et al
(1College of Post-graduate,2College of Rehabilitation and Nursing,North China University
of Science and Technology,Tangshan 063000;3Dept of Neurosurgery,Affiliated Hospital of North China University of Science and Technology,Tangshan 063000)
Objective To investigate the effect of edaravone on autophagy in hippocampal neurons of SAH rats. Methods All of 72 healthy clean-grade male SD rats were randomly devided into three groups,namely the false operation group(sham group,n=24),the subarachnoid hemorrhage group(edaravone group,n=24)combined with edaravone,and hemorrhagic SAHmodel group(SAH group,n=24).Sham group:only the blood of themodel was performed.SAH group:the SAH animalmodelwasmade by using the two injection of the classic pillow.Edaravone group was given intraperitoneal injection of edaravone(5 mg/kg)in 30 minutes aftermodeling operation had been succeeded,and the injection was performed once every 12 hours so as to makemedicated group be killed at each time point.SAH group was injected with normal saline ateach time interval of12 h(5 mg/kg body weight). The whole group were divided into four subgroups(a subgroup of6 SD rats)according to time points of6,24,72,and 144 h.The behavioral changes of the 3 groups were observed,and the expression of Beclin-1 and LC3-Ⅱ in the hippocampus of rats was detected by the specific markers of autophagy.Results The scratching forces of SAH group was significantly decreased,and the expression of LC3-Ⅱ and Beclin-1 in the hippocampus was increased. Edaravone group scratching force was significantly increased,the expression of LC3-Ⅱand Beclin-1 in the hippocampus cellswas significantly increased.Conclusion Edaravone intervention can significantly activate the expression of autophagy in hippocampus of SD rats after subarachnoid hemorrhage.
subarachnoid hemorrhage;edaravone;autophagy
R 651.1
A
1000-1492(2016)04-0531-05
2016-01-18接收
河北省高等学校科学技术研究项目(编号:ZD20131007);河北省高等学校科学技术重点项目(编号:ZH2012046);唐山市科技计划项目(编号:14130220B)
华北理工大学1研究生学院、2康复与护理学院,唐山063000
3华北理工大学附属医院神经外科,唐山 063000
徐继伟,男,硕士研究生;
李建民,男,教授,主任医师,硕士生导师,责任作者,E-mail:Lijianmints@sina.com
