Mcl-1抑制剂UM I-77诱导胃癌细胞MGC-803凋亡的机制研究
2016-08-09朱雪萍张林杰
朱雪萍,吴 萍,张林杰
Mcl-1抑制剂UM I-77诱导胃癌细胞MGC-803凋亡的机制研究
朱雪萍,吴 萍,张林杰
目的 探讨髓样细胞白血病-1(Mcl-1)分子选择性抑制剂UMI-77诱导胃癌细胞MGC-803凋亡的机制。方法采用Annexin V/PI染色流式细胞术观察不同浓度UMI-77作用后MGC-803细胞凋亡率;JC-1染色流式细胞术分析线粒体膜电位的改变;Western blot法检测UMI-77作用后半胱天冬氨酸蛋白酶9(Caspase-9)、半胱天冬氨酸蛋白酶3 (Caspase-3)和聚腺苷二磷酸核糖聚合酶(PARP)的活化情况以及B淋巴细胞瘤2(Bcl-2)、Bcl-2蛋白1亚型1(Bcl-XL)和Mcl-1蛋白的表达情况;转染Mcl-1 siRNA特异性沉默Mcl-1基因,Western blot验证基因沉默效果,Annexin V/PI染色流式细胞术检测转染对UMI-77诱导的细胞凋亡的影响。结果 UMI-77能诱导胃癌细胞MGC-803发生凋亡,随着药物浓度升高,细胞凋亡率逐渐增加;UMI-77作用后,线粒体膜电位下降;Caspase-9、Caspase-3和PARP在UMI-77处理24 h显著活化(P<0.05);Bcl-2、Bcl-XL在UMI-77作用前后的蛋白表达水平没有明显改变,而Mcl-1在12 h起即明显下调(P<0.05);与阴性对照比较,转染Mcl-1 siRNA后MGC-803细胞中Mcl-1蛋白表达水平显著下降(P<0.05),且转染后再用UMI-77处理,细胞凋亡率降低(P<0.05)。结论UMI-77可通过内源性凋亡途径诱导胃癌细胞MGC-803发生凋亡,下调Mcl-1表达会阻止UMI-77诱导的凋亡。
胃癌;UMI-77;Mcl-1;小分子抑制剂;细胞凋亡
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.022.htm l
胃癌是严重危害人类健康的恶性肿瘤,化疗是主要的治疗方式,而化疗药物通常是通过诱导细胞凋亡来发挥效应的。凋亡途径一般分为由细胞膜上的死亡受体介导的外源性途径和由线粒体启动的内源性途径,其中B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)家族蛋白是调控内源性途径的关键,包括促凋亡的蛋白Bax、Bak、Bad、Bid和Bim等以及抗凋亡蛋白Bcl-2、Bcl-2蛋白1亚型1(Bcl-2-like protein 1 isoform 1,Bcl-XL)、髓样细胞白血病-1(myeloid cell leukemia-1,Mcl-1)和Bcl-w等,促凋亡和抗凋亡蛋白之间的平衡决定了细胞对凋亡刺激的反应[1]。近些年来,人们从抗凋亡的Bcl-2、Bcl-XL、Mcl-1入手,合成了许多小分子抑制剂,如ABT-737[2]、ABT-199等,其单独使用或与化疗药物联合时具有很好的抗肿瘤效果。UMI-77是2014年Abulwerdi et al[3]运用高通量筛选以及结构生物学方法鉴定出的一种小分子抑制剂,能选择性地结合Mcl-1,阻止Mcl-1/Bax及Mcl-1/Bak的异二聚化,从而拮抗Mcl-1的功能,发挥抑制细胞生长及诱导凋亡作用。该研究将UMI-77应用于胃癌细胞,了解其诱导胃癌细胞凋亡的机制,为其进入临床提供理论依据。
1 材料与方法
1.1材料 人胃癌细胞株MGC-803购自中国科学院上海细胞库;UMI-77购自美国Selleck公司;RPMI 1640培养基和Opti-MEM低血清培养基购自美国Gibco公司;胎牛血清购自美国Hyclone公司;Annexin V-FITC细胞凋亡检测试剂盒、FACSVerse流式细胞仪购自美国BD公司;线粒体膜电位检测试剂盒购自北京泛博生物化学有限公司;兔抗人Bcl-XL单克隆抗体及半胱天冬氨酸蛋白酶9(cysteinyl aspartate specific proteinase 9,Caspase-9)多克隆抗体购自美国Cell Signaling公司;小鼠抗人半胱天冬氨酸蛋白酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)、聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)及Bcl-2单克隆抗体、兔抗人Mcl-1多克隆抗体购自美国Santa Cruz公司;辣根过氧化物酶标记的山羊抗小鼠IgG及山羊抗兔 IgG购自北京中杉金桥生物技术有限公司;Lipofectamine 2000 Reagent购自美国Invitrogen公司;人Mcl-1 siRNA序列由上海吉玛公司设计并合成。
1.2方法
1.2.1细胞培养 MGC-803细胞培养于含10%胎牛血清的RPMI 1640培养基中,5%CO2、37℃、饱和湿度条件下常规培养。
1.2.2Annexin V/PI染色流式细胞术检测细胞凋亡 将对数生长期的细胞按每孔1×105个接种于24孔板中,次日细胞融合达80%以上,分别用0、2.5、5、10、15、20μmol/L UMI-77处理,每组设3个复孔,24 h后分别收集各孔中细胞于流式管中,加300μl 1×Binding Buffer重悬,然后加入5μl Annexin V-FITC和5μl PI,充分混匀,避光作用20 min,流式细胞仪检测细胞凋亡情况,采用FlowJo 7.6软件分析结果。
1.2.3JC-1染色流式细胞术检测线粒体膜电位按1.2.2中接种细胞,分别用0、15、20μmol/LUMI-77处理,每组设3个复孔,24 h后分别收集各孔细胞,用0.5 m l RPMI 1640完全培养液重悬细胞,再加入0.5 ml JC-1染色工作液,颠倒混匀,37℃避光作用20 min,于每管加入300μl JC-1染色缓冲液(1×),立即上流式细胞仪检测线粒体膜电位变化,以线粒体膜电位阻断剂CCCP(50μmol/L)处理 10 min的细胞为阳性对照,FlowJo 7.6软件分析结果。
1.2.4Western blot法检测蛋白表达情况 分别收集各孔(未转染、转染NC siRNA、转染Mcl-1 siRNA)以及UMI-77(15μmol/L)处理0、6、12、24 h细胞。加适量RIPA裂解液,冰上裂解30 min,4℃、14 000 r/min离心30 min后取上清液,获得细胞总蛋白。用BCA法进行蛋白定量,然后加入等体积的2×上样缓冲液,煮沸3 min使蛋白变性。各蛋白样品取20μg进行SDS-PAGE凝胶电泳,随后转移至硝酸纤维素膜上,用含5%脱脂奶粉的TBST室温封闭2 h,然后加入各自的一抗4℃孵育过夜,次日用TBST洗3次,每次10 min。再加入相应二抗,室温孵育1 h,TBST洗3次,每次10 min。用ECL试剂盒显色,天能全自动凝胶成像系统照相并分析结果。
1.2.5siRNA转染 Mcl-1 siRNA上游引物:5′-GUGCCUUUGUGGCUAAACA-3′,下 游 引 物:3′-UGUUUAGCCACAAAGGCAC-5′。将细胞分别接种于6孔板和24孔板中(6孔板每孔2×105个细胞,24孔板每孔1×105个细胞),次日细胞融合达30% ~50%即进行转染,分未转染、转染NC siRNA、转染Mcl-1 siRNA,每组设3个复孔。转染前1 h将各孔中液体更换为无血清Opti-MEM培养基,然后分别用Opti-MEM将适量siRNA与Lipofectamine2000稀释,静置20 min后混合,将 siRNA/Lipofectamine 2000混合物滴入相应孔中,置于培养箱中继续培养,约4~6 h后更换为RPMI 1640培养基。6孔板细胞在转染48 h后提取细胞总蛋白,Western blot法检测转染效率。24孔板中细胞在未转染以及转染Mcl-1 siRNA基础上待细胞融合达80%~90%后再加入 UMI-77(15μmol/L)处理24 h,Annexin V/PI染色流式细胞术检测细胞凋亡率。
1.3统计学处理 采用SPSS 17.0软件进行分析,实验数据以±s表示,组间比较采用单因素方差分析。
2 结果
2.1UM I-77对MGC-803细胞凋亡的影响 AnnexinV-FITC/PI染色流式细胞术结果显示,0、2.5、5、10、15、20μmol/L的UMI-77作用 MGC-803细胞24 h的凋亡率分别为(2.12±3.103)%、(6.28± 2.679)%、(17.96±3.977)%、(43.11±5.133)%、(50.97±4.819)%、(77.38±6.574)%,随着药物浓度的升高,细胞凋亡逐渐增加(F=464.036,P<0.05),呈剂量依赖性。见图1。
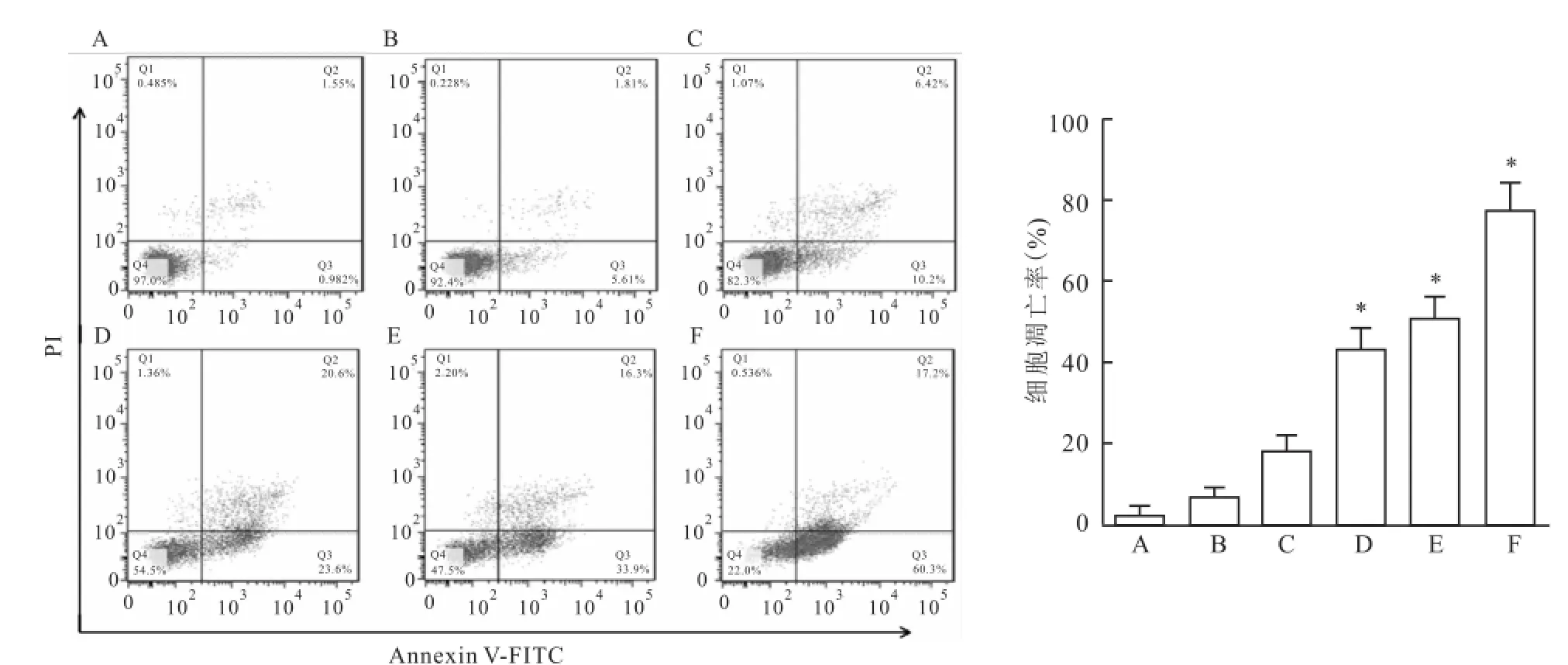
图1 不同浓度UM I-77处理MGC-803细胞24 h的凋亡率A:0μmol/L;B:2.5μmol/L;C:5μmol/L;D:10μmol/L;E:15μmol/L;F:20μmol/L;与0μmol/L比较:*P<0.05
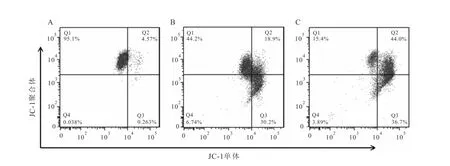
图2 UM I-77对 MGC-803细胞线粒体膜电位的影响A:0μmol/L;B:15μmol/L;C:20μmol/L
2.2UM I-77对MGC-803细胞线粒体膜电位的影响JC-1染色流式细胞术检测结果显示,正常情况下JC-1聚集在线粒体基质中形成聚合物,而0、15、20μmol/L的UMI-77处理后,细胞逐渐向右下方移动,即聚集在线粒体的JC-1聚合物减少,而单体形式的JC-1增加,线粒体膜通透性增加,线粒体膜电位降低。见图2。
2.3UM I-77对MGC-803细胞Caspase-9、Caspase-3、PARP表达的影响 Western blot法检测UMI-77(15μmol/L)处理后Caspase-9、Caspase-3、PARP活化情况,无活性的前体形式的Caspase-9、Caspase-3和PARP在UMII-77处理6、12 h未发生明显改变,而在处理24 h显著下降(F=139.446、71.385、130.880,P<0.05),被裂解的有活性的cleaved-Caspase-9、cleaved-Caspase-3和cleaved-PARP也出现,说明UMI-77激活了Caspase依赖性的内源性凋亡途径。见图3。
2.4UM I-77对MGC-803细胞Bcl-2、Bcl-XL和M cl-1表达的影响 Western blot法检测UMI-77(15 μmol/L)处理前后抗凋亡蛋白Bcl-2、Bcl-XL和Mcl-1的表达情况,Bcl-2和Bcl-XL在凋亡过程中并没有明显的改变,而Mcl-1则在UMI-77处理后12 h显著降低(F=1244.0,P<0.05),说明Mcl-1的下调可能参与了UMI-77诱导的凋亡过程。见图4。
2.5UM I-77对沉默M cl-1的MGC-803细胞凋亡的影响利用化学合成的针对Mcl-1基因的siRNA转染MGC-803细胞,Western blot法检测基因沉默效果,与未转染和转染NC siRNA比较,转染Mcl-1 siRNA能明显降低细胞中Mcl-1蛋白的表达水平,基因沉默效果好(F=850.571,P<0.05)。Annexin V/PI染色流式细胞术检测基因沉默对UMI-77(15 μmol/L)诱导凋亡的影响。细胞转染Mcl-1 siRNA后再加UMI-77处理24 h的凋亡率为(21.38± 4.907)%,与UMI-77处理未转染细胞24 h比较,差异有统计学意义(F=274.062,P<0.05)。见图5、6。

图3 UM I-77处理细胞不同时间后Caspase-3、Caspase-9以及 PARP的表达情况1:0 h;2:6 h;3:12 h;4:24 h;与0 h比较:*P<0.05
3 讨论
Mcl-1是1993年发现的Bcl-2家族抗凋亡分子,半衰期非常短,在多种肿瘤组织中高表达[4-5],在胃癌组织中的表达水平也显著高于癌旁组织,与胃癌细胞的生物学功能密切相关[6-7],而且抑制Mcl-1表达能有效诱导肿瘤细胞凋亡[8]。Mcl-1在结构和功能上与Bcl-2、Bcl-XL等抗凋亡成员相似,但在凋亡细胞中的表达水平存在差异,如在多种肿瘤细胞中伴随凋亡的加重,Mcl-1表达下调[8-10];采用RNA干扰技术下调Mcl-1基因表达后可致使肿瘤细胞凋亡增加[9-10]。这些研究表明Mcl-1在肿瘤细胞凋亡调控中起重要作用,提示Mcl-1可能是肿瘤治疗的一个重要靶点。
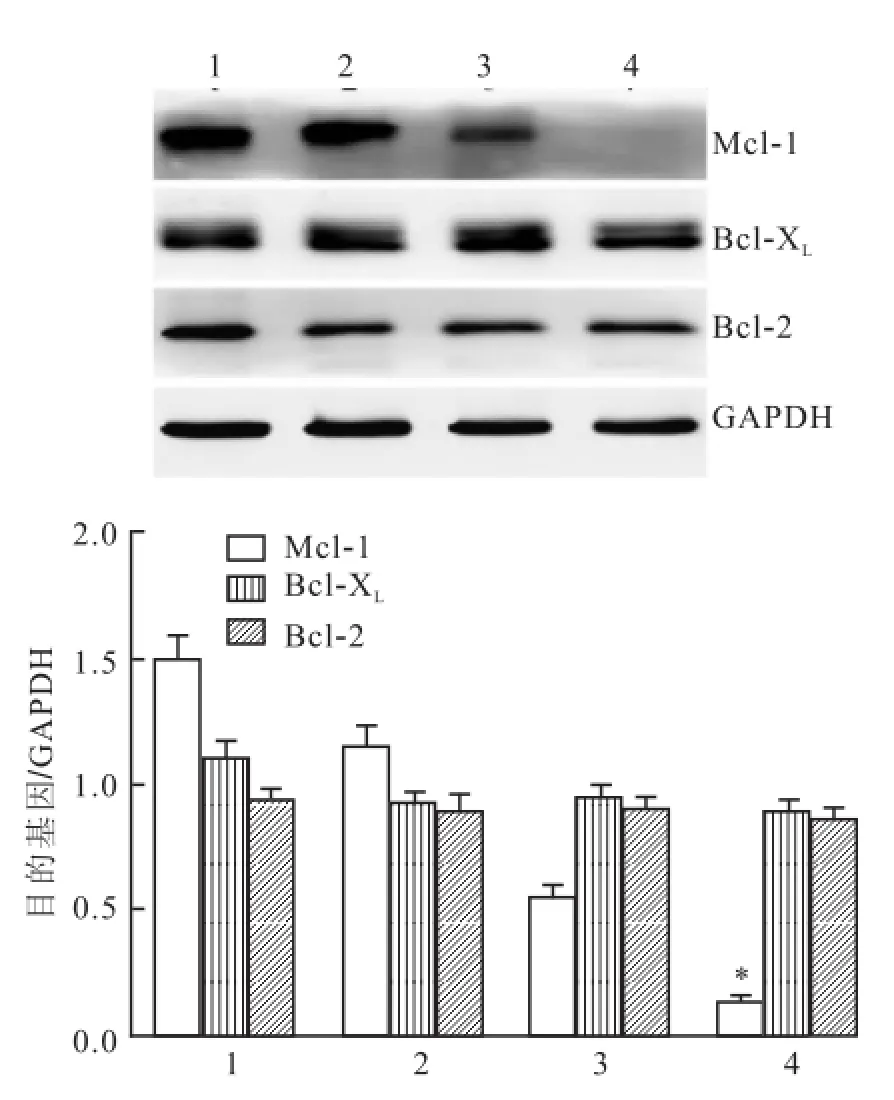
图4 抗凋亡的Bcl-2家族蛋白在UM I-77处理细胞不同时间后蛋白的表达情况1:0 h;2:6 h;3:12 h;4:24 h;与0 h比较:*P<0.05
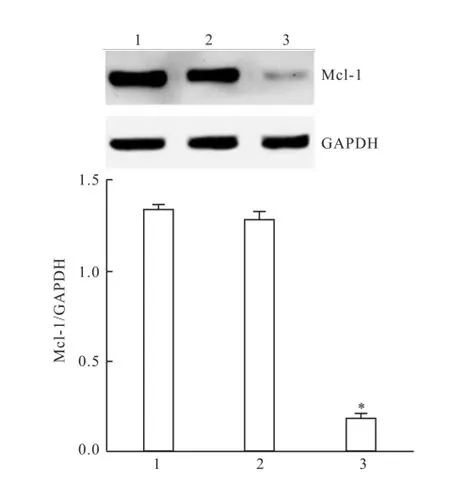

图5 W estern blot法检测转染 M cl-1siRNA的基因沉默效果1:未转染;2:转染NC siRNA;3:转染Mcl-1 siRNA;与未转染比较:*P<0.05
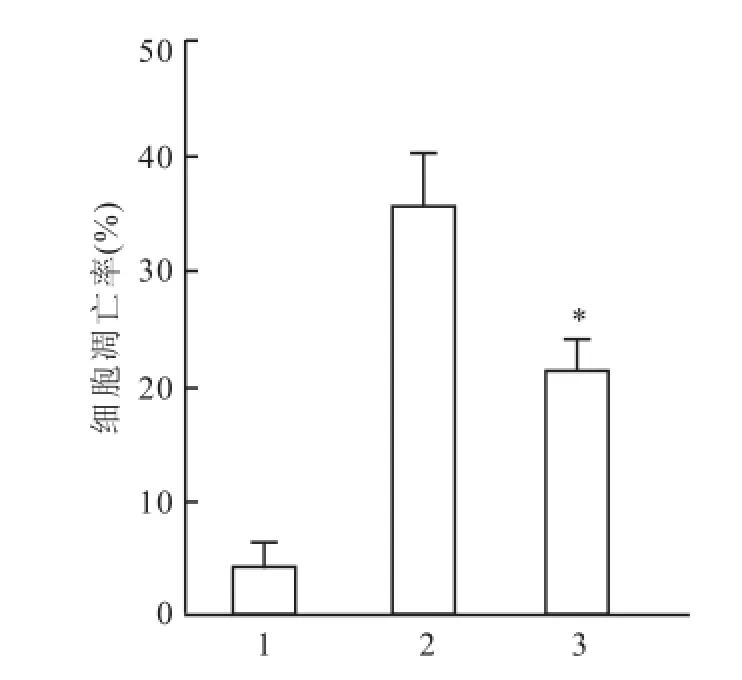
图6 UM I-77对沉默 M cl-1的MGC-803细胞凋亡的影响1:未转染;2:未转染 +UMI-77 15μmol/L;3:Mcl-1 siRNA+ UMI-77 15μmol/L;与未转染 +UMI-77 15μmol/L比较:*P<0.05
近年来,针对抗凋亡蛋白的抑制剂不断涌现,其中最重要的是BH3类似物,都是一些类似BH3-only蛋白的小分子,如ABT-263[11]、AT-101[12]、ABT-737等,通过结合到Bcl-2家族抗凋亡(促生存)成员上发挥抑制作用。这些小分子抑制剂对细胞的渗透性好,相对于传统的细胞毒性药物更容易被细胞吸收[13],在抑制蛋白作用的同时发挥抗肿瘤作用。目前研究的最为清楚的是ABT-737,其以高亲和力与Bcl-2、Bcl-XL和Bcl-w结合,抑制这些蛋白的功能,并释放Bax和Bak,通过内源性途径激发细胞凋亡[2]。ABT-737在多种肿瘤中单用或者与其他化疗药物联用时有非常好的效果。但是,高表达Mcl-1的细胞却对ABT-737抵抗[14],如果能下调、去稳定或者灭活Mcl-1则可以增加该细胞对ABT-737的敏感性,提示Mcl-1可能是一个较Bcl-2、Bcl-XL更为重要的作用靶点。UMI-77除了有上述小分子抑制的特点以外,更表现出对Mcl-1的高选择性和高亲和性,而且UMI-77作用于胰腺癌可以抑制细胞增殖诱导细胞凋亡,其抑制作用与Mcl-1高表达有关[3]。
本实验采用不同浓度UMI-77处理MGC-803细胞显示细胞对UMI-77较为敏感,浓度在10μmol/L以上时24 h内有一半以上的细胞死亡,且大多数死亡的细胞表现为Annexin V(+)/PI(-),即凋亡细胞的特征性改变。在该凋亡过程中亦检测出线粒体膜电位降低,说明线粒体可能参与其中。此外Caspase-9、Caspase-3活化和PARP裂解,也表明UMI-77诱导的是Caspase依赖性的内源性凋亡。本实验显示Bcl-2家族抗凋亡蛋白Bcl-2和Bcl-XL在UMI-77处理前后并没有发生改变,而Mcl-1则在药物处理12 h起即显著下调,这说明Mcl-1在UMI-77诱导的细胞凋亡中起重要作用。为进一步证实Mcl-1在UMI-77诱导细胞凋亡中的作用,采用Mcl-1 siRNA转染方法沉默Mcl-1基因,在转染后给予UMI-77处理,细胞凋亡率降低,进一步说明Mcl-1 在UMI-77诱导MGC-803细胞凋亡中起重要作用,Mcl-1基因沉默后 UMI-77没有可结合作用的靶点而丧失了其诱导凋亡的功能。
综上所述,本实验显示Mcl-1的小分子选择性抑制剂UMI-77可诱导MGC-803细胞发生凋亡,该凋亡是通过线粒体介导的内源性凋亡途径,而且UMI-77诱导的细胞凋亡可能部分是通过下调Mcl-1表达实现。Mcl-1蛋白小分子抑制剂具有广泛的研究前景,对其作用机制进行深入研究并设计出高特异性、高亲和力的小分子抑制剂将会为抗肿瘤治疗提供更多选择。
[1] Anilkumar U,Prehn JH.Anti-apoptotic Bcl-2 family proteins in acute neural injury[J].Front Cell Neurosc,2014,8:281-6.
[2] Kiprianova I,Remy J,Milosch N,etal.Sorafenib sensitizes glioma cells to the BH3mimetic ABT-737 by targetingMcl-1 in a STAT3-dependentmanner[J].Neoplasia,2015,17(7):564-73.
[3] Abulwerdi F,Liao C,Liu M,et al.A novel small-molecule inhibitor ofmcl-1 blocks pancreatic cancer growth in vitro and in vivo [J].Mol Cancer Ther,2014,13(3):565-75.
[4] Quinn BA,Dash R,Azab B,etal.Targeting Mcl-1 for the therapy of cancer[J].Expert OpinInvestig Drugs,2011,20(10):1397-411.
[5] Perciavalle R M,Opferman JT.Delving deeper:Mcl-1’s contributions to normal and cancer biology[J].Trends Cell Biol,2013,23(1):22-9.
[6] LikuiW,Qun L,Wanqing Z,et al.Prognostic role ofmyeloid cell leukemia-1 protein(Mcl-1)expression in human gastric cancer[J].JSurg Oncol,2009,100(5):396-400.
[7] Saito Y,Suzuki H,Imaeda H,et al.The tumor suppressor microRNA-29c is downregulatedand restored by celecoxib in human gastric cancer cells[J].Int J Cancer Suppl,2013,132(8):1751-60.
[8] 吴亚欧,张林杰,张旭东,等.高表达Mcl-1对衣霉素诱导胃腺癌细胞凋亡的影响[J].安徽医科大学学报,2010,45(1):20-3.
[9] SieghartW,Losert D,Strommer S,et al.Mcl-1 overexpression in hepatocellular carcinoma:a potential target for antisense therapy [J].JHepatol,2006,44(1):151-7.
[10]Guoan X,Hanning W,Kaiyun C,et al.Adenovirus-mediated siRNA targeting Mcl-1 geneincreases radiosensitivity of pancreatic carcinoma cells in vitro and in vivo[J].Surgery,2010,147(4):553-61.
[11]Gandhi L,Camidge D R,Ribeiro de Oliveira M,et al.Phase I study of Navitoclax(ABT-263),a novel Bcl-2 family inhibitor,in patients with small-cell lung cancer and other solid tumors[J].J Clin Oncol,2011,29(7):909-16.
[12]Baggstrom M Q,Qi Y,Koczywas M,et al.A phase II study of AT-101(Gossypol)in chemotherapy-sensitive recurrentextensivestage small cell lung cancer[J].JThorac Oncol,2011,6(10):1757-60.
[13]Youle R J,Strasser A.The BCL-2 protein family:opposing activities thatmediate cell death[J].Nat Rev Mol Cell Biol,2008,9 (1):47-59.
[14]Zhou H,Chen J,Meagher JL,et al.Design of Bcl-2 and Bcl-XLinhibitors with subnanomolar binding affinities based upon a new scaffold[J].JMed Chem,2012,55(12):4664-82.
Mechanism of apoptosis induced by Mcl-1 inhibitor UM I-77 on gastric cancer MGC-803 cells
Zhu Xueping,Wu Ping,Zhang Linjie
(Dept of Immunology,Anhui Medical University,Hefei 230032)
Objective To investigate themechanism of apoptosis induced by UMI-77,a novel selective inhibitor of Mcl-1,in gastric cancer MGC-803 cells.Methods MGC-803 cells were treated with UMI-77 in different concentrations for 24 h,apoptotic rates were determined by Annexin V/PImethod using flow cytometry.Mitochondrial membrane potentialwas determined by JC-1 staining on a flow cytometer.The activation of Caspase-9,Caspase-3 and cleavage of PARPwere measured by Western blot analysis.The protein level of Bcl-2,Bcl-XLand Mcl-1 was monitored by Western blotaswell.Chemically synthesized Mcl-1 siRNA was transfected into MGC-803 cells usingLipofectamine 2000 Reagent.The efficacy of gene silencing was confirmed by Western blotanalysis,and opoptotic rates before and after transfection wasmeasured by flow cytometry using Annexin V/PIstaining.Results UMI-77 was effective in induction of apoptosis in gastric cancerMGC-803 cells,apoptotic rateswere increased in a dose-dependentmanner.Mitochondrialmembrane potentialwas collapsed after UMI-77 treatment.Activation of Caspase-9,Caspase-3 and cleavage of PARP occurred at24 h(P<0.05).The expression level of Bcl-2 and Bcl-XLwere not altered after exposure to UMI-77,while Mcl-1 was down-regulated after 12 h(P<0.05).Transfection with Mcl-1 siRNA successfully decreased the expression level of Mcl-1 in MGC-803 cells(P<0.05)and blocked apoptosis induced by UMI-77(P<0.05).Conclusion UMI-77 induces apoptosis through activation of the intrinsic pathway in gastric cancer MGC-803 cells,and knocking down Mcl-1 expression abrogates apoptosis by UMI-77.
gastric cancer;UMI-77;Mcl-1;smallmolecule inhibitor;apoptosis
R 735.2
A
1000-1492(2016)04-0506-06
2016-01-18接收
安徽高校省级自然科学研究项目(编号:KJ2014A113)
安徽医科大学免疫学教研室,合肥230032
朱雪萍,女,硕士研究生;
张林杰,男,博士,教授,博士生导师,责任作者,E-mail:zlj33@ahmu.edu.cn
