PTP1B及瘦素信号通路在奥曲肽抗大鼠肝纤维化中的作用
2016-08-09陈元淦李方跃牛森森
陈元淦,张 超,李方跃,牛森森
PTP1B及瘦素信号通路在奥曲肽抗大鼠肝纤维化中的作用
陈元淦,张 超,李方跃,牛森森
目的 研究蛋白酪氨酸磷酸酶1B(PTP1B)在奥曲肽(OCT)治疗大鼠肝纤维化过程中的作用机制,及其对瘦素和JAK2-STAT3信号通路的影响。方法 将大鼠随机分为:空白组、OCT组、模型组。模型组和OCT组采用皮下注射四氯化碳(CCl4)法建立肝纤维化模型。饲养8周后,采集标本,全自动生化分析仪测定血清肝脏生化指标:总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)及大鼠血清白蛋白(ALB)。ELISA法测定瘦素水平,HE染色观察肝脏病理,免疫组化法检测肝组织瘦素及瘦素受体(Ob-Rb)的表达,碱水解法测定肝脏中羟脯氨酸(Hyp)含量。Western blot法检测肝组织内PTP1B、JAK2、STAT3、p-JAK2、p-STAT3的表达。结果 与空白组比较,模型组和OCT组大鼠血清中TBIL、ALT、AST水平上升(P<0.05),ALB水平明显降低(P<0.05),血清瘦素、肝组织内瘦素及瘦素受体表达增加(P<0.001)。肝组织中Hyp含量明显升
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.020.htm l高(P<0.05)。模型组及OCT组JAK2、STAT3磷酸化水平较空白组升高(P<0.001)。OCT组与模型组比较,肝脏生化指标改善明显,病理改变较轻,血清瘦素含量减少(P<0.05),肝组织内瘦素、Ob-Rb及Hyp含量降低(P<0.05),JAK2、STAT3磷酸化水平较模型组均有降低(P<0.05),而PTP1B表达增加(P<0.001)。结论 应用OCT能一定程度上减轻大鼠肝维化程度,减轻肝脏损伤。推测其机制是OCT通过上调PTP1B,抑制了瘦素及JAK2/STAT3信号通路的促肝纤维化效应,最终达到抗肝纤维化的目的。
瘦素;奥曲肽;蛋白酪氨酸磷酸酶1B;JAK2/STAT3
肝星状细胞(hepatic stellate cell,HSC)被认为在肝纤维化的发展过程中有重要地位。各种因素导致肝脏的损伤,使HSC被激活并产生细胞外机制[1]。瘦素与瘦素受体(obese receptor,Ob-Rb)结合,激活下游信号通路JAK2/STAT3,参与了HSC的增殖和活化[2-3]。蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)是JAK2/STAT3的负性调控因子。生长抑素是一种能抑制细胞因子合成与分泌的多肽,能够调节炎症、免疫过程。其可通过上调HSC内的PTP1B,抑制JAK2/STAT3磷酸化,从而抑制HSC的激活[4]。生长抑素类似物奥曲肽(octreotide,OCT),可被用于治疗门静脉高压症[5]。前期实验[6]显示,OCT能降低肝纤维化大鼠中瘦素及其受体的表达,减轻肝脏的损害。该实验通过建立肝纤维化模型,观察OCT对瘦素及其信号通路和PTP1B表达的影响,探究OCT在抗肝纤维化中的作用机制。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物 清洁级成年雄性SD大鼠45只,200~250 g,购自安徽医科大学实验动物中心,实验前在标准环境下适应性饲养。
1.1.2 药物试剂 四氯化碳(CCl4)及橄榄油购自国药集团有限公司。将CCl4与橄榄油配成40%的混合溶液(容积比4∶6)。5%乙醇溶液用于造模大鼠唯一饮水。OCT(0.1 mg/ml)购自瑞士Novartis Phama Schwaiz公司,将其稀释成200 ng/m l用于皮下注射;羟脯氨酸(hydroxyproline,Hyp)测试盒购自南京建成生物工程研究所;瘦素ELISA试剂盒购自上海源叶生物科技有限公司;兔抗鼠瘦素、瘦素受体抗体购自北京博奥森公司;ECL试剂盒、β-actin以及相应二抗均购自北京中杉金桥公司;Western blot所需一抗(JAK2、STAT3、p-JAK2、p-STAT3、PTP1B)购自英国abcam公司。
1.2 实验方法
1.2.1 动物分组及造模 将大鼠分为:空白组、OCT组、模型组,每组15只。OCT组给予腹部皮下注射OCT 100 ng/100 g,每天2次。空白组和模型组皮下注射等量生理盐水。肝硬化模型建立:模型组和治疗组于左右后肢交替注射40%的CCl4、橄榄油混合溶液(造模3周后出现注射部位溃烂,视情况更改为背部、颈部等部位皮下注射),注射后棉签按压,防止溢出。首次注射剂量为0.5 ml/100 g,维持剂量为0.3 ml/100 g(每隔3 d注射1次)。使用动物实验中心提供的普通饲料用于喂养,5%乙醇溶液为唯一饮用水(饮水状况不佳时调整乙醇溶液浓度以避免大鼠脱水)。空白组注射等量橄榄油及生理盐水,普通饲料及饮水喂养。造模时间为8周,实验过程中每3 d测量体重,用于调节药物剂量。
1.2.2 标本采集 末次给药24 h后,戊巴比妥钠腹腔麻醉后,腹主动脉采血,4℃冰箱静置120 min后,14 000 r/min离心,取上层血清保存,用于后续检测。肝左叶取1 cm×1 cm×1 cm肝组织,10%中性甲醛固定。肝右叶取相同大小肝组织,-80℃保存。
1.2.3 血清学检测 全自动生化分析仪(安徽医科大学第一附属医院检验科提供)测定总胆红素(total bilirubin,TBIL)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)及大鼠血清白蛋白(serum albumin,ALB)的含量。
1.2.4 形态学及病理学观察 甲醛固定后,肝脏组织常规石蜡包埋、切片、HE染色,普通光学显微镜下观察肝脏病理学改变。
1.2.5 检测肝脏组织瘦素和Ob-Rb的表达 免疫组织化学法测定大鼠肝脏瘦素及Ob-Rb的表达。将切片置于Leica DM4000光学显微镜下观察,400倍下每张切片随机选取5个不连续视野,将观察到的明显棕黄色颗粒视为阳性细胞。Leica DM4000进行拍摄,拍摄后的图片使用Image ProPlus 6.0图像分析系统测平均光密度(optical density,OD)值。
1.2.6 组织蛋白提取及测定 取大鼠肝组织20 mg,加入500μl RIPA细胞裂解液,玻璃匀浆器匀浆,置于冰上裂解30 min,离心机预冷至4℃,14 000 r/min离心10 min,取上清液。BCA法测定蛋白浓度,将样本蛋白总量调成一致。依据不同蛋白分子量,制备8%~10%SDS-PAGE进行蛋白电泳,120~160 min将蛋白转移到PVDF膜上,3%~5%脱脂奶粉37℃封闭2 h,一抗4℃摇床孵育过夜。一抗浓度分别为PTP1B(1∶500)、JAK2(1∶1 000)、p-JAK2(1∶1 000)、STAT3(1∶1 000)、p-STAT3(1∶1 000);TBST洗膜3次,TBS洗膜1次后将膜置于二抗中,常温下孵育1~2 h。TBST洗膜3次,TBS洗膜1次后,用ECL发光试剂盒发光。Quantity One软件分析条带灰度值。
1.2.7 ELISA法测定血清瘦素含量 按照试剂盒说明书进行操作,用酶标仪在450 nm波长下测定样本的吸光度值,随后对照标准曲线测出血清瘦素含量。
1.2.8 碱水解法测定肝脏Hyp含量 按照试剂盒说明书进行操作,用酶标仪在550 nm下测定样本吸光度值后计算出Hyp含量。
1.3 统计学处理 采用SPSS 17.0软件进行分析,数据以±s表示。单因素方差分析行多组间差异统计,LSD法进行组间两两比较。
2 结果
2.1 大鼠状况 模型组3只大鼠因感染和营养状况极差而死亡;OCT组死亡1只;空白组大鼠活动、饮食饮水无异常,精神状况好,体重逐渐增加;解剖见肝脏无肿大或萎缩,色泽红润,表面光滑,边缘锐利,脾脏色红润,无肿大。模型组大鼠于注射CCl4当天开始,精神状况逐渐变差,毛发干枯,饮食饮水逐渐减少;解剖见肝脏颜色较浅,表面欠光滑,边缘钝,可见大小不等的结节,脾脏明显肿大。OCT组大鼠精神,饮食饮水较模型组有明显改善;解剖见肝脏表面欠光滑,色泽较浅,表面结节较模型组明显减少,少数大鼠脾脏轻度肿大。
2.2 大鼠血清相关指标变化及肝组织中Hyp含量的变化 与空白组比较,模型组和OCT组血清AST、ALT、TBIL、肝组织中Hyp含量升高,ALB降低,差异有统计学意义(P<0.05);与模型组比较,OCT组TBIL、AST、ALT和Hyp均有改善,差异有统计学意义(P<0.05)。与空白组比较,模型组和OCT组瘦素表达水平均有升高,差异有统计学意义(P<0.05);与模型组比较,OCT组瘦素水平降低,差异有统计学意义(P<0.05)。见表1。
2.3 肝脏形态学检测 HE染色显示,与空白组比较,模型组肝细胞排列紊乱,部分肝细胞气球样变、脂肪样变以及点状坏死;结缔组织广泛增生包绕肝小叶,正常肝小叶被假小叶取代,中央静脉偏位或缺如。OCT组较模型组有明显改善,纤维间隔包绕的假小叶减少,炎性细胞浸润程度明显改善,肝细胞变性坏死明显减少。见图1。
2.4 瘦素及Ob-Rb的表达 瘦素及Ob-Rb的表达见于HSC的胞质和胞膜,为黄褐色细颗粒沉积。空白组肝细胞内无表达,或仅在肝窦间隙的间质细胞中及汇管区有极少量表达甚至是不表达;模型组瘦素及Ob-Rb表达明显增加,主要见于HSC中。在肝脏的汇管区、肝窦、血管周围瘦素及Ob-Rb表达增多。与模型组比较,OCT组阳性表达则明显减少。空白组瘦素表达量为(0.37±0.07),模型组(0.57 ±0.39)和OCT组(0.49±0.24)均比空白组明显增加,差异有统计学意义(F=25.204,P<0.001);与模型组比较,OCT组瘦素表达降低,差异有统计学意义(0.57±0.39 vs 0.49±0.24,P<0.05)。空白组Ob-Rb表达量为(0.38±0.09),模型组(0.55± 0.04)和 OCT组(0.46±0.05)均比空白组明显增加,差异有统计学意义(F=10.899,P<0.001);与模型组比较,OCT组Ob-Rb表达降低,差异有统计学意义(0.55±0.04 vs0.46±0.05,P<0.05),见图2。
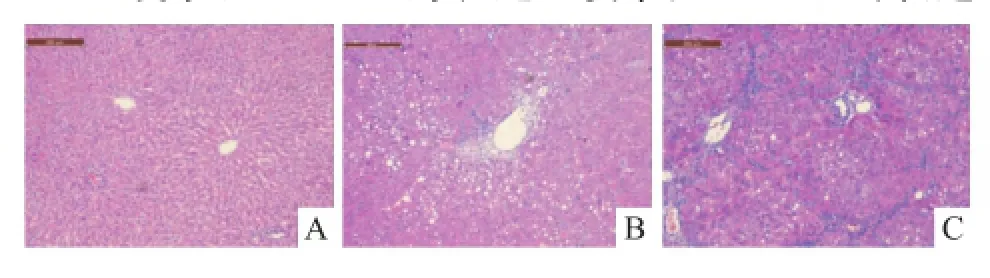
图1 肝组织 HE染色 ×100A:空白组;B:OCT组;C:模型组

图2 肝组织瘦素及Ob-Rb表达 ×400A:空白组;B:OCT组;C:模型组;1:瘦素;2:Ob-Rb
表1 大鼠血清TBIL、AST、ALT、ALB、瘦素及肝组织中Hyp含量(n=12,±s)

表1 大鼠血清TBIL、AST、ALT、ALB、瘦素及肝组织中Hyp含量(n=12,±s)
与空白组比较:*P<0.05;与 OCT组比较:#P<0.05
项目 空白组 OCT组 模型组 F值TBIL(μmol/L) 0.61±0.07 1.62±0.33* 2.01±0.31*#75.043 AST(U/L) 101±13 370±57* 470±50*# 185.036 ALT(U/L) 37±5 196±60* 294±51*# 81.375 ALB(g/L) 36.19±1.73 26.68±1.84* 26.49±1.69* 99.977瘦素(ng/m l) 8.24±0.37 10.62±0.87* 11.75±0.95*# 53.398 Hyp(mg/g) 5.43±0.65 9.45±0.78* 11.12±0.93*#136.328
2.5 肝组织内相关蛋白的表达 模型组PTP1B显著低于其他两组(P<0.001),OCT组PTP1B表达高于空白组(P<0.05);模型组和OCT组 p-JAK2较空白组明显升高(P<0.001),而OCT组的表达较模型组降低(P<0.05);模型组和OCT组p-STAT3表达较空白组明显升高(P<0.001),OCT组较模型组降低(P<0.05)。见图3、4。
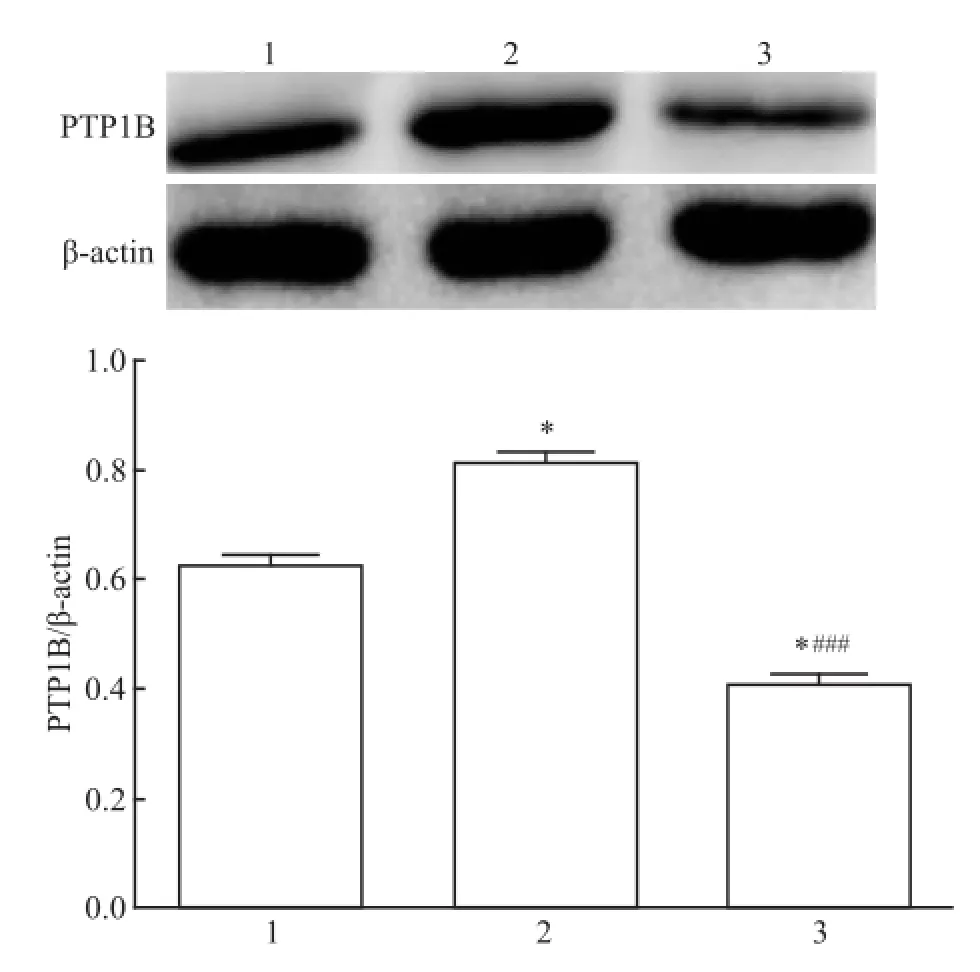

图3 PTP1B表达水平1:空白组;2:OCT组;3:模型组;与空白组比较:*P<0.05;与OCT组比较:###P<0.001
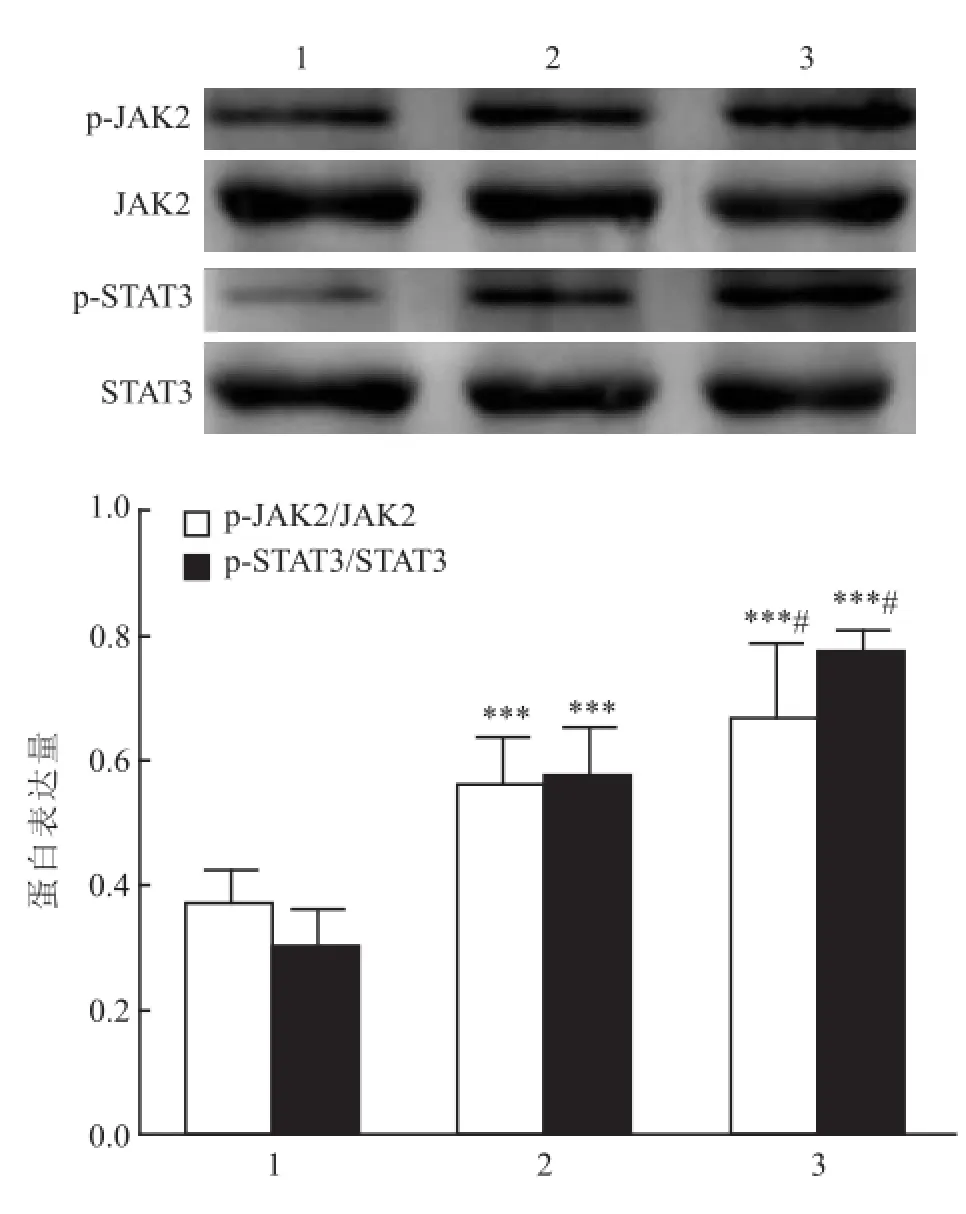

图4 STAT3、p-STAT3、JAK 2、p-JAK 2表达水平1:空白组;2:OCT组;3:模型组;与空白组比较:***P<0.001;与OCT组比较:#P<0.05
3 讨论
CCl4诱导形成肝纤维化模型是最经典和广泛的建模方法。本实验利用该方法可制备有效的肝纤维化模型[7]。TBIL、ALT、AST和ALB是反应肝脏功能的重要指标。Hyp为胶原纤维中特有的氨基酸,由于肝纤维化时肝内主要增加的成分为胶原纤维,测量肝Hyp的含量可以反应肝纤维的程度。实验结果显示,与模型组比较,OCT组大鼠生存状态较好,解剖可见肝脏、脾脏外观有明显改善;肝脏血清指标提示TBIL、ALT、AST降低明显,肝 Hyp含量显著降低,肝脏病理改变较轻,纤维间隔包绕的假小叶明显减少。在大鼠肝纤维化模型中应用OCT,能明显改善大鼠生存质量,一定程度上减轻肝纤维化程度,缓解肝纤维化所致的肝功能损害。肝纤维化是病毒、药物、毒物等各种因素导致的慢性肝损伤,HSC增殖活化是肝纤维化发生发展的重要环节。前期实验[4]显示:生长抑素能够抑制HSC的增殖和活化。推测OCT作为生长抑素类似物,能一定程度上抑制HSC的增殖活化,从而具有一定的抗肝纤维化作用,进而缓解了肝脏的损伤。瘦素是近年来发现的调控HSC的重要因子,HSC也能够参与合成和分泌瘦素[8]。实验结果显示,模型组和OCT组大鼠肝脏内Hyp含量增加,血清瘦素、肝组织中瘦素及其受体表达水平升高,证实了瘦素与肝纤维化程度密切相关。与OCT组比较,模型组大鼠肝功能指标TBIL、ALT、AST明显升高,肝纤维化指标Hyp增加,血清瘦素水平增加,肝组织瘦素和Ob-Rb表达增加。说明OCT缓解肝纤维化所致的肝功能损害,可能是基于其抑制了瘦素及其受体的表达。瘦素与Ob-Rb结合后,JAK2-STAT3是主要的下游信号转导通路[9],而PTP1B是调节JAK2-STAT3磷酸化的重要因子。Western blot法检测显示,OCT组PTP1B的表达较模型组和空白组均明显增加,且JAK2/ STAT3的磷酸化程度减小。提示OCT可能上调了PTP1B的表达,较高表达的PTP1B使瘦素下游通路JAK2/STAT3的磷酸化程度降低,这与相关文献[10]报道相一致。
综上所述,在CCl4诱导的肝纤维化模型中应用OCT,能够上调体内PTP1B水平,抑制瘦素下游信号通路JAK2/STAT3的磷酸化。结合前期细胞水平的研究,推测OCT通过该作用机制,抑制HSC的增殖与活化,最终能一定程度上抑制肝纤维化并减轻肝脏损害。但是OCT促进PTP1B的表达是否是其保护作用的唯一机制,以及其是否具有时间和剂量依赖性等问题仍然值得进一步研究。
[1] Lee U E,Friedman SL.Mechanisms of hepatic fibrogenesis[J]. Best Pract Res Clin Gastroenterol,2011,25(2):195-206.
[2] De Minicis S,SekiE,Oesterreicher C,etal.Reduced nicotinamide adenine dinucleotide phosphate oxidase mediates fibrotic and inflammatory effects of leptin on hepatic stellate cells[J].Hepatology,2008,48(6):2016-26.
[3] Handy JA,Fu PP,Kumar P,etal.Adiponectin inhibits leptin signaling via muLtiple mechanisms to exert protective effects against hepatic fibrosis[J].Biochem J,2011,440(3):385-95.
[4] 牛森森,张 超,李方跃,等.生长抑素阻断瘦素诱导肝星状细胞增殖及基质分泌的分子机制[J].实用医学杂志,2014,30 (20):3216-9.
[5] Zhang C,Xu JM,Kong D R,etal.Immediate effects of different schedules of somatostatin on portal pressure in patients with liver cirrhosis[J].JClin Pharm Ther,2008,38(3):206-11.
[6] 姚 磊,张 超,李方跃,等.奥曲肽对实验性肝纤维化大鼠瘦素及功能性瘦素受体表达的影响[J].安徽医科大学学报,2012,47(7):800-4.
[7] Vanheule E,Geerts A M,Reynaert H,et al.Influence of somatostatin and octreotide on livermicrocirculation in an experimental mousemodel of cirrhosisstudied by intravital fluorescencemicroscopy[J].Liver Int,2008,28(1):107-16.
[8] Saxena N K,Titus M A,Ding X,et al.Leptin as a novel profibrogenic cytokine in hepatic stellate cells:mitogenesis and inhibition of apoptosis mediated by extracelluLar reguLated kinase (Erk)and Akt phosphorylation[J].FASEB J,2004,18(13):1612-4.
[9] Park H K,Ahima R S.Leptin signaling[J].F1000Prime Reports,2014,6:73.
[10]White S J,Taylor M J,Hurt R T,et al.Leptin-based adjuvants:an innovative approach to improve vaccine response[J].Vaccine,2013,31(13):1666-72.
Octriotide promotes PTP1B expression to protect carbon tetrachloride-induced hepatic fibrogenesis rats
Chen Yuangan,Zhang Chao,Li Fangyue,et al
(Dept of Liver and Biliary Pancreatic Surgery,
The First Affiliated Hospital of AnhuiMedical University,Hefei 230022)
Objective To investigate the mechanisms of octriotide(OCT)protecting carbon tetrachloride-induced hepatic fibrogenesis rats and the effects of protein tyrosine phosphatase 1B(PTP1B)on leptin and JAK2/STAT3 signaling.Methods Adultmale SD ratswere divided into three groups:control,OCT and model group.The liver fibrosismodelswere induced with carbon tetrachloride(CCl4).The levels of total bilirubin(TBIL),alanine aminotransferase(ALT),aspartate aminotransferase(AST),serum albumin(ALB)and leptin in serum and Hyp in liver were tested and histopathology changes were observed.Leptin and obese receptor(Ob-Rb)expressions were observed by immunohistochemical staining.The expressions of the phosphorylation of Janus kinase2(JAK2),signal transducers and activators of transcription 3(STAT3)and PTP1B were tested by Western blot.Resu lts In model and OCT group,compared with the control group,the levels of TBIL,ALT,AST and leptin in serum increased and serum ALB decreased(P<0.05).Compared with the control group,in model and OCT group,the expressions of Hyp,p-JAK2,p-STAT3,leptin and Ob-Rb in liver increased(P<0.05).In OCT group,with lower leptin,OBRb and Hyp expression,the injury of hepatic histopathology was less serious than that in model group.In model group,the expressions of p-JAK2 and p-STAT3 rosemore evidently than OCT group(P<0.05),while PTP1B expressions were lower(P<0.001).Conclusion OCT can ease the CCl4-induced hepatic injury and relieve liver fibrosis.OCT dampens leptin signaling by stimulating PTP1B expression,which is a negative regulator of JAK2/ STAT3,and thus inhibits liver fibrosis.
leptin;octreotide;protein tyrosine phosphatase;JAK2/STAT3
2016-01-18接收
安徽省教育厅自然科学基金(编号:KJ2014A117)
安徽医科大学第一附属医院肝胆胰外科一病区,合肥230022
陈元淦,男,硕士研究生;
张 超,男,副教授,主任医师,硕士生导师,责任作者,E-mail:smallcloud2@hotmail.com
R 575.2
A
1000-1492(2016)04-0501-05
