高糖诱导人肾近曲小管上皮细胞凋亡及其调控机制
2016-08-09袁育珺段惠芳胡志坚
袁育珺,段惠芳,胡志坚,汪 渊
高糖诱导人肾近曲小管上皮细胞凋亡及其调控机制
袁育珺1,段惠芳2,胡志坚1,汪 渊3
目的 研究高糖诱导人肾近曲小管上皮细胞凋亡及其调控机制。方法 以人肾近曲小管上皮细胞株HK-2为研究对象,随机分为对照组、高糖组、甘露醇组。MTT、流式细胞术观察细胞的增殖和凋亡状况;ELISA法检测细胞内Caspase的活性;Western blot法分析B淋巴细胞瘤-2(Bcl-2)及Caspase家族蛋白的表达变化。结果 与对照组比较,高糖组能抑制HK-2细胞的体外增殖,下调抑制凋亡作用的蛋白Bcl-2表达,上调促凋亡作用的蛋白Bax、Bak表达(P<0.05);流式细胞术显示HK-2细胞周期有明显的变化,且随葡萄糖浓度的升高中期凋亡和末期凋亡所占的比例明显上升(P<0.01),并且Caspase酶原降解及活性表达也呈上升趋势(P<0.01)。结论 高糖能抑制HK-2细胞体外增殖,并诱导其凋亡,其机制可能是通过Bcl-2及Caspase家族调控HK-2细胞的凋亡。
高糖;HK-2;凋亡;表达
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.018.htm l
细胞凋亡是生理性过程,不同于细胞坏死;凋亡细胞能产生吞噬和清除碎片的凋亡小体,避免周围环境中细胞损害,维持内环境稳定[1]。糖尿病肾病(diabetic nephropathy,DN)发病机制复杂,DN早期,肾脏通过细胞凋亡等应急反应来清除过度增殖的内皮细胞,维持内环境稳定;DN晚期,随着肾功能障碍,内环境稳态破坏,细胞凋亡过度,致使肾损害也加剧[2-3]。了解和干预肾小管内皮细胞凋亡有助于延缓DN进展。该研究采用体外培养人肾近曲小管上皮细胞株HK-2细胞,分析高糖坏境下HK-2细胞的增殖和凋亡状况、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)及Caspase家族蛋白表达的变化,并进一步探讨这些作用可能的分子调控机制。
1 材料与方法
1.1 材料 低糖(5.5 mmol/L)DMEM(美国Gibico公司);D-glucose、医用甘露醇(北京国药集团公司);Gibco原装小牛血清(北京索莱宝科技有限公司);HK-2由中国科学技术大学生命科学院赠送,液氮保存;Annexin V-FITC(安徽碧云天生物试剂公司);一抗actin、Caspase-3、Caspase-9、Bcl-2、Bax、Bak、Caspase-7(美国Santa Cruz公司);MTT(美国Sigma公司);二抗(美国Pierce公司)。
1.2 方法
1.2.1 细胞培养和分组 液氮取出HK-2细胞,37℃水浴解冻,迅速接种于含10%小牛血清低糖DMEM(葡萄糖浓度5.5 mmol/L),37℃、5%CO2饱和湿度的细胞培养箱中。胰酶消化传代,备用。分组:对照组(葡萄糖浓度为5.5 mmol/L)、高糖组(葡萄糖浓度分别为25、40 mmol/L)和甘露醇组(葡萄糖浓度5.5 mmol/L+甘露醇浓度分别为19.5、34.5 mmol/L)。
1.2.2 MTT法检测细胞增殖 取生长旺盛的HK-2细胞,胰酶消化,按1.2.1分组,MTT实验严格按照前期报道[4]操作,实验重复3次。
1.2.3 Annexin V-FITC分析细胞凋亡 取对数期生长的HK-2细胞,胰酶消化传代,制成细胞悬液,取合适的量平均接种于6孔板,次日按1.2.1分组,37℃刺激48 h,各组胰酶消化制成约1×106个/ml细胞悬液。400μl Annexin V结合液重悬,加入5μl Annexin V-FITC染色液,2~8℃避光孵育15 min。4℃冷冻离心5 min(10 000 r/min),去除上清液,再用400μl Annexin V结合液重悬,10μl/孔PI染色液,震动器轻轻混匀;锡箔纸包裹置冰上孵育5 min,然后上机检测。
1.2.4 Caspase蛋白酶原活性检测 原理:依据ELISA抗原抗体结合的原理,细胞内活性的Caspase-7、Caspase-3、Caspase-9能在体外与相应的酶结合,催化底物显色反应,通过吸光度(optical density,OD)值OD405来间接反应Caspase-7、Caspase-3、Caspase-9的活性。取对数期生长的HK-2细胞,按1.2.3步骤操作,分组后置于培养箱连续刺激2 d,胰酶消化,冷冻离心5 min(10 000 r/min),按照ELISA法操作,依次加入酶、底物、酶标仪检测,实验重复3次。
1.2.5 Western blot法检测 提取总蛋白:按1.2.1分组批量培养,刺激48 h后,弃去原液并用PBS洗去残留液体,置冰上,每瓶加裂解液150μl充分裂解,细胞刮子收集细胞,低温冷冻离心5 min(10 000 r/min),上清液置于-80℃备用,BCA测定蛋白浓度,每组加入浓缩蛋白上样缓冲液,水浴煮沸,分装备用,置于 -20℃保存。配制12.5%SDS-PAGE,微量加样针上样,先用40~50 V电泳浓缩胶,100 V电泳分离胶,100 mA冰浴转膜,伊利脱脂牛奶封闭,PBS洗膜,置于一抗为Bcl-2(1∶400),Caspase-7(1 ∶1 000),Bak(1∶1 000),Bax(1∶300),Caspase-3 (1∶2 000),Caspase-9(1∶800),actin(1∶1 000),4℃过夜。相应二抗分别为山羊抗小鼠(1∶1 500),山羊抗鼠(1∶1 500),山羊抗兔(1∶1 000),山羊抗鼠(1∶1 000),山羊抗鼠(1∶1 000),山羊抗兔(1 ∶1 000),山羊抗小鼠(1∶4 000),37℃孵育2 h,PBS洗膜3次,暗室内胶片显影、定影,重复实验3次。结果进行统计学分析。Western blot条带的灰度值用Image Pro 4.5分析软件测定。
1.3 统计学处理 采用SPSS 19.0软件进行统计学单因素方差分析,数据用±s表示。组间计量资料用方差分析。
2 结果
2.1 高糖对HK-2细胞的体外增殖的影响 MTT
结果采用单因素方差分析进行主体间效应检测,显示差异有统计学意义(F=112.04,P<0.01)。组间两两比较显示,与对照组比较,高糖组(25、40 mmol/ L)的OD值依次降低,且糖浓度为40 mmol/L抑制率达26.6%(P<0.05,P<0.01);而甘露醇组与对照组比较,差异无统计学意义,表明体外高糖能抑制HK-2细胞的体外增殖,与高晶体渗透压无关。见表1。

表1 不同浓度葡萄糖对HK-2细胞的增殖的影响(n=5)

图1 Annexin V-FITC检测高浓度葡萄糖对 HK-2细胞凋亡的影响A:对照组;B:25 mmol/L葡萄糖;C:40 mmol/L葡萄糖;D:5.5 mmol/L葡萄糖+19.5 mmol/L甘露醇;E:5.5 mmol/L葡萄糖 +34.5 mmol/甘露醇
2.2 高糖对HK-2细胞凋亡的影响 结果采用单因素方差分析进行主体间效应检测,差异有统计学意义(F=82.54,P<0.01)。组间两两比较显示:与对照组(9.9%)比较,高糖组(图1B、1C)中期凋亡与末期凋亡所占的比例明显升高,并且末期凋亡所占的比例随着葡萄糖浓度的升高而升高;从图1D、1E中可以观察到甘露醇对细胞的凋亡影响不明显。提示高糖能诱导HK-2细胞凋亡,与高晶体渗透压无关。见图1、表2。
2.3 高糖对Caspase蛋白酶原活性的影响 单因素方差分析显示高糖能够增强Caspase-7、Caspase-3、Caspase-9活性(F=71.43、55.81、74.32,P<0.01)。组间两两比较显示:与对照组比较,高糖组Caspase-7、Caspase-3、Caspase-9活性呈上升趋势,但甘露醇组活性没有明显变化。见图2。
2.4 高糖对Bcl-2及Caspase蛋白酶原家族蛋白表达的影响 单因素方差分析显示高糖上调Bak、bax、cleaved-Caspase-9、cleaved-Caspase-3、cleaved-Caspase-7蛋白表达(F=27.41、47.54、37.22、41.77、25.47,P<0.01);下调Bcl-2蛋白表达(F= 33.14)。组间两两比较显示:与对照组比较,Bcl-2家族Bcl-2蛋白表达量有所下降,Bak、Bax蛋白表达量显著上升,且Bax/Bcl-2的比值也呈上升趋势。另外剪切后的Caspase蛋白酶原家族cleaved-Caspase-9、cleaved-Caspase-3、cleaved-Caspase-7蛋白表达明显增加,见图3。

图2 Caspase-3、Caspase-7、Caspase-9活性检测(n=4,±s)A:Caspase-7;B:Caspase-3;C:Caspase-9;1:对照组;2:5.5 mmol/L葡萄糖+19.5 mmol/L甘露醇;3:5.5 mmol/L葡萄糖 +34.5 mmol/甘露醇;4:25 mmol/L葡萄糖;5:40 mmol/L葡萄糖;与对照组比较:**P<0.01
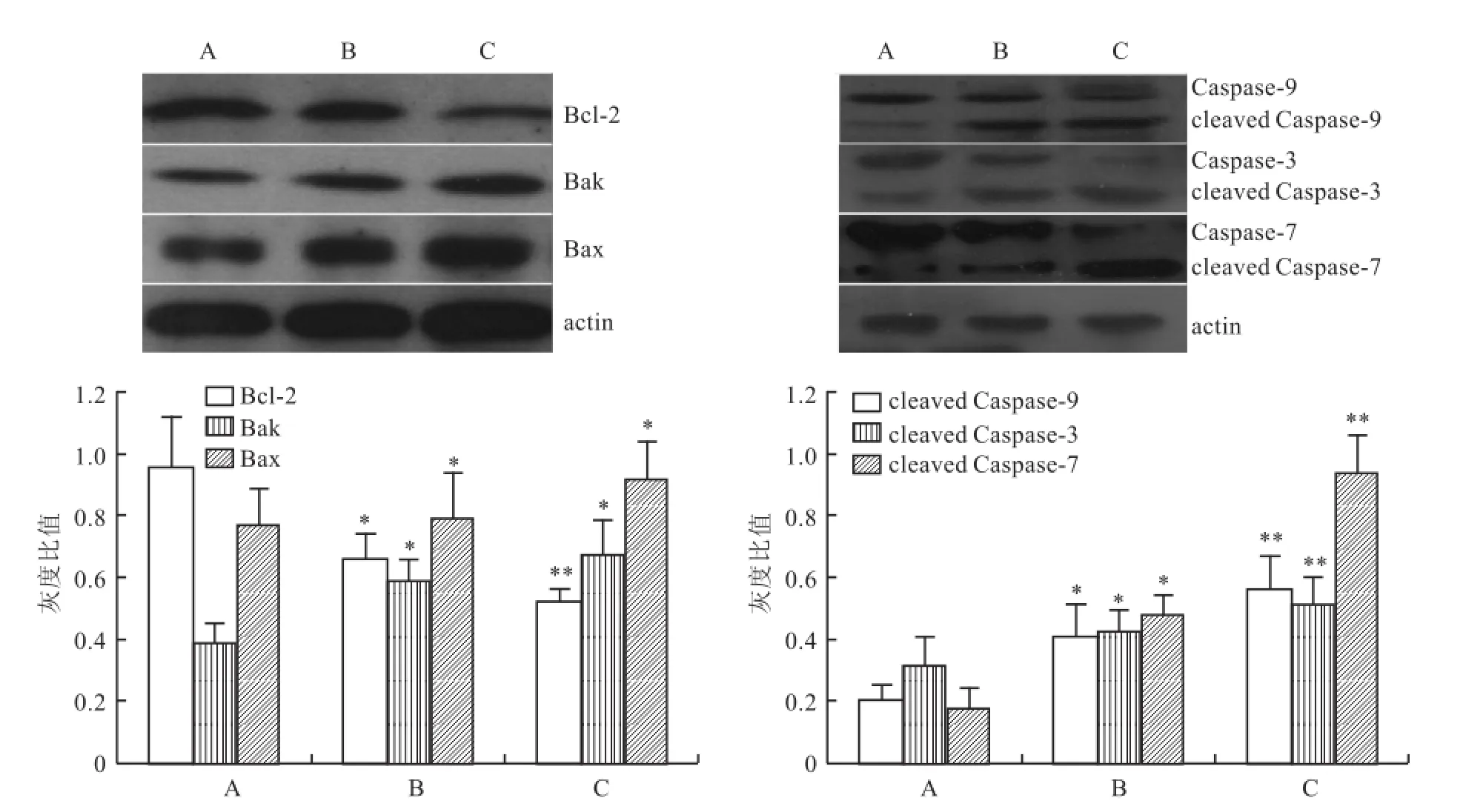
图3 高浓度葡萄糖对HK-2细胞相关凋亡蛋白表达的变化A:对照组;B:25 mmol/L葡萄糖;C:40 mmol/L葡萄糖;与对照组比较:*P<0.05,**P<0.01

表2 不同浓度葡萄糖对HK-2细胞周期的影响(%)
3 讨论
DN是糖尿病重要并发症之一,其基本病理特征主要表现为肾小球细胞外基质聚集与降解紊乱,导致肾小球病态增生、基底膜增厚和动脉硬化等,这些改变严重影响肾小管的营养供应,诱发上皮细胞程序性凋亡,从而导致肾间质纤维化[5]。国外相关报道[6]证实终末期肾病肾小球损伤多数从肾小球上皮细胞(足细胞)损伤开始;在糖尿病的早期,长期处于高糖环境下的细胞微环境发生改变,导致肾小球超过滤、诱发氧化应激、糖化终产物堆积、蛋白激酶C的激活、多元醇化、转化生长因子的过表达和炎症等,这些因素致使肾小管基底膜增厚,养分供应受阻,引起肾小管上皮细胞萎缩,导致肾衰竭。因此干预肾小管上皮细胞凋亡,维持上皮细胞活性,能有效的减缓肾脏的衰竭[5]。
体内长期高血糖容易导致上皮、内皮细胞损伤和功能障碍,从而诱发多种疾病,如2型糖尿病等;因此,控制血糖,并通过调节细胞增殖和凋亡修复损伤的细胞有重要的临床意义[7-8]。本研究模拟体内高糖环境,选取稳定性较好的人肾近曲小管上皮细胞株HK-2进行体外培养。作为维持近曲小管功能的上皮细胞,HK-2细胞的功能障碍在DN的发生发展中扮演着重要角色。实验表明高糖刺激48 h后HK-2细胞的增殖抑制,且出现细胞凋亡现象。
Bcl-2家族和Caspase共同参与调控细胞凋亡[9-10]。Bcl-2家族通过调控Bcl-2与Bax、Bak之间的比例,改变线粒体膜的通透性释放细胞色素C等促凋亡蛋白[11-12],诱导细胞凋亡。而Caspase家族分工协作,Caspase-9感受线粒体发出的死亡信号;Caspase-3属于凋亡效应子,能直接引起细胞凋亡;Caspase-7能促使ROS表达,诱导内质网应激,参与细胞凋亡[13-15]。本实验Western blot结果表明HK-2细胞内Bcl-2家族和Caspase家族均被激活,表现为Bcl-2蛋白表达量下降,Bak、Bax蛋白表达量上升,且Bax/Bcl-2的比值也呈上升趋势。另外Caspase蛋白酶原家族Caspase-9、Caspase-3、Caspase-7酶原降解及活性表达也呈上升趋势。推测高糖可能是通过某种途径激活Bcl-2家族,释放细胞色素C,引起Caspase酶原降解,活化Caspase家族启动级连反应,诱导HK-2细胞发生凋亡。详细机制有待进一步研究。
[1] Krysko D Y,Vanden Berqhe T,D’Herde K,et al.Apoptosis and necrosis:detection,discrimination and phagocytosis[J].Methods,2008,44(3):205-21.
[2] Verzola D,Gandolfo M T,Ferrario F,et al.Apoptosis in the kidneys of patientswith type IIdiabetic nephropathy[J].Kidney Int,2007,72(10):1262-72.
[3] KolatiSR,Kasala ER,Bodduluru LN,etal.BAY 11-7082 ameliorates diabetic nephropathy by attenuating hyperglycemia-mediated oxidative stress and renal inflammation via NF-κB pathway [J].Environ Toxicol Pharmacol,2015,39(2):690-9.
[4] 袁育珺,朱华庆,周 青,等.高浓度葡萄糖诱导HepG-2细胞凋亡及其调控的相关机制[J].安徽医科大学学报,2011,46 (12):1223-6.
[5] Zhao X,Liu G,Shen H,et al.Liraglutide inhibits autophagy and apoptosis induced by high glucose through GLP-1R in renal tubular epithelial cells[J].Int JMol Med,2015,35(3):684-92.
[6] Asanuma K.The role of podocyte injury in chronic kidney disease [J].Nihon Rinsho MenekiGakkaiKaishi,2015,38(1):26-36.
[7] Song H,Wu F,Zhong Y,et al.Irisin promotes human umbilical vein endothelial cell proliferation through the ERK signaling pathway and partly suppresses high glucose-induced apoptosis[J]. PLoSOne,2014,9(10):e110273.
[8] Triqqle C R,Samuel SM,Ravishabkar S,et al.The endothelium:influencing vascular smoothmuscle inmany way[J].Can JPhysiol Pharmacol,2012,90(6):713-8.
[9] Liu J,Yao Y,Qing H,Chen R.Oxymatrine triggers apoptosis by regulating Bcl-2 family proteins and activating caspase-3/caspase -9 pathway in human leukemia HL-60 cells[J].Tumour Biol,2014,35(6):5409-15.
[10]Galluzzi I,Vitale I,Abrams JM,et al.Molecular definitions of cell death subroutines:recommendations of the Nomenclature Committee on Cell Death 2012[J].Cell Death Differ,2012,19(1):107 -20.
[11]Han C R,Jun do Y,Lee JY,et al.Prometaphase arrest-dependent phosphorylation of Bcl-2 and Bim reduces the association of Bcl-2 with Bak or Bim,provoking Bak activation and mitochondrial apoptosis in nocodazole-treated Jurkat T cells[J].Apoptosis,2014,19(1):224-40.
[12]曹军军,杨茂伟,郭宝磊,等.高糖通过线粒体途径诱导成骨细胞凋亡[J].中国生物化学与分子生物学报,2012,28(12):1109-14.
[13]Chen X,Wang J,Qin Q,et al.Mono-2-ethylhexyl phthalate induced loss of mitochondrial membrane potential and activation of Caspase3 in HepG2 cells[J].Environ Toxicol Pharmacol,2012,33(3):421-30.
[14]Wu C Y,Tang ZH,Jiang L,etal.PCSK9 siRNA inhibits HUVEC apoptosis induced by ox-LDL via Bcl/Bax-caspase9-caspase3 pathway[J].Mol Cell Biochem,2012,359(1-2):347-58.
[15]Liu J,Yao Y,Dinq H,et al.Oxymatrine triggers apoptosis by regulating Bcl-2 family proteins and activating caspase-3/caspase-9 pathway in human leukemia HL-60 cells[J].Tumour Biol,2014,35(6):5409-15.
High glucose can inhibit the proliferation of HK-2 cells in vitro and induce its apoptosis,and itsmechanism may regulate the apoptosis of HK-2 cells through Bcl-2 and Caspase families.
Apoptosis of HK-2 cells induced by high glucose and its regulation mechanism
Yuan Yujun1,Duan Huifang2,Hu Zhijian1,et al (1Clinical Laboratory,2Medicare Office,The Affiliated Hospital of Jiujiang University,Jiujiang 332000)
Objective To investigate high glucose-induced apoptosis in HK-2 cells and its possible regulation mechanism.Methods HK-2 cells were divided into three groups and treated as follows:normal group,high glucose groups,mannitol groups.The cell proliferation and apoptosis of HK-2 cellwas analyzed by MTT,flow cytometry.The expression of Bcl-2 and Caspase family proteins were studied by Western blot,and the activity of Caspase family was analyzed by ELISA.Resu lts High glucose could inhibit growth of HK-2 cells.Moreover,high concentrations of glucose could also induce apoptosis with the concentration increased more obviously(P<0.01).Western blot showed that high glucose down-regulated Bcl-2,increased Bak,Bax expression(P<0.05).Conclusion
high glucose;HK-2;apoptosis;expression
R 735.7
A
1000-1492(2016)04-0497-05
2016-01-08接收
国家自然科学基金(编号:81272399)
九江学院附属医院1检验科、2医保办,九江 332000
3安徽省/省部共建教育部重要遗传病基因资源利用重点
实验室,合肥 230032
袁育珺,男,硕士;
汪 渊,男,教授,博士生导师,责任作者,E-mail:wangyuan@ahmu.edu.cn
