基于AMMI模型分析凡纳滨对虾选育家系基因型与环境互作效应
2016-08-09钱佳慧胡志国刘建勇
钱佳慧,胡志国,刘建勇*
(1.广东海洋大学 水产学院,广东 湛江 524088)
基于AMMI模型分析凡纳滨对虾选育家系基因型与环境互作效应
钱佳慧1,胡志国1,刘建勇1*
(1.广东海洋大学 水产学院,广东 湛江 524088)
摘要:为选育出具有广适性和适应某一特定环境的凡纳滨对虾(Litopenaeus vannamei)家系,实验采用巢式交配设计建立了凡纳滨对虾选育家系,并从中选出7个体质量性状优良的家系进行主效可加互作可乘模型(AMMI)分析,得出7个凡纳滨对虾选育家系体质量基因型与环境互作效应。结果表明,凡纳滨对虾7个家系的基因型与环境互作效应(G×E)达极显著水平(P<0.01);G×E效应平方和占总平方和的20.608%,家系效应平方和占总平方和的12.814%,环境效应平方和占总平方和的64.289%,说明家系体质量差异受环境效应影响显著,此外环境与基因型互作效应对体质量也存在影响,且影响力大于家系效应;基于双标图AMMI模型分析和稳定性参数分析,家系G2产量较高,为12.90 g,但G2对环境的选择能力以及依赖性较强,不适合广泛推广;G6产量为9.00 g,与G2相比虽然产量稍低,但其家系稳定性较高,对环境选择能力以及依赖性较弱,适合在多种类型环境下养殖,因此G6为中产、稳定、广适应性的家系,其基因型适合新品系的选育及推广;通过AMMI模型双标图功能形态分析,G11在E1环境中体质量最高产,适合与在E1环境下推广;G2在E2环境中最高产,适合在E2环境下推广;G5在E3环境中体质量最高产,适于在E3环境下推广。
关键词:凡纳滨对虾;AMMI模型;基因型;环境;互作效应
1引言
凡纳滨对虾(Litopenaeusvannamei)是我国对虾类产业的主要品种之一,目前养殖产量可高达130万吨,约占国内对虾养殖总产量的90%[1]。然而随着养殖规模扩大,我国养殖凡纳滨对虾逐渐出现发病和死亡率升高、生长缓慢、形态畸形、规格参差不齐等种质退化现象[2]。面临以上出现的诸多问题,培育出抗逆性强、生长速度快、性能稳定的凡纳滨对虾新品种已成为众多学者首要的科研工作。目前国内已培育出“科海1号”、“中科1号”、“中兴1号”和“桂海1号”等新品种,这些新品种在一定程度上减缓了凡纳滨对虾种质退化[3],然而新品种的培育多处于理想环境下养殖,实际生产中养殖环境与育种环境存在较大差异,如海水盐度、养殖密度、养殖模式等,这些差异不可避免地产生基因型与环境互作效应[4—5]。因此在家系选育过程中,开展核心育种家系基因型和养殖环境之间互作效应研究至关重要。
基因型与环境互作效应(G×E)是环境差异对基因型具有不同作用效果,即基因型的表型值随环境变化而发生改变[6]。G×E效应对家系适应环境能力鉴定、家系推广、以及育种区域规划具有重要意义[7],目前水产动物育种中对G×E效应研究日渐增多,在鱼类和贝类方面,已对罗非鱼(Oreochroumisniloticus)[8]、大菱鲆(Scophthalmusmaximus)[9]、杂色鲍(Haliotisdiversicolor)[10]、长牡蛎(Crassostreagigas)[11]等进行G×E效应研究,且G×E效应均达显著水平。对虾方面有关G×E效应研究主要来自于国外,如Ibarra和Famula[12]研究了凡纳滨对虾在不同密度养殖下基因型和环境互作对其体质量的影响;Gitterle等[13]对哥伦比亚5个不同养殖环境下的430个家系凡纳滨对虾进行研究,发现凡纳滨对虾体质量间具有高度的遗传相关性,且G×E效应不显著;Campos等[14]研究表明,单独估计凡纳滨对虾家系间遗传力为0.14~0.23,结合环境因素估计遗传力为0.26~0.39,两种差距不显著。国内对凡纳滨对虾家系基因型×环境效应研究较少,目前仅有栾生[3]、金武[4]等进行了初步研究,且采用方法为线性混合模型(AIREML)。而将AMMI模型应用于对虾基因型×环境效应研究未见报道。国内外研究表明AMMI模型是研究品种稳定性较理想的模型方法[15—17],该模型又称主效可加互作可乘模型,它主要特点是将主成分分析与方差分析结合起来,从加性模型中的互作相分离出若干个乘积相之和,提高对品种估计的准确性。目前AMMI模型在农作物区域种植中广为应用,在水产动物育种及品系应用上较少,仅在大菱鲆(Scophthalmusmaximus)[9]、合浦珠母贝(Pinctadafucata)[18]中得到应用,在对虾育种及家系稳定性鉴定方面尚未得到应用,因此本实验采用AMMI模型分析7种不同家系凡纳滨对虾在3种不同养殖环境下基因型和环境之间的互作效应,旨在选育出具有普适性的优良基因型以及适应于某一特定区域的特定基因型,为凡纳滨对虾新品种选育和优良家系的建立具有重要理论和实际意义。
2材料与方法
2.1实验材料
实验在广东海洋大学遗传选育中心(广东海洋大学东海岛研究基地)进行,选出9个生长性状较为优良的引进群体作为下代家系选育的亲本,其中包括广东海洋大学家系B(HB),来源于广东海洋大学遗传选育中心;广东海洋大学家系C(HC),来源于广东海洋大学遗传选育中心;科海1号(KH);美国SIS自交一代(SIS×SIS);美国迈阿密群体与夏威夷群体杂交一代(M×HI);海大抗热家系与粤海选育群体杂交一代(HD×YH);粤海选育群体与美国科纳湾海洋亲虾杂交(YH×KN)一代;美国SIS抗病一代(KB1);美国迈阿密群体自交一代(M×M)。
2014年6-7月,分别从亲本家系中挑选性腺发育成熟,活力较好的对虾进行杂交,其中建立的7个家系生长性状优良,作为实验研究家系,分别为1#家系(HC♀×(HD×YH)♂,G1)、2#家系(HC♀×(YH×KN)♂,G2)、3#家系(HB♀×HB♂,G3)、4#家系(KH♀×(YH×KN)♂,G4)、5#家系(HB♀×(SIS×SIS)♂,G5)、6#家系((SIS×SIS)♀×KB1♂,G6)、11#家系((M×HI)♀×(M×M)♂,G11)。每个家系幼体孵育均在孵育车间独立的200 L孵化桶中进行,孵化后在桶中培育至仔虾。当仔虾体长达3 cm时,进行“可视嵌入性荧光标记(VIE)”。每个家系内个体分为3部分:一部分(随机挑选200尾)饲养于室外水泥池(E1);一部分(随机挑选200尾)饲养于室内水泥池(E2);另一部分(随机挑选200尾)饲养于网箱(E3)。对每个家系放入每实验地点的200尾对虾进行标记区分后混养,养殖密度控制在100尾/m2左右(数量不足采用7个家系未标记个体进行补充)。实验期间水体温度为30~32℃,盐度为32,pH为7.8~8.0,饵料投喂以及日常管理等操作均相同。养殖90 d,测量每尾虾的体质量,记录个体的VIE颜色组合。
2.2分析方法
2.2.1AMMI 模型
AMMI(additive main effects and multiplicative interaction)模型即加性主效应和乘积交互作用模型,其特点是将主成分分析和方差分析相结合,其模型公式参照马爱军和王新安[9]方法计算:
(1)
式中,yge是环境e中基因型g的体质量,μ表示总体平均值,αg为基因型平均偏差(各个基因型平均值减去总的平均值),βe是环境的平均偏差(各环境的平均值减去总的平均值),λn是第n个主成分分析的特征值,γgn是第n个主成分的环境主成分得分,δgn是第n个主成分的基因型主成分得分,n是在模型主成分分析中主成分因子轴的总个数,θge为残差。
2.2.2稳定性参数
稳定性参数参照吕建华[19],特定基因型(或环境)在IPCA的k维空间中图标离原点的欧式距离公式:
(2)
式中,k=1,2,…,m,m是显著的IPCA个数,Dg(e)是第g个基因型或第e个环境在m个IPCA上的得分。Dg(e)的大小度量第g个基因型或第e个环境的相对稳定性,基因型Dg值越小越稳定,环境的De值越大对基因型的分辨力越强,即De值越大,基因型在环境中表现出的遗传差异越大,越有利于发挥基因型的特性。
3结果与分析
3.1产量方差分析和AMMI模型分析
在室外水泥池(E1)、室内水泥池(E2)和网箱(E3)3个实验点所采集的样本数量和规格见表1。经方差分析不同实验点的对虾平均体长和平均体质量存在显著差异(P<0.05),其中室内水泥池(E2)的平均体长和平均体质量最高,分别为(10.11±1.26)cm, (13.45±5.57)g。而网箱(E3)的平均体长和平均体质量最低,分别为(7.11±0.86)cm, (4.93±1.81)g。
从表2体质量方差分析可以看出,基因、环境以及基因与环境的交互作用差异差异达极显著(P<0.01),表明参试家系之间、实验地点以及家系与实验地点交互作用对凡纳滨对虾体质量影响显著。此外,从表2可以看出,家系基因型的平方和占总平方和的12.814%,环境间变异的平方和占总平方和的64.289%,家系和环境间的互作效应平方和占总平方和的20.608%。可见,在总变异中环境间的差异是引起体质量变化的主要原因。AMMI模型分析结果表明,IPCA1、IPCA2主成分轴未达显著水平(P>0.05),但IPCA3主成分轴达极显著水平(P<0.01)。IPCA1解释了交互作用的16.632%,IPCA2解释了交互作用的3.664%。

表1 不同测试点采集的样本数量和规格
注:实验数值上标表示多重比较结果,相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P>0.05)。
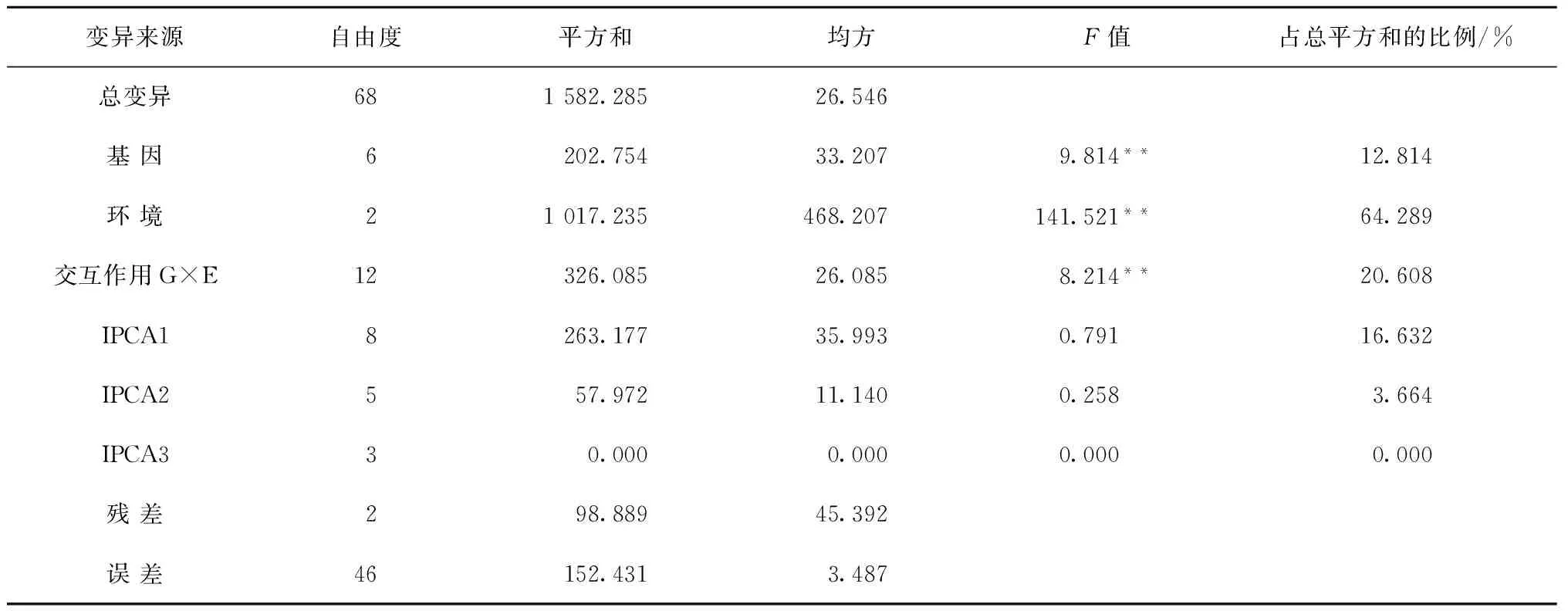
表2 体质量方差分析及AMMI模型分析
注:*表示差异达到显著水平,**表示差异达极显著水平。
3.2双标图AMMI模型分析
从家系和环境AMMI双标图可知(图1),横坐标表示各因素主效应值,即表示该因素水平之间的平均数差异。环境图标较家系图标更为分散,说明环境因素影响凡纳滨对虾体质量效果较家系因素影响效果明显,同一家系在各实验点条件下体质量差异显著,其中室内水泥池(E2)的体质量较高,网箱(E3)的体质量最低,纵坐标方向反映的是家系与环境间的互作差异,图标越接近IPCA1零值说明家系与环境互作效应越小,品种的稳定性越好或环境对家系差异的分辨能力越低。由图1可知,G1、G3、G4、G6、G11 5个家系的IPCA1值均在-1.5~1.0之间,说明以上5个家系对环境分辨能力较低。而G2的IPCA1绝对值较大,说明该家系易受到环境影响,稳定性较差。

图1 体质量AMMI模型双标图Fig.1 AMMI biplots of body weight
图2为AMMI模型双标图,横坐标为解释变异最多的主成分即第一主成分(IPC1或IPCA1),纵坐标为解释变异第二多的主成分即第二主成分(IPC2或IPCA2)。在AMMI模型中离坐标原点越近则说明家系越稳定,环境分辨能力越差,由图2可知,G6离坐标原点最近,因此家系6最稳定,对环境因素不敏感;G2距离坐标原点较远,稳定性较差,对环境分辨能力较强。就环境而言,从图2中可初步看出室内水泥池(E2)离坐标原点较近,即该环境比较稳定,适合不同家系生长。

图2 AMMI模型双标图Fig.2 AMMI biplots
图3为AMMI模型分析凡纳滨对虾7个家系最佳养殖环境,其功能是按家系-环境相互关系对实验点分组,并揭示各组内最高产家系[20]。图中的多边形是由连接同一方向上距离原点最远的家系形成,它把所有家系都框在其中,由原点出发的各条射线是对多边形各边的垂线,这些垂线将多边形分成多个区域,并由此把实验点分成不同的组。由图3可知,3个实验点被分为3组,E1为一组,E2为一组,E3为一组。G11在E1环境中最高产,是“赢家”;G5在E3环境中最高产,是“赢家”;G2在E2环境中最高产,是“赢家”。

图3 AMMI模型双图标“哪个赢在哪里”功能形态Fig.3 “Which-won-where” view of the AMMI biplot
3.3家系稳定性参数及适合环境综合分析
AMMI模型分析尽管很可靠,但仍未考虑IPCA3上存在的互作信息。为了更准确全面的评判,利用家系和环境主成分轴(IPCA1~IPCA3)上的得分,计算各家系稳定性参数Di。从表3可以看出家系G6的Di最小(0.633 6)最稳定,其次是家系G3(0.765 4);相反家系G2的Di最大(2.536 6),稳定性最差。家系间Di最大相差4.003 5倍。综合适应程度以及凡纳滨对虾产量,G6和G3属于高产、稳定、适应性广的优良家系。
同样,用IPCA1~IPCA3得分计算环境对品种分辨力(Di),地点分辨能力由高到低依次为:室内水泥池(E2)、网箱(E3)、室外水泥池(E1)。即环境以室外水泥池(E1)对家系分辨力较弱,室内水泥池(E2)对家系分辨能力较强。

表3 家系稳定性参数分析

表4 地点稳定性参数分析
4讨论
4.1不同类型养殖池对生长性状差异分析
我国对虾养殖常采用传统的土池塘养殖,且在养殖规模、养殖技术及产量等方面均取得较大成就,但土池塘养殖水环境控制较难,对虾养殖过程中易发生病害,因此土池养殖逐渐被水泥池等养殖模式替代。随着对虾育苗技术的不断突破,国内部分地区开始采用一种新型的网箱养殖,且取得较好的养殖成果[21—22]。温度、盐度以及pH控制在相同范围内的情况下,本研究通过研究地点稳定性参数分析可知,网箱养殖稳定性优于室外水泥池养殖,但与室内水泥池相比稳定性较差,说明对于稳定性较差、生长情况不理想的凡纳滨对虾家系应选择在室内水泥池中养殖,而不宜进行室外养殖。室内水泥池与网箱及室外水泥池相比,水体环境可通过人工进行调控,满足对虾生长最佳环境。对于稳定性强、抗逆性较强的家系可根据情况选择室外水泥池或网箱养殖,以达到较大收益。研究发现3种养殖环境对凡纳滨对虾生长性状影响存在显著差异,其中两种水泥池(E1、E2)对虾的平均体长和平均体质量高于网箱(E3)养殖对虾的平均体长和平均体质量。其原因可能是由于网箱在养殖过程中网箱底部常会被排泄物堵塞,造成水体交换能力较差[23]。因此如果采用网箱养殖对虾需及时清理网箱底部,避免网孔阻塞。即便如此,网箱养殖作为一种新型集约式养殖方式,能够增加水体外源营养物质输入,加强水体中浮游动植物的生产力,此外网箱养殖具有产量高、投资少、管理方面等特性现已逐渐被人重视[24]。
4.2AMMI模型分析
AMMI模型分析是在基因型和环境加性模型中加入互作效应,可将方差分析与主成分分析有效结合在一起,提高模型对互作估计的准确程度[25—26]。此外,AMMI模型分析可借助互作效应值和双标图反映出品种家系的稳定性和适应区域,比线性模型适用的数据范围更广[18]。近年来,对于AMMI模型的应用逐渐从农作物和经济陆地动物转移到水产动物研究上,如马爱军和王新安[9]应用AMMI模型研究了大菱鲆(Scophthalmusmaximus)各家系养殖在不用实验点下,其基因型和环境互作效应,有效的提出了最优家系以及各家系适合的养殖环境;吴曼[18]采用AMMI模型分析了合浦珠母贝(Pinctadafucata)各家系不同生长阶段壳长、壳高、壳宽以及体质量4个生长性状的基因型和环境互作效应,得出了生长速度较快的家系和养殖地点。本研究通过应用AMMI模型分析可知,家系2#(G2)稳定性差,但家系6#和家系3#属于高产、稳产、广适性较好的家系,其基因型适于新品种(或新品系)选育;进一步通过“哪个赢在哪里”功能图研究发现,家系11#(G11)较适合室外水泥池养殖,可初步推测该家系具有某些抗逆性;家系2#(G2)适合在室内水泥池养殖,说明G2不仅稳定性差、其对养殖环境要求较高,不易推广;家系5#(G5)适合在网箱中生存,表明该家系对适合在流动水体中养殖,对水体质量要求较高。由于AMMI模型分析采用主成分得分,消除了变量间存在的共线性,克服由此造成的运算不稳定、矩阵病态等问题,此外本研究得出IPCA1、IPCA2的值远大于IPCA3的值,说明前两个主成分能反映原来变量所包含的信息,可用来解释交互作用。AMMI分析得出实验的均方误差较小,说明该模型描述实验数据具有更好的精确性,因此本研究结果较为可靠,可将此研究结果作为家系选育的重要参考依据。
4.3基因型×环境效应分析
基因型与环境互作效应常作为评价品种适应环境能力的一个重要环节[27],适应环境能力的强弱直接影响水产动物遗传育种改良中所创造的经济效益和社会效益[4],因此在凡纳滨对虾遗传育种中,可以考虑针对不同地域不同养殖环境进行选择育种[5],提高经济效益和社会效益。研究发现凡纳滨对虾选育的7个家系,其体质量与G×E效应间存在高度相关性,若单独考虑家系与环境因素,则环境因素对凡纳滨对虾体质量影响显著大于基因型单独作用,说明家系间生长差异可能主要来源于环境效应。Castillo等[28]研究同样发现不同家系凡纳滨对虾在两种养殖环境下其体质量的G×E效应间存在高度遗传相关。栾生等[3]研究表明HBHH和QDAS两场体质量间表现为高度遗传相关,体质量性状的G×E效应不显著,其原因是HBHH和QDAS两场养殖环境较为相似,导致测试环境间的差异程度较小,影响基因型和环境互作效应。本研究中养殖环境差异较大,3个养殖环境间G×E效应显著,由此可以看出若养殖环境间差异较大,则不可忽略G×E效应,较大的环境差异往往与基因型互作对生长性状产生显著影响。对凡纳滨对虾7个家系研究发现,与其他家系相比,家系6#(G6)稳定性最好,即对环境的选择能力较差,适合在多种养殖环境中饲养,适合广泛推广。家系6#(G6) 来源于SIS自繁子一代(♀)与SIS抗病一代(♂)杂交,杂交过程不仅可以综合双亲的优良性状,同时可以获得在双亲中不存在的某些优良性状,增加后代的变异性,因此家系6稳定性好的原因是杂种优势的体现[29]。Brad采用不同群体凡纳滨对虾进行研究,结果发现经过杂交选育的后代比亲本抗TSV能力增加21%[30];何玉英[31]对中国对虾3个养殖群体(CY、HB、WP)进行杂交,发现6个杂交组合的子一代均表现出一定程度杂种优势,且HB×WP组合杂种优势最明显;李永[32]对斑节对虾不同家系耐氨氮能力进行分析,发现不同家系耐氨氮能力不同,但均出现杂种优势,原因是由于群体间的杂交增加了显性有利基因的互作机会,从而杂交后代抗逆性增强。以上研究均说明在杂交子一代会体现出某些抗逆性状优势。家系6#稳定性强具体是由哪种抗逆性状引起的结果是我们即将进行的研究,接下来我们会对该家系某些具体抗逆性状进行研究,与其他家系进行对比,诠释该家系优缺点。
参考文献:
[1]陈晓汉. 我国凡纳滨对虾育种现状与发展对策[R]. 南宁: 广西水产科学研究院, 2015: 1-38.
Chen Xiaohan.Litopenaeusvannameibreeding actuality and development countermeasure in our country[R]. Nanning: Guangxi Institute of Fishery Sciences, 2015: 1-38.
[2]李亚春, 蔡强, 陈海进, 等. 凡纳滨对虾良种选育之虾苗培育技术探讨[J]. 海洋与渔业, 2010(11): 41-42.
Li Yachun, Cai Qiang, Chen Haijin, et al. The discussion of young shrimp cultivating technology ofLitopenaeusvannameiselective breeding[J]. Ocean and Fishery, 2010(11): 41-42.
[3]栾生, 罗坤, 阮晓红, 等. 凡纳滨对虾(Litopenaeusvannamei)体重、存活性状的遗传参数和基因型与环境互作效应[J]. 海洋与湖沼, 2013, 44(2): 445-452.
Luan Sheng, Luo Kun, Ruan Xiaohong, et al. Genetic parameters and genotype by environment interaction for body weight and survival of pacific white shrimpLitopenaeusvannamei[J]. Oceanologia et Limnologia Sinica, 2013, 44(2): 445-452.
[4]金武, 栾生, 孔杰, 等. 基因型与环境互作条件下凡纳滨对虾多性状复合育种方案的遗传和经济评估[J]. 水产学报, 2013, 37(12): 1770-1781.
Jin Wu, Luan Sheng, Kong Jie, et al. Genetic evaluation and investment appraisal of the multi-trait selection breeding program inLitopenaeusvannamei[J]. Journal of Fisheries of China, 2013, 37(12): 1770-1781.
[5]Ponzoni R W, Nguyen N H, Khaw H L,et al. Accounting for genotype by environment interaction in economic appraisal of genetic improvement programs in common carpCyprinuscarpio[J]. Aquacultrue, 2008, 285(1/4): 47-55.
[6]郭平仲. 数量遗传分析[M]. 北京: 北京师范学院出版社, 1987.
Guo Pingzhong. Quantity genetic analysis[M]. Beijing: Beijing Normal University Press, 1987.
[7]邓岳文, 刘晓, 张国范. 皱纹盘鲍基因型与环境互作的初步研究[J]. 海洋科学, 2005, 29(12): 31-34.
Deng Yuewen, Liu Xiao, Zhang Guofan. Genotype-environment interaction of growth inHaliotisdiscushannai[J]. Marine Sciences, 2005, 29(12): 31-34.
[8]颉晓勇, 李思发, 蔡完其, 等. 罗非鱼主要生长性状的杂种优势分析[J]. 南方水产科学, 2007, 3(3): 1-7.
Jie Xiaoyong, Li Sifa, Cai Wanqi, et al. Heterosis analysis of main growth-related traits of tilapia[J]. South China Fisheries Science, 2007, 3(3): 1-7.
[9]马爱军, 王新安. 基于AMMI模型分析大菱鲆选育家系基因型与环境互作效应[J]. 水产学报, 2012, 36(11): 1633-1639.
Ma Aijun, Wang Xin’an. Analysis of genotype-environmental interaction of turbot (Scophthalmusmaximus) based on AMMI model[J]. Journal of Fisheries of China, 2012, 36(11): 1633-1639.
[10]游伟伟, 柯才焕. 杂色鲍的基因型与环境互作研究[C]//中国动物学会、中国海洋湖沼学会贝类学会分会第十四次学会研讨会论文摘要汇编. 济南: 中国海洋湖沼学会, 2009.
You Weiwei, Ke Caihuan. Genotype-environment interaction ofHaliotisdiversicolor[C]//China Zoological Society, Chinese Society for Oceanology and Limnology. Ji’nan: Chinese Society for Oceanology and Limnology, 2009.
[11]宋盛亮. 长牡蛎不同选育群体间杂交效应及其与环境互作分析[D]. 青岛: 中国海洋大学, 2011.
Song Shengliang. The analysis of effect of crossbreeding among different selected strains and genotype×environment interactions in the pacific oysterCrassostreagigas[D]. Qingdao: Ocean University of China, 2011.
[12]Ibarra A M, Famula T R. Genotype by environment interaction for adult body weights of shrimpPenaeusvannameiwhen grown at low and high densitie[J]. Genet Sel Evol, 2008, 40(5): 541-551.
[13]Gitterle T, Rye M, Salte R, et al. Genetic (co)variation in harvest body weight and survival inPenaeus(Litopenaeus)vannameiunder standard commercial conditions[J]. Aquaculture, 2005, 243(1/4): 83-92.
[14]Campos-Montes G R, Montaldo H H, Martínez-Ortega A, et al. Genotype by environment interaction effects for body weight at 130 days of age in the Pacific white shrimpPenaeus(Litopenaeus)vannamei[J]. Veterinaria México, 2009, 40(3): 255-267.
[15]Gauch H G Jr. AMMI analysis on yield trials[R]. CIMMYT Wheat Special Report (CIMMYT), 1992.
[16]Gauch H G Jr. 产量区域试验统计分析——因子设计的AMMI分析[M]. 王磊, 张群远, 张晓冬, 译. 北京: 中国农业科技出版社, 2001.
Gauch H G Jr. Production of regional test statistical analysis AMMI model[M]. Wang Lei, Zhang Qunyuan, Zhang Xiaodong, Tr.Beijing. China’s Agricultural Science and Technology Press, 2001.
[17]Moreno-Gonzalez J, Crossa J, Cornelius P L. Genotype×environment interacion in multi-environment trials using shrinkage factors for AMMI models[J]. Euphytica, 2004, 137(1): 119-127.
[18]吴曼. 合浦珠母贝基因型与环境互作研究及珍珠质颜色评价[D]. 上海: 上海海洋大学, 2014.
Wu Man. Genotype by environment interactions and estimation of nacre color of the pearl oysterPinctadafucata[D]. Shanghai: Shanghai Ocean University, 2014.
[19]吕建华. AMMI 模型在小麦品种区试中的应用[J]. 安徽农业科学, 2004, 32(3): 411-412.
Lv Jianhua. Application of AMMI model in the regional test of wheat[J]. Journal of Anhui Agricultural Sciences, 2004, 32(3): 411-412.
[20]Yan Weikai, Hunt L A, Sheng Qinglai, et al. Cultivar evaluation and mega-environment investigation based on the GGE biplot[J]. Crop Science, 2000, 40(3): 597-605.
[21]李宏宇. 对虾养殖的新途径——网箱养虾[J]. 海洋与海岸带开发, 1992, 9(3): 76-79.
Li Hongyu. The new way shrimp breeding—the cages to raise shrimp[J]. Ocean and Coastal Zone Development, 1992, 9(3): 76-79.
[22]湛文. 对虾养殖新招——网箱养虾[N]. 中国渔业报, 2013-09-03.
Zhan Wen. The new way shrimp breeding——the cages to raise shrimp[N]. China Fisheries News, 2013-09-03.
[23]宋妍, 宋碧玉. 淡水网箱养殖对环境的影响[J]. 水产科学, 2006, 25(1): 42-44.
Song Yan, Song Biyu. The effect of freshwater cage aquaculture on environment in China[J]. Fisheries Science, 2006, 25(1): 42-44.
[24]陈波. 浅海网箱养殖中国对虾技术[J]. 今日科技, 1992(7): 9-10.
Chen Bo. The shallow sea aquaculture technology ofPenaeeschinensis[J]. Today’s Science and Technology, 1992(7): 9-10.
[25]李武, 谢德意, 段峥峥, 等. 基于AMMI模型分析棉花基因型与环境互作效应[J]. 河北农业科学, 2010, 14 (4): 158-160.
Li Wu, Xie Deyi, Duan Zhengzheng, et al. Analysis on genotype-environment interaction of cotton based on AMMI model[J]. Journal of Hebei Agricultural Sciences, 2010, 14(4): 158-160.
[26]王军, 郭二虎, 袁峰, 等. 基于AMMI模型分析谷子基因型与环境互作效应[J]. 河北农业科学, 2010, 14(11): 107-111.
Wang Jun, Guo Erhu, Yuan Feng, et al. Analysis on genotype environment interaction effect of millet based on AMMI model[J]. Journal of Hebei Agricultural Sciences, 2010, 14(11): 107-111.
[27]黄英姿, 毛盛贤. 基因型与环境互作的研究的新进展[J]. 作物学报, 1992, 18(2): 116-125.
Huang Yingzi, Mao Shengxian. A review on the theories and methods of studying genotype-environment interaction[J]. Acta Agronomica Sinica, 1992, 18(2): 116-125.
[28]Castillo-Jurez H, Casares J C Q, Campos-Montes G, et al. Heritability for body weight at harvest size in the Pacific white shrimp,Penaeus(Litopenaeus)vannamei, from a multi-environment experiment using univariate and multivariate animal models[J]. Aquaculture, 2007, 273(1): 42-49.
[29]陈宗阳. 刺参家系构建、抗病力评价及遗传连锁图谱的初步构建[D]. 上海: 上海海洋大学, 2014.
Chen Zongyang. Construction and comparisons of sea cucumber (Apostichopusjaponicus) full-sib families and preliminary construction of genetic linkage map[D]. Shanghai: Shanghai Ocean University, 2014.
[30]Argue B J, Arce S M, Lotz J M, et al. Selective breeding of Pacific white shrimp (Litopenaeusvannamei) for growth and resistance to Taura Syndrome Virus[J]. Aquaculture, 2002, 204(3/4): 447-460.
[31]何玉英. 中国对虾生长性状和对高氨氮和高pH抗性的基础研究[D]. 青岛: 中国海洋大学, 2009.
He Yuying. Preliminary studies on growth performance and the resistance to high ammonia and pH in Chinese shrimpFenneropenaeuschinensis[D]. Qingdao: Ocean University of China, 2009.
[32]李永. 斑节对虾人工选育及氨氮对其免疫、解毒代谢影响[D]. 上海: 上海海洋大学, 2012.
Li Yong. Artificial selection of Penaeus monodon and impacts of ammonia-N on immune parameters detoxification[D]. Shanghai: Shanghai Ocean University, 2012.
收稿日期:2015-10-09;
修订日期:2016-03-16。
基金项目:广东省海洋渔业科技推广专项(A201208B05); 广西科学研究与技术开发技术计划项目(桂科转 12239002-3,桂科合 14125007-2-9)。
作者简介:钱佳慧(1990—),女,黑龙江省佳木斯市人,主要研究无脊椎动物增养殖及珍珠培育。E-mail:52.duo@163.com *通信作者:刘建勇(1970—), 男,教授,主要研究海产经济遗传育种。E-mail:liujy70@126.com
中图分类号:S917.4
文献标志码:A
文章编号:0253-4193(2016)08-0044-08
Analysis of genotype-environmental interaction of Litopenaeus vannamei based on AMMI model
Qian Jiahui1,Hu Zhiguo1,Liu Jianyong1
(1.FisheriesCollege,GuangdongOceanUniversity,Zhanjing524088,China)
Abstract:In order to obtain fine families with universality in the process of selecting breeding, we carried out diallel crosses and nest design to establish the families, and chose seven families with better individual quality traits. AMMI (additive main and multiplicative interaction) model was used to analyze data. The results showed that the effect of G×E interaction on body weight reached significant level(P<0.01), and G×E effects on body weight was higher than families genotype. The quadratic sum of G×E effect accounted for 20.608% in the total quadratic sum, and the quadratic sum of families genotype effect accounted for 12.814%,and the quadratic sum of environmental effect accounted for 64.289%, suggested that environmental effect on body weight was higher than families genotye. Based on the double plot AMMI model and stability parameter analysis, the yield of family G2was the highest(12.9 g) and the stability parameter of the G2 families was the highest (2.536 6), so it is not suitable for wide promotion. Although family G6 production is lower than G2, its stability is higher than G2. Obviously, family G6 had a high and stable yield and wide adaptability and the genotype was beneficial to select breeding of new variety(or new strain). Three test locations were divided into three environment groups, i.e., E1, E2 and E3, at the same time, family G11, G2, G5 should be dispatched to the environment E1, E2, E3 respectively, based on “Which-won-where” view of the AMMI biplot. The conclusion of the study can provide theoretic basis for selecting breeding of new strains (or new varieties) and the extension of fine families.
Key words:Litopenaeus vannamei;AMMI model;genotype;environmental;G×E interaction
钱佳慧,胡志国,刘建勇. 基于AMMI模型分析凡纳滨对虾选育家系基因型与环境互作效应[J].海洋学报,2016,38(8):44—51, doi:10.3969/j.issn.0253-4193.2016.08.005
Qian Jiahui,Hu Zhiguo,Liu Jianyong. Analysis of genotype-environmental interaction ofLitopenaeusvannameibased on AMMI model[J]. Haiyang Xuebao,2016,38(8):44—51, doi:10.3969/j.issn.0253-4193.2016.08.005
