汞在罗丹明B-NaCl-丙醇水溶液中的绿色析相萃取分离和富集
2016-08-09段香芝司学芝马冬冬马万山
段香芝,司学芝,马冬冬,马万山*
(1.信阳师范学院 化学化工学院,河南 信阳 464000;2.河南工业大学 化学化工学院,河南 郑州 450052)
0 引言
汞广泛存在于各类环境介质和食物链中,由于它是一种剧毒元素,在很多环境监测项目中,汞是必检的元素之一.但对于较复杂试样中微量汞的测定,为了提高监测的灵敏度和选择性,必须预先富集分离.用安息油、乙氧基乙烷、四氯化碳和环己酮等有机溶剂来萃取分离和富集汞是分析化学领域经常使用的方法[1].但这类溶剂毒性较大,难免要污染环境和对操作人员造成伤害.另外,因为这些有机溶剂都难溶于水,为使水溶液中的被萃取物质顺利转移到有机溶剂相中,需要反复剧烈震荡使两相充分接触,在静置后会发现在两相界面上有乳化现象,使得有机相与水相没有清晰的界面而使分离和富集的效果不理想.随着人类社会的进步,对环境保护提出了更高的要求,限制了这些传统萃取方法的应用.这样就迫使人们探究环保、高效的汞的萃取新方法.乙醇或丙醇可以与水混溶,特定的一些无机盐溶入其中后,溶液就彻底分成醇/水两相,醇相浮在水相上面,界面很清晰,在此过程中,特定的金属离子以络合物的形式被萃取到醇相中,近些年已有文章报道了用这种技术来富集和分离金属离子[2-11].
本工作实验发现,于含有Hg(Ⅱ)和罗丹明B的丙醇水溶液中加入NaCl,在NaCl的盐析作用下,丙醇可从其水溶液中析出,在此过程中,Hg(Ⅱ)以[HgCl42-][RhB+]2的形式被萃取到丙醇相中,而Pb(Ⅱ)、Zn(Ⅱ)、Ir(Ⅳ)、Ni(Ⅱ)、Ag(Ⅰ)、Rh(Ⅲ)、Cu(Ⅱ)、Cr(III)、Mg(Ⅱ)、Fe(Ⅲ)、Al(Ⅲ) 和Co(Ⅱ)在此条件下不能被丙醇萃取,使得Hg(Ⅱ)与这些离子分离.这种方法对Hg(Ⅱ)的一次萃取率达到98.0%以上,单次萃取就可达到分离和富集的目的,这种萃取技术也比较好操作,所用的试剂价格低廉且易得,在分析化学领域有一定的实际意义.
1 实验部分
1.1 主要仪器和试剂
pHS-3C型精密pH计,UV-754 型分光光度计,上海第三分析仪器厂.
丙醇;NaCl固体;罗丹明B溶液(3g /L):称取3 g 罗丹明B置于1000 mL烧杯中,加入1000 mL 1mol/L盐酸使其完全溶解,转入棕色试剂瓶中;Hg(Ⅱ)标准溶液(1 g/L):准确称取1.618 3 g硝酸汞,置于200 mL烧杯中,加入25%硝酸20 mL,加30 mL水将其溶解,移入1000 mL容量瓶中定容,摇匀.按文献[1]配制其余金属离子标准溶液.
实验用的试剂都为分析纯,水是二次蒸馏水.
1.2 实验方法
在25 mL具塞比色管中(磨口并标有体积刻度),定量加入丙醇、NaCl固体、罗丹明B溶液和金属离子标准溶液,溶液的pH值用盐酸调节并定容至10 mL.反复振荡,静置至丙醇完全析出,醇/水两相用锥形分液漏斗分离,检测水相中各金属离子的含量.用二硫腙为显色剂光度法测定Hg(Ⅱ)并计算萃取率[12].另一些金属离子的萃取率分别按文献[12]中的方法测定.
2 结果与讨论
2.1 NaCl的用量对丙醇水溶液分相的影响
丙醇/水溶液在NaCl的作用下,丙醇从其水溶液中析出且浮在水相的上面,两相界面非常清晰.醇/水分相的程度与水溶液中的NaCl用量和丙醇的浓度有关,水溶液中丙醇的浓度较大时,少量的NaCl可使醇/水分相,反之所需NaCl的量较大.考虑到Hg(Ⅱ)分离和富集的双重需要,将溶液中丙醇的体积浓度控制为30%.先将丙醇(3.0 mL)和水(7.0 mL)充分混合,然后向其醇/水溶液中加入了1.0 g NaCl,充分振荡后静置,有1.98 mL丙醇析出,加入1.5 g NaCl时,丙醇相析出了2.97 mL.将NaCl用量控制在1.5~1.7 g范围之间,平行4次分相试验,析出丙醇相的体积都是在2.98~3.02 mL之间波动,这说明醇/水已完全分相,因此,NaCl的加入量在其他项目实验时定为1.6 g(NaCl在醇/水溶液中的浓度为160 g/L).
2.2 罗丹明B浓度对萃取Hg(Ⅱ)的影响及机理
固定醇/水溶液中NaCl、Hg(Ⅱ) 和丙醇的浓度分别是和160 g/L、10 mg/L和30%(V/V),考察了罗丹明B浓度对萃取Hg(Ⅱ)的影响.实验数据表明,不加罗丹明B Hg(Ⅱ)的萃取率为零,加入罗丹明B后才能萃取Hg(Ⅱ),Hg(Ⅱ)的萃取率也随着罗丹明B溶液加入量的增加而增大,当加入0.8 mL罗丹明B溶液时,有98.0%以上的Hg(Ⅱ)被萃取,控制罗丹明B溶液的加入量在0.8~1.2 mL范围之间,通过6次平行萃取和测定,这时Hg(Ⅱ)的萃取率都处在98.0%~99.1%范围内.在其他实验项目中都将罗丹明B溶液的加入量固定为0.9 mL(醇/水溶液中罗丹明B的浓度是0.27 g/L).
该体系的萃取机理应是:罗丹明B(RhB)在水溶液中离解成[RhB+]阳离子,溶液中大量的氯离子与Hg(Ⅱ)生成HgCl42-阴离子,[RhB+]再与HgCl42-生成稳定的三元缔合物 [HgCl42-][RhB+]2[11], 由于此三元缔合物中的RhB+含有四个疏水基团(-C2H5), 丙醇含有大量的疏水基因-C3H7,依据相似相溶的原理可知,丙醇相容易萃取[HgCl42-][RhB+]2.
2.3 萃取时的酸度条件
考察了醇/水溶液的pH值(用盐酸来调节)对萃取的影响,实验的结果显示, 在pH1~4范围内,Hg(Ⅱ)的萃取率都不低于98.0%,在此酸度范围内Pb(Ⅱ)、Zn(Ⅱ)、Ir(Ⅳ)、Ni(Ⅱ)、Ag(Ⅰ)、Rh(Ⅲ)、Cu(Ⅱ)、Cr(III)、Mg(Ⅱ)、Fe(Ⅲ)、Al(Ⅲ) 和Co(Ⅱ)基本不被萃取.
2.4 合成试样的萃取和分离
固定前述的优化实验条件,对二元及多元的合成试样进行了萃取分离,其结果祥见表1和表2.由表中的数据 (每个数据是3次平行分离测定的平均值)可知,这种方法对Hg(Ⅱ)的萃取率很高,并能与Pb(Ⅱ)、Zn(Ⅱ)、Ir(Ⅳ)、Ni(Ⅱ)、Ag(Ⅰ)、Rh(Ⅲ)、Cu(Ⅱ)、Cr(III)、Mg(Ⅱ)、Fe(Ⅲ)、Al(Ⅲ) 和Co(Ⅱ)离子有效分离.需要说明的是:Ag(Ⅰ)生成了AgCl沉淀在水相下面不能被萃取.但Hg(Ⅱ)不能与Au(Ⅲ)和Sb(Ⅴ)分离(因为Au(Ⅲ)和Sb(Ⅴ)在此体系中也有很高的萃取率).

表1 两种金属离子混合体系的分离结果Tab.1 Results separation of metal ion in binary mixture systems
注: Me表示除Hg(Ⅱ)以外的其他金属离子;* 表示沉淀.
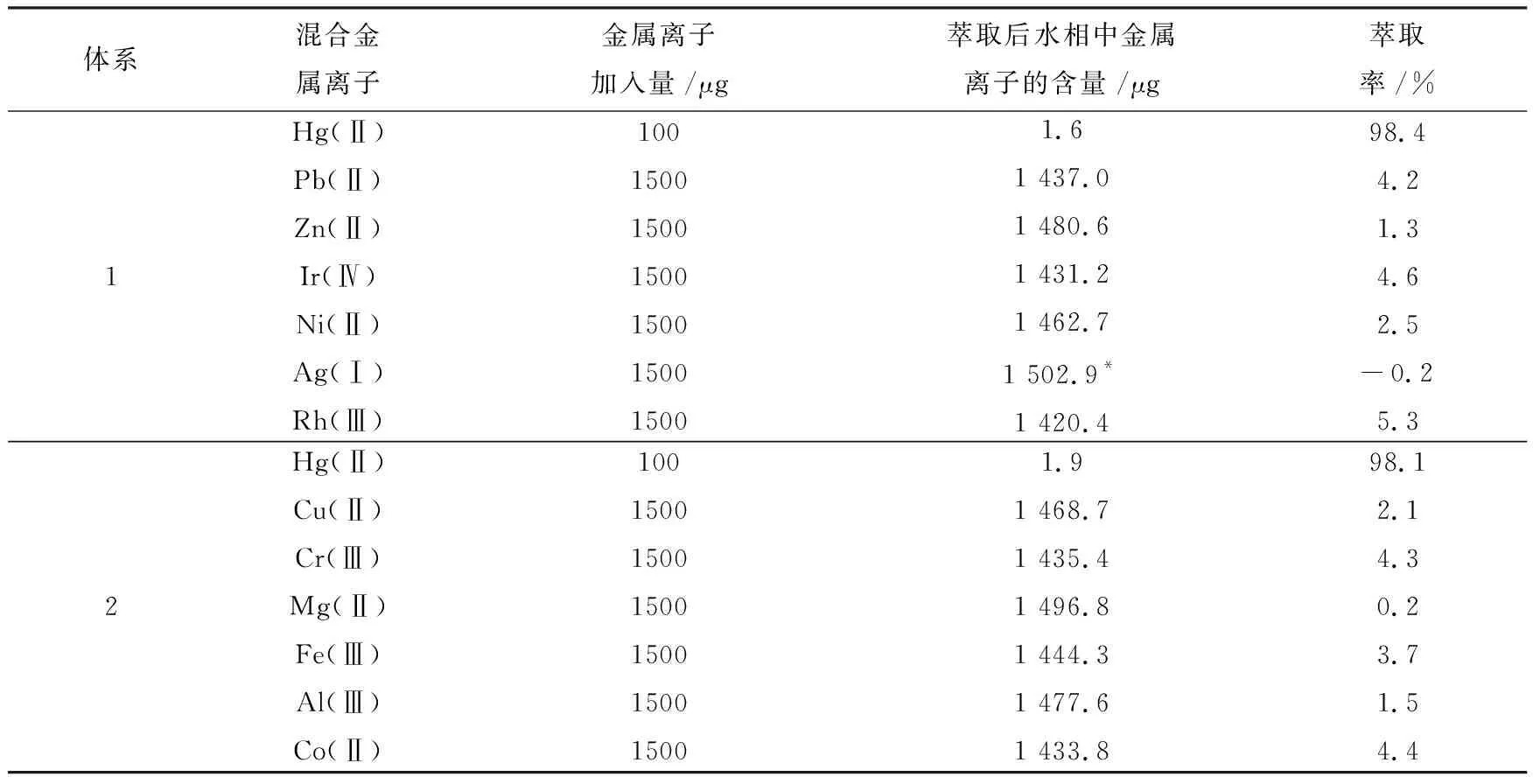
表2 多种金属离子混合体系的分离结果Tab.2 Results separation of metal ion in multiple systems
注:* 表示沉淀 .
3 结论
Hg(Ⅱ)在NaCl -丙醇-罗丹明B体系中,可以 [HgCl42-][RhB+]2的形式被析出的丙醇相萃取,Hg(Ⅱ)得到了富集,同时又能与同一溶液中的Pb(Ⅱ)、Zn(Ⅱ)、Ir(Ⅳ)、Ni(Ⅱ)、Ag(Ⅰ)、Rh(Ⅲ)、Cu(Ⅱ)、Cr(Ⅲ)、Mg(Ⅱ)、Fe(Ⅲ)、Al(Ⅲ) 和Co(Ⅱ)离子分离,所用试剂价廉易得,绿色环保,所需设备简单且易操作,该技术可以用作微量汞的分离和富集,在汞的分析领域具有实际意义.
