过氧化氢诱导前列腺癌PC3细胞HSP60表达和Akt蛋白磷酸化的研究
2016-08-09席红军张师红李炳义
席红军,张师红,李炳义
(陕西省渭南市第二医院 泌尿外科,陕西 渭南714000)
0 引言
Akt蛋白也称作蛋白激酶B(PKB),是一种丝氨酸特异性蛋白激酶,在多种细胞信号通路中发挥重要的作用,包括调控细胞存活、细胞凋亡、细胞增殖、转录和细胞迁移[1-3].研究表明,Akt蛋白在PI3K/AKT/mTOR等分子通路中[4]起关键性作用,并且通过磷酸化(p-Akt)和灭活特定蛋白,比如Bad,forkhead转录因子(forkhead transcription factors),以及c-Raf 和caspase-9促进细胞存活[5-7].热休克蛋白60( heat shock protein, HSP60)是一种线粒体分子伴侣,其功能是将细胞质中的蛋白质折叠转运到线粒体基质,在细胞的免疫应答中起着重要作用[8],在受到外界刺激后,迅速调节细胞免疫应答抵御各种侵袭.Tina[9]等人研究发现,HSP60能够激活细胞外信号相关激酶ERK-1/2、JNK、p38、NF-κB以及损伤性胰岛素诱导的磷酸化Akt.活性氧(ROS)能够攻击细胞的遗传物质DNA,并可能对其增殖生长造成一定的影响.在此研究中,使用 H2O2对前列腺癌细胞PC3进行刺激,来研究HSP60的促炎症或抗炎症反应中是否对Akt蛋白的表达造成一定的影响,进而激活PI3K/AKT/mTOR,对细胞的存活形成一定的保护作用.
1 材料和方法
1.1 抗体及试剂
H2O2,Sigma公司;噻唑蓝(MTT)及二甲基亚砜(DMSO),Sigma公司;HSP60,Stressgen公司;Akt以及磷酸化Akt,Cell signaling公司;GAPDH,Ambion公司;辣根过氧化物二抗,BD公司.
1.2 主要仪器
倒置显微镜,Nikon公司;二氧化碳培养箱,美国Thermo公司;SDS电泳仪器以及电转移,Bio-rad公司;台式高速低温离心机,美国Beckman 公司;DG-3022A 型酶标仪,美国Biotek 公司.
1.3 MTT法检测细胞存活率
接种200 μL 3×104个·mL-1细胞于96 孔平底培养板上,37 ℃、5%CO2培养72 h.加入H2O2与完全培养基混合液处理细胞,设置9组不同摩尔浓度的H2O2,见表1,每组设8 个平行孔,并设3个对照孔,即只加同摩尔浓度的H2O2混合液,培养24 h.每孔加入MTT 溶液20 μL,继续培养4 h,去培养液,加200 μL DMSO溶液,振荡10 min后,在酶联免疫检测仪上测定吸光度值(OD值),测定波长570 nm.用公式(1)计算细胞存活率.
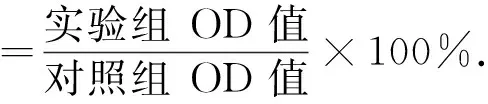
细胞存活率 (1)
1.4 蛋白质印迹法检测蛋白的表达
收集处理24 h后的各组细胞,加入预冷的裂解液,轻微超声粉碎细胞,低温离心30 min,取上清即总蛋白.用Bradford法测定蛋白质浓度后,取50 μg蛋白上样,通过分离胶后转至NC膜上,10%脱脂奶粉+0.1%FBS室温封闭1 h;加入鼠抗人HSP60、Akt、磷酸化Akt抗体和GAPDH抗体(抗体工作浓度均为1∶1000);4 ℃过夜;用PBST洗膜10 min×3次,加入羊抗鼠二抗;室温微摇1 h,PBS洗膜10 min×3次;曝光后照相以GAPDH抗体作为上样对照,图像分析系统测定HSP60、Akt和磷酸化Akt蛋白的表达,以目的蛋白与GAPDH相对灰度值的比值作为目的蛋白相对表达量.
1.5 统计学方法
用ImageJ分析软件测定Western Blotting印迹蛋白带的灰度值,并计算目标带测定值与GAPDH蛋白带测定值的比值,绘制直方图.采用GraphPad Prism 5.0 软件进行分析,组间比较采用方差分析,p< 0.05为差别有显著性统计意义.
2 结果
2.1 H2O2对细胞存活率的影响
细胞暴露于H2O2中,作用24 h后,细胞存活率呈下降趋势,且细胞存活率与H2O2的摩尔浓度呈负相关,见图1.各个浓度的实验重复3次,结果表示为means±S.E.M.

图1 不同浓度H2O2处理细胞24 h后细胞存活率
(与对照相比,*:p<0.05; **:p<0.01;***:p<0.001.下同)
2.2 H2O2对HSP60、Akt以及磷酸化Akt蛋白的影响
如图2所示,7.312 μmol/L 的H2O2作用细胞24 h后,HSP60蛋白水平并未发生明显改变,而15.625 μmol/L会导致HSP60蛋白表达水平的升高(p<0.05).同时,7.312 μmol/L以及15.625 μmol/L H2O2作用细胞24 h后,均会导致磷酸化Akt蛋白的显著降低(p<0.05),见图3,但对总Akt蛋白的表达并无明显改变(p>0.05),见图4.
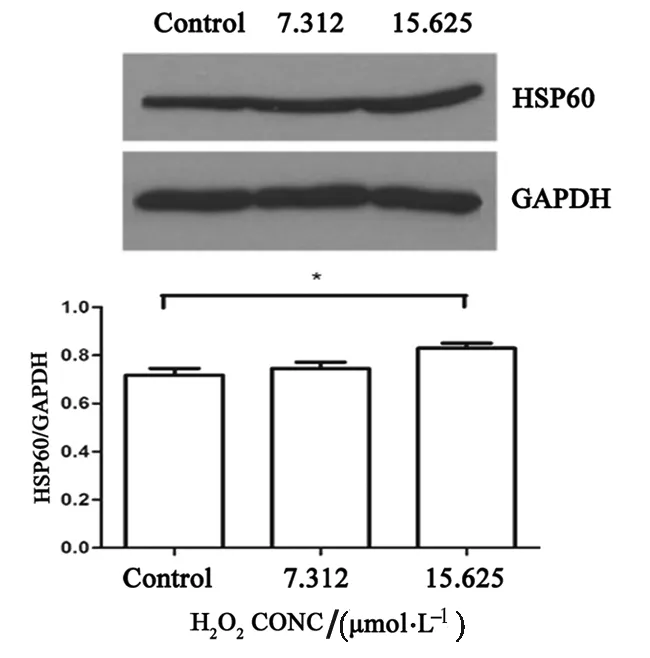
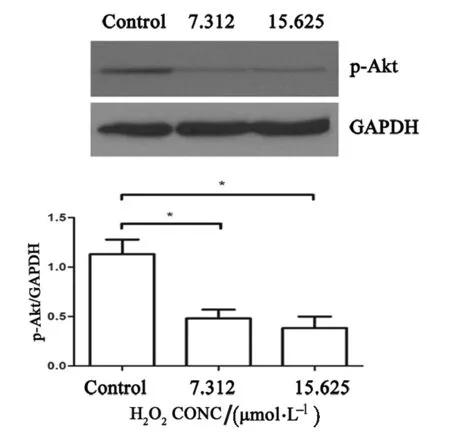


图2 不同摩尔浓度H2O2作用细胞24 h后 HSP60蛋白表达量Fig.2 The protein expression of HSP60treated by different concentrationsof H2O2 for 24 h图3 不同摩尔浓度 H2O2作用细胞24 h后磷酸化Akt蛋白表达量Fig.3 The protein expression of p-Akt treated by different concentrations of H2O2 for 24 h图4 不同摩尔浓度H2O2作用细胞24 h后,总Akt蛋白表达量Fig.4 The protein expression of Akt treated by different concentrations of H2O2 for 24 h
3 讨论
HSP60蛋白能够激活细胞外信号相关激酶(ERK1/2,JNK,P38,NF-kB)并能破坏胰岛素介导脂肪细胞的p-Akt[9].在实验中,HSP60蛋白表达上调,同时,检测到磷酸化Akt蛋白表达下调.PI3K是信号转导酶中的一个保守家族,参与调控细胞增殖及存活.PI3K/Akt通路在炎症发生发展和内毒素血症的发生中可能发挥重要的调控作用.PI3K持续表达于天然免疫细胞中,当细胞受病原微生物侵袭时,在TLRs成员的激发下,PI3K迅速活化,参与第一时间LPS信号通路的传导及调控.研究表明LPS攻击单核/巨噬细胞时可活化PI3K,活化的PI3K催化胞膜的磷脂肌醇的磷酸化,生成PI-3,4,5P3及PI3,4P2蛋白,从而引起PKB/Akt的膜移位及活化,在胞膜上募集的Akt可被磷脂酰肌醇依赖的激酶1活化,使其在Ser473及Thr308位双磷酸化而被活化.本研究从H2O2刺激后Akt蛋白及磷酸化水平的表达变化角度,分析总Akt表达变化的原因及其意义,同时对HSP60的表达进行研究,以便对Akt信号通路的调控途径有更深入的了解.该研究中,HSP60如何参与了Akt磷酸化水平的调控,从而在何种时期H2O2诱导的信号通路发挥了相应作用,如何发挥作用则是下一步需要研究的主要问题.
