HGF对AngII介导的肾小管上皮细胞转分化的影响及相关信号转导通路的研究
2016-08-09王红月顾春梅
王红月,刘 丽,张 洋,顾春梅
(吉林大学第一医院 肾内科,吉林 长春130021)
HGF对AngII介导的肾小管上皮细胞转分化的影响及相关信号转导通路的研究
王红月,刘丽,张洋,顾春梅*
(吉林大学第一医院 肾内科,吉林 长春130021)
摘要:目的探讨肝细胞生长因子(HGF)对血管紧张素II(AngII)介导的肾小管上皮细胞转分化(TEMT)的影响以及是否与信号转导和基因转录激活子(STAT3)信号转导通路有关。方法体外培养人近曲小管上皮细胞并分为4组,即对照组,AngII(AngII:10-6mol/L)组,HGF(HGF:8 μg)组,AngII(AngII:10-6mol/L)+HGF(HGF:8 μg)组,用RT-PCR的方法检测4组中α-平滑肌肌动蛋白(α-SMA)及β-actin的mRNA表达,用Western方法检测4组中P-STAT3及β-actin的蛋白表达。结果与对照组相比,HGF组α-SMA mRNA表达减少,P-STAT3 蛋白表达下降,AngII组与之相反;与AngII 组比较,AngII+HGF组α-SMA mRNA表达减少,P-STAT3蛋白表达下降。结论HGF可抑制AngII介导的肾小管上皮细胞转分化,且此作用可能通过对STAT3信号转导通路的抑制而达到的。
关键词:肝细胞生长因子;肾小管上皮细胞转分化;血管紧张素II;α-平滑肌肌动蛋白;STAT3信号通路
(ChinJLabDiagn,2016,20:1058)
肝细胞生长因子(hepatocyte growth factor,HGF),是一种重要的抗肾间质纤维化因子,新近发现,HGF可通过肾小管上皮-肌成纤维细胞转分化(tubular epithelial-myofibroblast transdifferentiation,TEMT)而防止肾脏纤维化[1]。TEMT致其增殖能力加强,并产生大量间质成分,α-平滑肌肌动蛋白(α-SMA)是判定是否存在TEMT的重要物质。转化生长因子-β1(TGF-β1)被认为是重要的促进TEMT因子,在近期的研究中发现,血管紧张素II(AngII)也是很强的致TEMT因子[2],且HGF抗TEMT作用可能与AngII相关[3],Janus酪氨酸蛋白激酶/信号转导和基因转录激活子(JAK/STAT3)信号途径可发挥信号转导和基因转录活化子蛋白的双重作用,介导多种细胞因子和生长因子的细胞内信号转导过程并活化相应靶基因,从而产生生物学效应。我们实验的目的是探讨HGF是否抑制AngII介导的肾小管上皮细胞转分化,以及此作用是否与STAT3信号通路有关。
1材料与方法
1.1肾小管上皮细胞培养人近曲小管上皮细胞 (HK-2,Human kidney proximaltubular cells-2)购自中国生命科学院上海细胞库。HK-2细胞用含有10% RPMI-1640胎牛血清的培养液培养。
1.2分组以每孔1×103细胞接种于96孔板中,肾小管上皮细胞分4组:对照组,AngII 组,HGF组,AngII+HGF组。对照组只加肾小管上皮细胞,HGF及AngII组在细胞的基础上分别加入HGF(8 μg)及AngII(AngII:10-6mol/L),AngII+HGF组在细胞基础上同时加HGF(8 μg)及AngII(AngII:10-6mol/L)。24 h后收集细胞进行检测。
1.3α-SMA mRNA的表达采用RT-PCR法检测,首先用Trizol法提取总RNA,鉴定,合成cDNA,计算RNA的浓度。PCR扩增α-SMA基因,β-actin为内参。α-SMA正义链 5′-ACTGGGACGACTAGGAAAAAG-3′,反义链 5′-CATCTCCAGAGTCCAGCACA -3′,退火温度42°C,30个循环,产物240bp;β-actin正义链 5′-ATCATGTTTGAGACCTTCAACAC -3′,反义链 5′-CATGGTGGTGCCGCCAGACAG -3′,退火温度56℃,30个循环,产物552 bp。PCR反应产物经琼脂糖凝胶电泳后,用Phoretix ID凝胶图像分析软件测定电泳条带的吸收度,用内参校准。
1.4用Western印记法检测将细胞加入细胞裂解缓冲液,离心,提取总蛋白,测定蛋白含量电泳、移膜,封闭。 加入一抗、二抗室温孵育1 h。晾干拍照。应用ECL化学发光试剂在X线胶片上曝光、显影和定影。测定α-SMA及P-STAT3蛋白表达条带的灰度值,用β-actin作为内参,计算比值。
2结果
4组α-SMA的m-RNA表达图谱见图1A),4组α-SMA的基因表达的光密度值标准化半定量分析见图1B)。可以看出,与对照组相比,HGF组α-SMA表达下降(P<0.05),AngII组α-SMA表达上调(P<0.01);与AngII组比较,AngII+HGF组α-SMA表达减少(P<0.05)。

注:A) 4组α-SMA的m-RNA表达,B) 4组α-SMA的m-RNA表达光密度值标准化分析。*与对照组相比,P<0.05,**P<0.01;#与AngII组相比P<0.05。
图14组α-SMA的m-RNA表达及光密度值标准化分析
4组P-STAT3的蛋白表达图谱见图2 A),4组P-STAT3的蛋白表达的光密度值标准化半定量分析见图2 B)。可以看出,与对照组相比,HGF组P-STAT3表达下降(P<0.01),AngII组P-STAT3表达上调(P<0.01);与AngII 组比较,AngII+HGF组P-STAT3表达减少(P<0.01)。
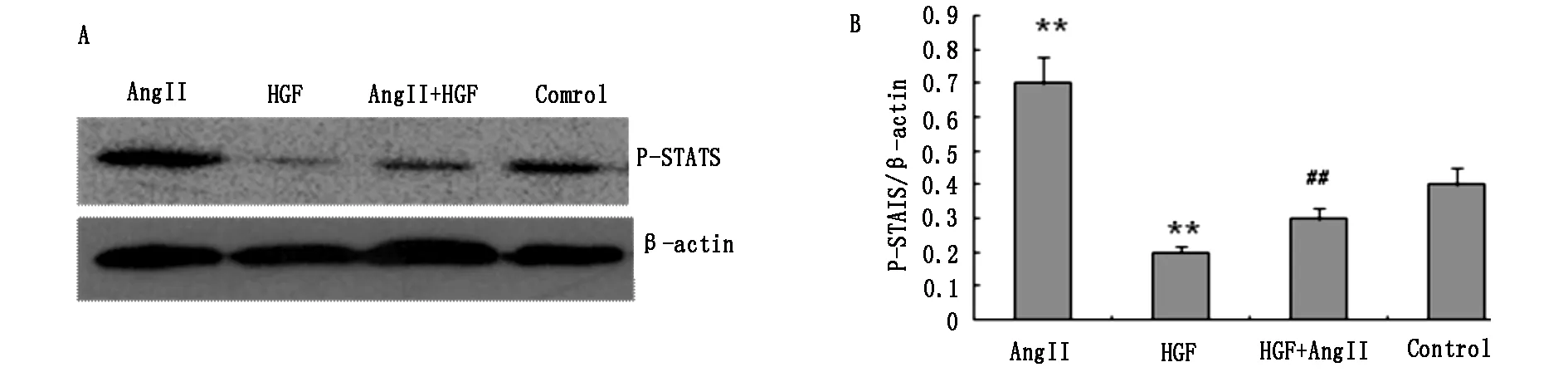
注:A) 4组P-STAT3蛋白表达,B) 4组P-STAT3蛋白表达光密度值标准化分析。*与对照组相比,P<0.05;**P<0.01;##与AngII组相比P<0.01。
图24组P-STAT3蛋白表达及光密度值标准化分析
3讨论
近期的研究提示,肾间质纤维化很大程度上是由于TEMT而引起的[4],HGF有逆转TEMT的作用[1],但关于其机制目前尚不明确,可能与对TGF-β1的抑制有关,还有一些线索提示与AngII有关[3]。
JAK/STAT信号途径介导多种细胞因子细胞内信号转导而调控细胞增殖、分化、凋亡、免疫调节等过程,P-STAT是STAT磷酸化形式,是有活性形式。其在糖尿病肾病、梗阻性肾病中起重要作用[5]。有实验认为,AngII可以通过激活JAK2/STAT3通路进一步上调TGF-β1、CTGF等细胞因子及细胞外基质成分FN的表达,提示AngII可能通过激活JAK2/STAT3通路参与肾纤维化的发病过程[6],我们在培养的肾小管上皮细胞中,就TEMT、AngII及HGF的关系进一步研究,并探讨STAT3信号通路是否参与HGF抗TEMT的过程。
我们的研究结果显示,与对照组相比,HGF组α-SMA的mRNA表达减少,AngII组α-SMA的mRNA表达增多,说明HGF可从基因水平上抑制肾小管上皮细胞α-SMA的表达,即可抑制TEMT,与既往研究结果一致。而AngII可促进α-SMA的mRNA表达,促进TEMT,两者作用相反。与单独应用AngII对比,同时加入HGF和AngII时,α-SMA的mRNA表达减少,由此可推断HGF抑制α-SMA的mRNA表达可能与对AngII的抑制有关。
在P-STAT的蛋白表达分析中,我们看四组中,与对照组相比,HGF组P-STAT的蛋白表达减少,AngII组P-STAT的蛋白表达增多,说明HGF可从蛋白水平上抑制P-STAT通路,且与AngII作用相反,与单独应用AngII对比,HGF和AngII组P-STAT蛋白表达减少,提示我们HGF抑制AngII介导肾小管上皮细胞转分化,这种作用可能通过对P-STAT信号通路的抑制而达到的。下一步需要探索HGF与JNK-2等信号通路的关系。
参考文献:
[1]Hong-yue Wang,Li-zhi Yang,Ming-ji Cui,et al.Hepatocyte growth factor-induced amelioration in chronic renal failure is associated with reduced expression of α-smooth muscle actin[J].Renal Failure,2012,34(7):862.
[2]Chen J,Chen JK,Harris RC.Angiotensin II induces epithelial -to to mesenchymal in renal epithelial cells through reactive oxygen species/Src/caveolin-mediated activation of an epidermal growth factor receptor-tracellular signal- regulated kinase signaling pathway[J].Mol Cell Biol,2012,32(5)981.
[3]Hong-yue Wang,Yan-jun Wang,Ming-ji Cui,et al.Hepatocyte growth factor-induced amelioration in renal interstitial fibrosis is associated with reduced expression of α-smooth muscle actin and transforming growth factor-β1[J].Indian Journal of Biochemistry & Biophysics,2011,48:308.
[4]Liu Y.New insight into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21:212.
[5]Pang M,Ma L,Gong R,et al.A novel STAT3 inhibitor,S3I-201,attenuates renal interstitial fibroblast activation and interstitial fibrosis in obstructive nephropathy[J].Kidney Int,2010,78(3):257.
[6]LI Yan-nong,FAN Qiu-ling,WANG Li-ning.Significance of JAK2/STAT3 in angiotensin II up-regulation of TGF-β1、CTGF and FN mRNA expression On mesangial cells under hyperglucose[J].J Nephrol Dialy Transplant,2009,18(1):44.
基金项目:吉林大学第一医院二部科研基金 (B007)
*通讯作者
文章编号:1007-4287(2016)07-1058-03
中图分类号:Q816
文献标识码:A
(收稿日期:2015-03-20)
The Effects of Hepatocyte Growth Factor on Tubular Epithelial-myofibroblast Transdifferentiation That Angiotensin II Took Part In and The Associated Study About Signaling Pathway
WANGHong-yue,LIULi,ZHANGYang,etal.
(DepartmentofNephrology,FirstHospitalofJilinUniversity,Changchun130021,China)
Abstract:ObjectiveTo inquire the effects of hepatocyte growth factor (HGF) on tubulapithelial-myofibroblast transdifferentiation (TEMT) that Angiotensin II (Ang II) took part in,and the associated study about STAT3 signaling pathway.MethodsHK-2 cells were cultured in RPMI-1640 medium containin,and the cells were divided into four groups:control,AngII(AngII:10-6mol/L) group,HGF(HGF:8 μg)group,AngII(AngII:10-6mol/L)+HGF(HGF:8 μg)group.α-smooth muscle actin (α-SMA),and β-actin mRNA expressions were detected by RT-PCR,P-STAT3 and β-actin protein expressions were detected by Western.Resultsα-SMA mRNA expression was reduced and STAT3 protein expression were reduced in HGF group compared to control.But α-SMA mRNA expression,STAT3 protein expression were elevated in AngII group.α-SMA mRNA,STAT3 protein expression were all released in AngII+HGF group compared to AngII group.ConclusionHGF can restrain TEMT that Ang II took part in,and this effect maybe realized by inhibiting STAT3 signaling pathway.
Key words:Hepatocyte growth factor;Tubular epithelial-myofibroblast transdifferentiation;Angiotensin II;α- smooth muscle actin;STAT3 signaling pathway
