EDTA对壳聚糖的抑菌增效研究
2016-08-07于立权张祥涛姜自庆李凤华朱金艳宁芮奇崔玉东
于立权,张祥涛,姜自庆,李凤华,朱金艳,宁芮奇,崔玉东
(1.黑龙江八一农垦大学生命科学技术学院,大庆163319;2.山东联创建筑(矿业)设计有限公司;3.富裕光明生态示范奶牛养殖有限公司;4.大连三仪集团生物工程研究所;5.庄河市食品检验监测中心)
EDTA对壳聚糖的抑菌增效研究
于立权1,张祥涛2,姜自庆3,李凤华4,朱金艳5,宁芮奇1,崔玉东1
(1.黑龙江八一农垦大学生命科学技术学院,大庆163319;2.山东联创建筑(矿业)设计有限公司;3.富裕光明生态示范奶牛养殖有限公司;4.大连三仪集团生物工程研究所;5.庄河市食品检验监测中心)
为了研究壳聚糖与EDTA的协同抗菌效果,采用体外药敏片扩散法和抑菌效应方法,测试了壳聚糖和EDTA联合应用后对大肠杆菌、金黄色葡萄球菌、白色念珠菌的抑制效应,来考察EDTA对壳聚糖的抑菌增强效果。结果表明,与壳聚糖对照组相比,壳聚糖和EDTA联合应用能增强壳聚糖对白色念珠菌、金黄色葡萄球菌、大肠杆菌的抑制杀伤作用,且对大肠杆菌的抑制杀伤效应更加明显。表明EDTA能够增强壳聚糖对细菌、真菌的抑制效应,为开发一种新型的抗菌剂提供了试验依据。
壳聚糖;EDTA;抑菌增效取
壳聚糖(Chitosan)为甲壳素脱乙酰基产物,是自然界唯一大量存在的碱性氨基多糖,具有良好的生物降解性、生物相容性和哺乳动物细胞低毒性[1-3]。近年来,有关壳聚糖及其聚合物抗菌性能的报道较多[4-6],证实了壳聚糖具有天然的广谱抗菌性能。EDTA是一种常见的膜通透性促进剂,可以与维持细胞膜结构和功能的必须成分如Ca2+、Mg2+等2价阳离子络合,从而导致细胞流动性和通透性增加,促进药物进入细胞内。有研究发现,EDTA与乳链菌肽和溶菌酶等联用时能增强对大肠杆菌、金黄色葡萄球菌,沙门氏菌和李斯特菌等的抑菌杀菌效果[7],特别是在抗菌药物中加入EDTA能够恢复多重耐药细菌对药物的敏感性[8]。
白色念珠菌是人体重要的机会性致病菌,也是人们饮食链条(特别是奶制品)中不可忽视的病原真菌[9]。金黄色葡萄球菌和大肠杆菌污染食品、水源的机会较多,常引起疾病暴发流行[10-11]。基于壳聚糖良好的抗菌活性,考察了壳聚糖与EDTA联用后对大肠杆菌、金黄色葡萄球菌和白念珠菌的抑菌效应,可为进一步开发壳聚糖基的细菌、真菌高效安全的抗菌剂提供有力数据。
1 材料与方法
1.1 材料
1.1.1 菌株、试剂与培养基
金黄色葡萄球菌Newman菌株,大肠杆菌O157∶H7菌株,白色念珠菌RM1000菌株均由黑龙江八一农垦大学生命科学技术学院微生物制药实验室提供。壳聚糖为杭州富丽生物科技有限公司产品。EDTA为南方东方之珠工贸有限公司产品。酮康唑药片(每片0.2 g)为西安杨森制药有限公司产品。红霉素为上海士锋生物科技有限公司产品。氨苄青霉素为南京奥多福尼生物科技有限公司。YPD培养基(胰蛋白胨2%,葡萄糖2%,酵母抽提物1%,)用于培养白色念珠菌;LB培养基(胰蛋白胨1%,酵母提取物0.5%,氯化钠1%)用于培养大肠杆菌;TSB培养基为美国Dickinson and Company(BD)公司产品;固体培养基所用琼脂粉由北京奥博生物技术责任有限公司提供。
1.1.2 主要仪器
FA2004N型电子天平,上海精密科学仪器有限公司;超净工作台,哈尔滨市东联电子技术开发有限公司;DHP-9162型电热恒温培养箱,上海一恒科技有限公司。
1.2 方法
1.2.1 菌株复苏与活化
用灭菌的Tip头分别蘸取-70℃保存的白色念珠菌菌株、金黄色葡萄球菌菌株和大肠杆菌菌液,在相应的YPD、TSB和LB固体培养基上密布划线后置于35℃恒温培养箱复苏培养。待长出单菌落后,挑取单菌落,在相应的固体培养基上三线法划线,培养活化出单菌落。挑取单菌落接种到相应的1 mL培养基中培养至对数生长期(OD600=0.4~0.6)。
1.2.2 壳聚糖醋酸液(Chitosan-acetate)和EDTA贮液的配制
称取壳聚糖,溶于1.5%的醋酸溶液中,调pH值为4,最终配制成40 g·L-1的贮存液。称取EDTA溶于8%的氢氧化钠(g·mL-1)中,配制成100 g·L-1的贮存液。取壳聚糖醋酸贮存液和EDTA贮存液,配置Chitosan-EDTA混合液使用药液,分别为CE1(Chitosan终浓度为1 g·L-1,EDTA终浓度为1 g·L-1,pH为4)和CE2(Chitosan终浓度分别为0.5 g·L-1,EDTA终浓度为1 g·L-1,pH为4)。将用作测试白念珠菌敏感性试验的阳性对照酮康唑药片(每片0.2 g)充分研磨成粉末后,用甲醇配制0.25 g·L-1酮康唑浓度的药液,0.45 μm滤膜过滤后备用。
1.2.3 不同药液浓度的药敏片制备
参照文献[12],用打孔器(孔径为6 mm)在滤纸上打孔,制备直径为6 mm的圆形滤纸片,装入干净的西林瓶中,高压灭菌,超净台上烘干,4℃保存。
分别将CE1药液、CE2药液、1 g·L-1的壳聚糖药液(C1)、0.5 g·L-1的壳聚糖药液(C2)、1 g·L-1的EDTA液(E)、0.25 g·L-1的酮康唑药液(测试白念珠菌敏感性阳性对照)或0.015 g·L-1的红霉素药液(测试金黄色葡萄球菌敏感性阳性对照)或和0.01 g·L-1的氨苄青霉素药液(测试大肠杆菌敏感性阳性对照)(K,代表三种阳性对照中的任意一种)加入青霉素瓶中,(药液的多少以浸透纸片为宜),将多余的药液倒掉,无菌超净台上晾干或放在37℃的恒温箱内烘干,加盖后置4℃保存备用。
1.2.4 敏感性试验
取对数生长期的白色念珠菌RM1000、金黄色葡萄球菌Newman和大肠杆菌O157:H7菌液10 μL,加入到含有140 μL灭菌水的eppendorf管中充分混匀后,L玻璃棒均匀涂布在YDD、TSB和LB平板上,待菌液完全吸收后,将平板平均划分4个区域,分别贴上将CE1、CE2、C1、C2、E和K药敏片,在平板中心圆点贴上无菌水处理的纸片做阴性对照。35℃下培养24 h。试验重复三次。
1.2.5 杀菌效应测定
用灭菌蒸馏水将培养至对数生长期的菌液调整至1×106CFU·mL-1,取1 mL菌液加入到上述不同浓度的药液中,分别作用和培养0 min,5 min,10 min和20 min,1∶100倍体积培养基稀释后,取50 μL液体涂布到相应平板中,35℃下培养24 h后进行菌落计数。
1.2.6 结果判读
肉眼观察抑菌圈大小。游标卡尺测定抑菌圈直径,每个抑菌圈在两个方向各测量两次,取其平均值,Excel软件处理数据,统计分析结果。菌落计数用笔型细菌计数器进行计数。
2 结果与分析
2.1 EDTA增强病原菌对壳聚糖的敏感性
为研究添加EDTA后Chitosan对病原菌的抑菌效应,我们选取了革兰氏阴性细菌大肠杆菌,革兰氏阳性细菌金黄色葡萄球和病原真菌白色念珠菌为测试代表菌株,进行三次重复试验,获得的抑菌圈数据取平均值,进行统计分析。与0.5 g·L-1的Chitosan和1 g·L-1EDTA相比,添加1 g·L-1的EDTA后,Chitosan对于白念珠菌和大肠杆菌的抑菌效应明显增强,差异显著(P<0.01)。但对于金黄色葡萄球菌,抑菌效果有所增强但差异不显著(P>0.05)(图1)。已有研究表明,chitosan的抑菌效果不呈现剂量效应[6]。为了考察在添加1 g·L-1的EDTA后Chitosan的抑菌效果是否具有剂量效应,我们将Chitosan浓度增加到1 g·L-1,发现添加EDTA后,Chitosan的抑菌活性并没有显著增强(图1),说明chitosan联合EDTA后的抑菌活性不呈现剂量效应。

图1 EDTA增强病原菌对壳聚糖的敏感性Fig.1 Enhanced sensitivity of pathogen against chitosan with EDTA
2.2 EDTA增强壳聚糖对病原菌的抑菌效应
为进一步研究添加EDTA后chitosan对病原菌的增强抑制效应,我们通过抑菌效应方法测试了药液对三种病原菌增殖和存活的影响。试验结果发现,与金黄色葡萄球菌(图2)相比,添加1 g·L-1的EDTA的chitosan溶液能够在很快抑制白色念珠菌(图3)和大肠杆菌(图4)。与各组阳性对照组相比,1 g·L-1的EDTA的chitosan溶液能在20 min内达到杀伤病原菌效应(图2,3和4)。添加1 g·L-1的EDTA后,1 g·L-1的较高浓度壳聚糖溶液的抑菌效应和0.5 g·L-1的较低浓度壳聚糖药液的抑菌效应相当,这一结果与抑菌圈试验结果吻合(图1)。
3 讨论
壳聚糖能够结合一些微生物正常生长所必需的微量元素、金属元素或营养物质以及DNA分子,在酸性条件下,低分子量壳聚糖能破坏细菌细胞壁和细胞膜上的负电荷分布,干扰细胞壁的合成,使细胞壁趋向溶解,高分子质量壳聚糖发挥絮凝剂作用。因而,壳聚糖杀菌和抑菌作用受到广泛关注[2]。EDTA是一种膜通透性促进剂,能增强药物转运[7]。试验首次采用低分子量壳聚糖,研究EDTA作用下壳聚糖是否对病原菌的抑菌效应有所增强。试验结果表明,EDTA能够增强壳聚糖抑菌效应,但不存在剂量依赖性。同时,EDTA对壳聚糖的抑菌增效也明显好于酮康唑组,这可能是由于EDTA增强了壳聚糖干扰细胞壁合成作用或者强化了壳聚糖的絮凝作用,其真实的联合作用机制有待于进一步探索。总之,试验为进一步评价壳聚糖和EDTA作为临床应用的抗菌复合剂提供了实验依据,对于抗耐药菌株新型药物研发具有很高的研究价值。

图2 EDTA对Chitosan抑制金黄色葡萄球菌的增强效应Fig.2 Enhanced effect of S.aureus against chitosan with EDTA
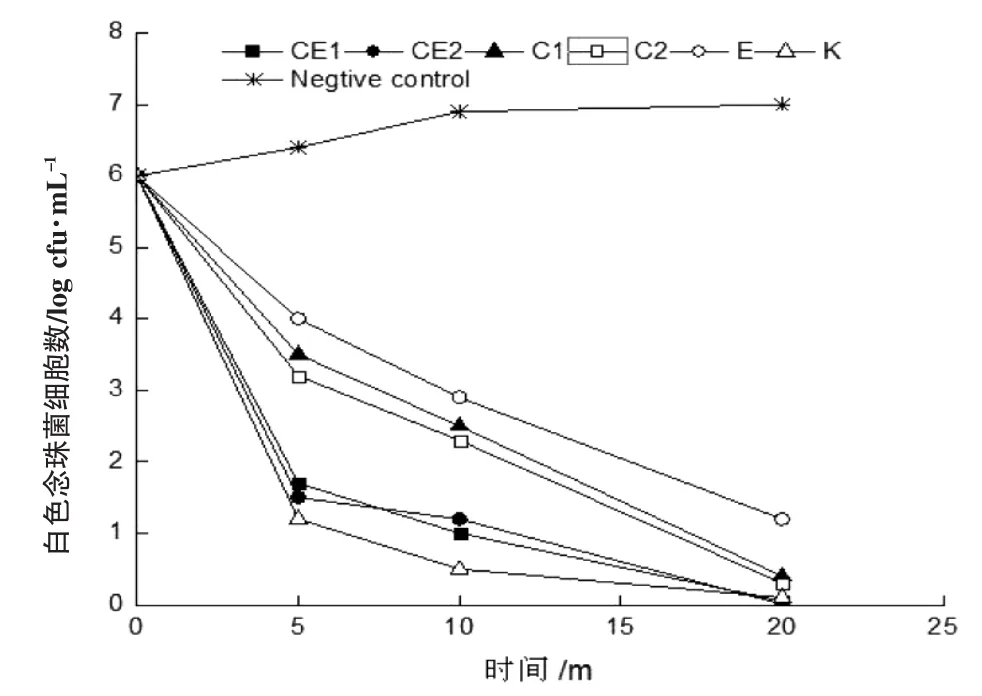
图3 EDTA对Chitosan抑制白色念珠菌的增强效应Fig.3 Enhanced effect of C.albicans against chitosan with EDTA
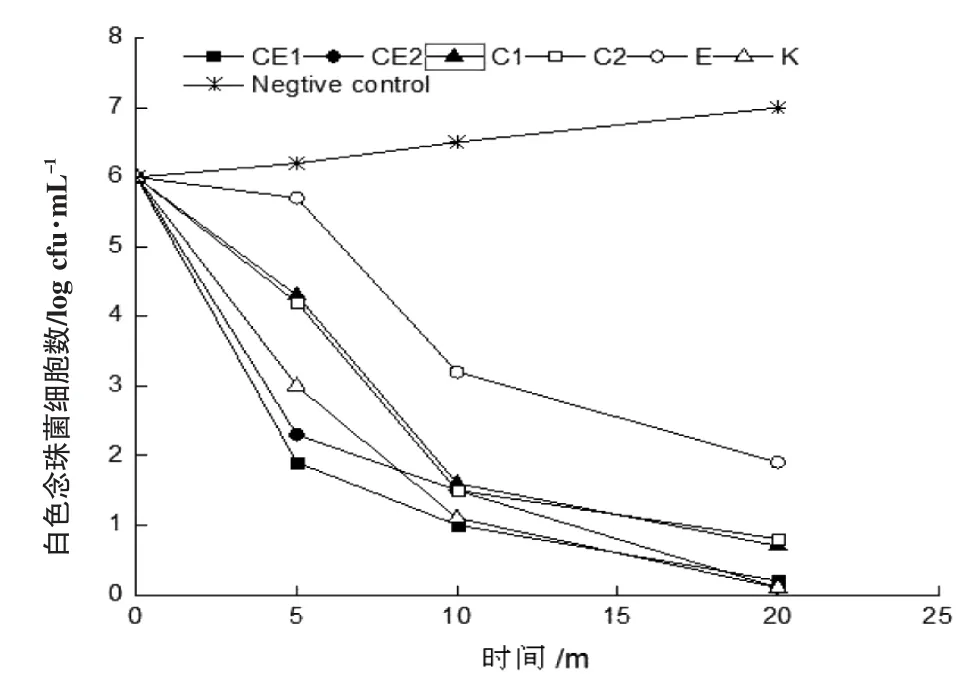
图4 EDTA对Chitosan抑制大肠杆菌的增强效应Fig.4 Enhanced effect of E.coli against chitosan with EDTA
[1]张菊,李金敏,于艳,等.壳聚糖的研究进展[J].饲料与畜牧,2013,6(1):21-25.
[2]胡芳,张惠君,王亮,等.壳聚糖及其衍生物的抗菌机理及在纺织品抗菌整理中的应用[J].印染助剂,2013,30(4):1-5.
[3]陈威,吴清平,张菊梅,等.壳聚糖抑菌机制的初步研究[J].微生物学报,2008,48(2):164-168.
[4]王莹,李大鹏.壳聚糖对白色念珠菌的抑菌研究[J].农产品加工学刊,2012,286(7):52-54.
[5]王科兵,肖激文,王芳宇,等.壳聚糖碘液体外抗真菌活性研究[J].解放军药学学报,2012,18(6):372-374.
[6]周晓涵,康美兰,杨帆,等.壳聚糖和木聚糖对人参不定根中皂苷积累的影响[J].延边农业大学学报,2015(3):217-220.
[7]杨万根,马美湖,张凤凯,等.三种抗菌剂在肉制品中的应用[J].肉类工业,2006,8(21):20-27.
[8]庞晓军,莫国艳,利春红,等.乙二胺四醋酸使耐药菌恢复对抗菌药物敏感性的研究[J].中国医院药学杂志,2008,28(14):1182-1184.
[9]杨继君.白念珠菌生物膜的形成及其耐药机制的研究进展[J].华中医学杂志,2005,29(3):179-180.
[10]Sibylh,Munson,Maryt.Identification and Characterization of Staphylococcal Enterotoxin types Gand I from Staphylococcus aureus[J].Infection and Immunity,1998(3):3337-3348.
[11]Shum L W,McConnel C S,Gunn A A,et al.Environmental mastitis in intensive high-producing dairy herds in New South Wales[J].Australian Veterinary Journal,2009,87(12):469-475.
[12]于立权,杨小雪,张红红,等.金黄色葡萄球菌胞外分泌物对白念珠菌ptc2缺失株酮康唑敏感性的影响[J].黑龙江八一农垦大学学报,2013,25(1):37-40.
Antibacterial and Synergistic Effect of EDTA on Chitosan
Yu Liquan1,Zhang Xiangtao2,Jiang Ziqing3,Li Fenghua4,Zhu Jinyan5,Ning Ruiqi1,Cui Yudong1
(1.College of Life Science and Biotechnology,Heilongjiang Bayi Agricultural University,Daqing 163319;2.Shandong Lianchuang(mining)Architectural Design Co.,LTD;3.Fuyu Brightdairy Ecological Demonstration Co.,LTD;4.Biological Engineering Research Institute,DALIAN SAM Group;5.Food Inspection and Testing Center of Zhuanghe)
The antibacterial synergy of chitosan and EDTA in combination was investigated using vitro diffusion method and killing time.Three kinds of bacteria,E.coli,S.aureus and C.albicans,were tested.The results showed that chitosan and EDTA in combination could enhance the inhibitory effect on tested bacteria.The synergic efficacy of chitosan and EDTA in combination against E.coli was found to be especially significant.It demonstrated that EDTA could enhance the inhibitory effect of Chitosan on bacteria and fungi. This study provided the experimental data for the development of a novel antibacterial agent.
chitosan;EDTA;antibacterial and synergistic effect
S182
A
1002-2090(2016)03-0095-04
10.3969/j.issn.1002-2090.2016.03.019
2015-04-13
黑龙江八一农垦大学“博士科研启动基金”(校启2011YB-15);黑龙江八一农垦大学大学生创新创业训练计划项目(XC2014060)。
于立权(1974-),男,讲师,天津大学毕业,现主要从事病原微生物致病机理及新药研发工作。
