玉米不育系回交转育群体遗传连锁图谱的比较分析
2016-08-07孙丽芳王振王霞邓杰胡凯凤王婧择杨克军
孙丽芳,王振,王霞,邓杰,胡凯凤,王婧择,杨克军
(黑龙江八一农垦大学农学院,大庆163319)
玉米不育系回交转育群体遗传连锁图谱的比较分析
孙丽芳,王振,王霞,邓杰,胡凯凤,王婧择,杨克军
(黑龙江八一农垦大学农学院,大庆163319)
以玉米细胞质雄性不育系cms-合344为试验材料,辐63018为轮回亲本构建BC1F1群体和BC2F1群体,并分别构建SSR标记遗传连锁图谱。结果表明,331对SSR标记中有60对标记在两亲本间呈现稳定多态性;BC1F1群体覆盖玉米基因组总长度为1 637.38 cM,标记间平均图距为27.29 cM,BC2F1群体覆盖玉米基因组总长度为1 183.64 cM,标记间平均图距为19.73 cM;两个图谱的每条染色体标记数目和种类一致,然而各标记位置发生明显变化。研究为玉米不育系回交转育分子辅助选择奠定基础。
玉米;回交转育;遗传连锁图谱
遗传图谱是进行农艺性状QTL定位、分子标记辅助选择育种、种质资源多样性分析等方面研究重要基石[1-2]。玉米是我国重要的粮食作物,为异花授粉作物,天然异交率在90%以上,杂交制种是保证大田生产用种质量的重要环节。选育不育系,利用三系配套制种不但有效保证种子质量,而且极大降低生产成本。在作物育种实践中,不育系的获得可以通过回交转育,然而该方法至少需要4~5个世代才能成功转移性状。1975年以前玉米遗传分析主要依赖于后代性状表现及分离情况等传统方法。随着分子生物学的迅速发展,在回交育种方法上分子标记辅助选择极大地提高了选择效率缩短回交世代[3-4]。目前,利用分子标记辅助选择、构建遗传图谱以及基因定位已经做了很多工作[5-7]。研究发现,SSR标记对日本栽培小豆地方品种×野生小豆的回交BC1F1群体作图,205个SSR覆盖11个连锁群,总程度832.1 cM,平均间距为1.85 cM[8]。然而利用分子标记技术辅助选择玉米不育系回交转育后代的研究还未见报道,研究以不育系和欲转育为不育系的优良自交系为试验材料,进行杂交和回交获得回交一代和回交二代分离群体,进行遗传图谱构建,旨在对不同回交世代遗传连锁图谱进行比较和分析,为进一步进行基因定位和分子标记辅助选择奠定基础。
1 材料与方法
1.1 试验材料
cms-合344:细胞质雄性不育系,黑龙江八一农垦大学密山试验实习基地选育;辐63018:由黑龙江省农科院玉米所辐射育种室提供。
1.2 试验方法
2012年以玉米细胞质雄性不育系cms-合344为母本与辐63018进行杂交,2013年种植F1与父本进行回交,获得BC1F1。2013年10月随机取200粒BC1F1种子和父本辐63018在海南进行回交加代,共获得120株BC2F1回交后代。
在室内随机取BC1F1和BC2F1两世代种子各200粒发芽,提取单株基因组DNA,最后两世代各保留150株构建遗传连锁图谱。
1.3 DNA提取及SSR标记分析
将取回的叶片放入研钵中,加入液氮后迅速研磨至粉末,玉米基因组总DNA的提取参照张玉胡CTAB方法并略有改动。用紫外分光光度计检测DNA的质量浓度,用TE缓冲液将DNA工作液的浓度调至100 ng·μL-1于4℃保存,保存液浓度为300 ng·μL-1于-20℃保存。
SSR引物序列信息摘自玉米基因组数据库(http://www.maizegdb.org/ssr.php),并由北京华大基因科技有限公司合成。
PCR扩增反应总体系为10 μL,ddH2O 5.6 μL, 10×PCR buffer 1.0 μL,dNTP(2.5 mM each)1.0 μL,上下游引物各0.5 μL,PCR Taq(5 μ·μL-1)0.2 μL,DNA(100 ng·μL-1)1.2 μL。PCR反应程序为95℃变性5 min;95℃30 s,60℃30 s,72℃45 s,共30个循环;72℃延伸10 min;12℃保存。扩增后的产物采用8%聚丙烯酰胺凝胶电泳进行分析。
1.4 统计分析
1.4.1 SSR带型统计分析
待胶片取出后置于灯箱上进行观察、照相。对条带进行统计并记录。根据筛选出的具有多态性的SSR引物扩增结果,在相同的迁移位置上,群体中带型与轮回亲本带型相同者赋值为“0”,为两亲本共同拥有的杂合带型赋值为“1”,缺失的标记赋值为“-1”。利用EXCEL2003对数据进行统计。
1.4.2 遗传连锁图谱的构建
将统计好的符合要求的数据采用QTLIcimapping4.0软件,对BC1F1、BC2F1群体的SSR标记位点进行遗传连锁分析,按照LOD临界值3.00标准分群,采用Kosambi作图函数构建遗传连锁图谱。
2 结果与分析
2.1 亲本间多态性引物筛选
随机选用玉米10条染色体上的SSR引物331对,对cms-合344和辐63018两亲本进行SSR标记分析,选出具有多态性标记SSR引物60对(表1),占筛选引物总数的18.13%。
多态性SSR引物的选择,两亲本间存在明显的差异条带,PCR扩增后的产物在8%的聚丙烯酰胺凝胶上带型清晰可见,60对SSR引物对BC1F1和BC2F1两群体进行多态性扩增,所筛选出的引物均能在8%聚丙烯酰胺凝胶电泳中检测到稳定的产物条带。根据扩增出的电泳条带进行统计,并计算遗传背景回复率。见图1。

图1 SSR标记um c2067在玉米(cm s-合344×辐63018)回交后代群体中扩增结果电泳图Fig.1 The results of amplified by umc2067 in backcross progeny group
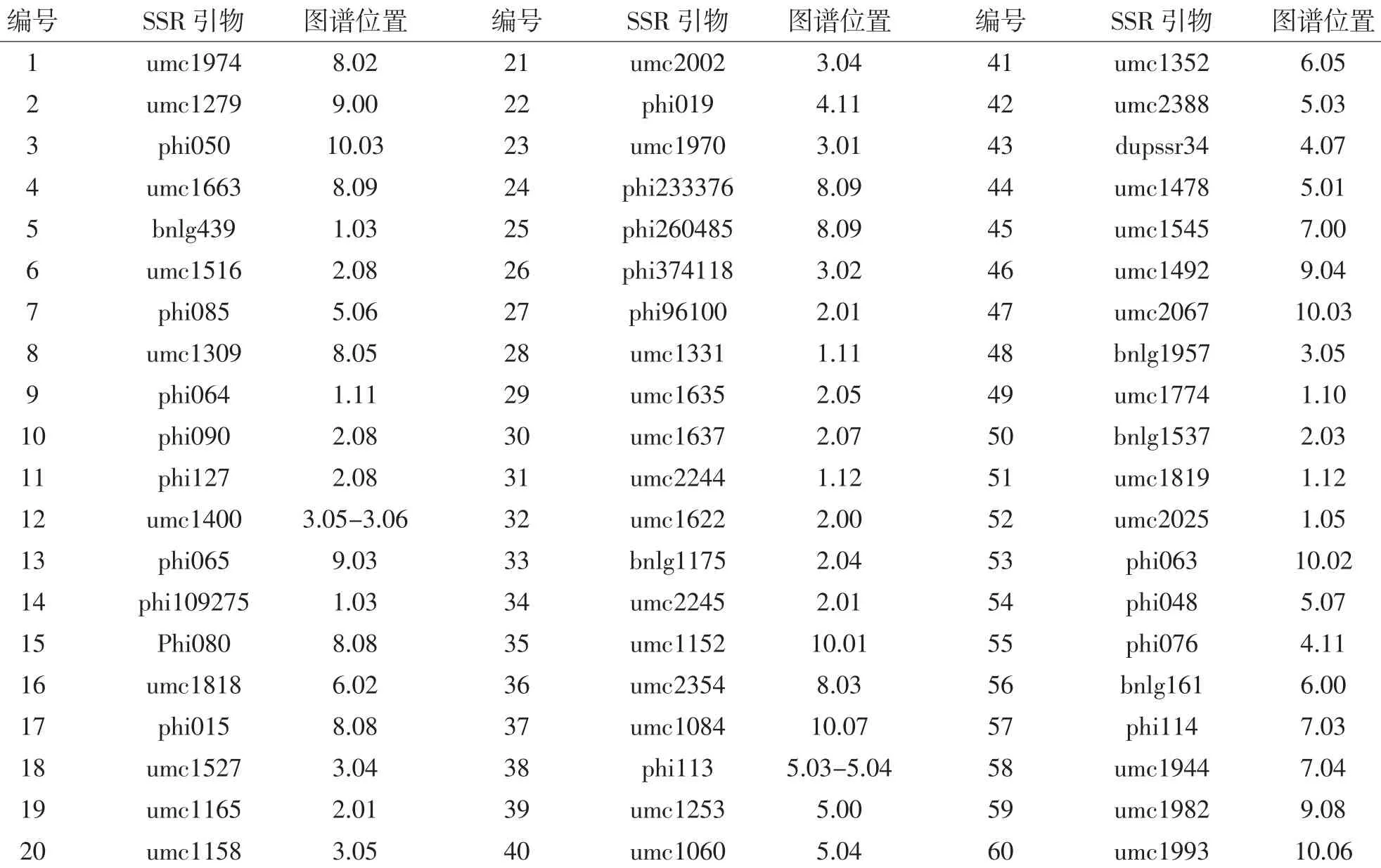
表1 60对SSR引物及其图谱位置Table 1 60 pairs of SSR primers and their map location
2.2 两群体遗传连锁图谱的比较
根据60对SSR引物的扩增信息,用QTLIcimapping4.0软件构建遗传连锁图谱,BC1F1和BC2F1遗传连锁图谱如图2和图3所示,标记在染色体上的分布情况如表2所示。根据经典形态学标记和SSR标记位点的结果,60个SSR标记全部可以分布到10条染色体上。从两遗传连锁图谱可以看出,两图谱在个别染色体上的标记位置以及在基因组覆盖程度上均存在明显的变化。BC1F1遗传连锁图谱覆盖玉米基因组总长度为1 637.38 cM,标记间平均图距为27.29 cM。其中第二条染色体上的标记最多,为11个标记,覆盖染色体225.85 cM,标记间平均图距为20.53 cM;第4、6和第7条染色体上的标记最少,都为3个标记,覆盖染色体分别为84.55 cM、135.70 cM和70.36 cM,标记间平均图距为28.18 cM、45.23 cM和23.45 cM。在10条连锁群中最大标记间距离在第1条染色体上,标记间距离为124.07 cM,最小标记间距离在第8条染色体上,标记间距离为2.95 cM(图2)。
BC2F1遗传连锁图谱覆盖玉米基因组长度为1 183.64 cM,标记间平均图距为19.73 cM。在第二条染色体上的标记数目最多为11个,覆盖染色体长度为207.9 cM,标记间平均图距为18.90 cM;在4、6和第7条染色体上的标记最少,各为3条,覆盖染色体长度分别为90.63 cM、99.71 cM和50.47 cM,标记间平均图距分别为30.21 cM、33.24 cM和16.82 cM。在10条染色体中最大标记间距离在第4条染色体上,标记间距离为77.65 cM,最小标记间距离在第3条染色体上,标记间距离为2.72 cM(图3)。
另外,从表2中可以看出在每条染色体上BC2F1遗传连锁图谱覆盖玉米基因组长度和平均图距都要小于BC1F1群体。同时,比较图2和图3可以发现,在每条染色体上BC1F1和BC2F1的标记数目和种类是一致,而标记的位置发生明显变化,如在第1条染色体的标记umc1774在BC1F1群体图谱位置为0.0 cM,而该标记在BC2F1群体图谱位置为163.53 cM。

表2 BC1F1和BC2F1群体遗传连锁图谱染色体上的标记分布情况Table 2 Distribution of markers on chromosome of genetic linkage map in BC1F1 and BC2F1 populations

图2 BC1F1遗传连锁图谱Fig.2 BC1F1 genetic linkage map

图3 BC2F1遗传连锁图谱Fig.3 BC2F1 genetic linkage map
3 结论与讨论
随着分子标记技术的问世,Helentjaris构建了首张玉米RFLP连锁图谱,但由于该标记技术费用昂贵、信息量小、操作时间长等缺点逐渐被淘汰[9,10]。微卫星DNA分子标记,即SSR标记广泛存在于真核生物中,具有多态性丰富、共显性、操作简单等优点正大量应用于遗传图谱构建、品种纯度鉴定以及物种进化等方面的研究[8]。实验以玉米细胞质雄性不育系cms-合344和辐63018为试验材料,以辐63018为轮回亲本构建BC1F1群体和BC2F1群体,利用60对在两亲本间呈现多态性的SSR标记,构建两个世代群体遗传图谱。BC1F1群体覆盖玉米基因组总长度为1 637.38 cM,标记间平均图距为27.29 cM,BC2F1群体覆盖玉米基因组总长度为1 183.64 cM,标记间平均图距为19.73 cM,分析两个群体图谱间的差异是由于BC2F1经回交两代后群体内杂合度降低而导致标记交换的可能性变小,最终使得覆盖长度和平均图距减少。图谱为玉米不育系回交群体的分子标记奠定了基础,对于发掘双亲之间其他优异农艺性状基因资源具有非常重要的价值。
[1]刘列钊,李加纳.利用甘蓝型油菜高密度SNP遗传图谱定位油酸、亚麻酸及芥酸含量QTL位点[J].中国农业科学,2014,47(1):24-32.
[2]陈建省,陈广凤,李青芳,等.利用基因芯片技术进行小麦遗传图谱构建及粒重QTL分析[J].中国农业科学,2014,47(24):4769-4779.
[3]岳效飞.分子标记辅助选择在回交育种中的两种数学模型及其原理剖析[J].中国农学通报,2011,27(9):265-267.
[4]相吉山,谢宗铭,董永梅,等.SSR分子标记辅助选择转育棉花胞质雄性不育系的回交亲本[J].棉花学报,2011,23(2):127-133.
[5]刘红军.玉米IBM Syn10群体高分辨率遗传连锁图谱构建及穗部相关性状QTL/miRNA遗传解析[D].雅安:四川农业大学,2013.
[6]魏海忠.玉米遗传图谱的构建及生育期相关性状的QTL定位[M].泰安:山东农业大学,2013.
[7]高树仁.分子标记辅助选择在作物改良中的应用概述[J].黑龙江八一农垦大学学报,2006,18(1):5-7.
[8]骆晚侠,张李,杨凯,等.小豆SSR分子标记遗传连锁图谱构建[J].中国农业科学,2013,46(17):3534-3544.
[9]Helentjaris T,Slocum M,Wright S,et al.Construction of genetic linkage maps in maize and tomato using restriction fragment length polymorphisms[J].Theor.Appl.Genet,1986,72:761-769.
[10]曹永国,王国英,王守才,等.玉米RFLP遗传图谱的构建及矮生基因定位[J].科学通报,1999,44(20):2178-2181.
Comparative Analysis of Genetic Linkage M ap of M aize Sterile Line Backcross Transformation Populations
Sun Lifang,W ang Zhen,W ang Xia,Deng Jie,Hu Kaifeng,W ang Jingze,Yang Kejun
(College of Agronomy,Heilongjiang Bayi Agricultural University,Daqing 163319)
Maize sterile line CMS-He as materials,344BC1F1 and BC2F1 populations were built by using Fu63018 as recurrent parent and their SSR markers genetic linkage maps were obtained.The results showed that a total of 60 pair markers displayed steady polymorphism between two parents;the BC1F1 group covered 1 637.38 cM length of maize genome,and the BC2F1 group covered 1 183.64 cM,the average marker interval was 27.29 cM and 19.73 cM,respectively;the number and type of markers in each chromosome were consistent with two maps,but the position of each marker was changed.The analysis laid the theoretical basis for molecular assisted selection of maize sterile line backcross transportation.
maize;backcross;genetic linkage map
S513
A
1002-2090(2016)03-0001-05
10.3969/j.issn.1002-2090.2016.03.001
2015-07-15
农业部公益性项目(201303007);黑龙江省青年科学基金(QC2015029);黑龙江八一农垦大学作物学科学技术骨干科研启动项目(ZWXQDJ-6)。
孙丽芳(1981-),女,讲师,吉林大学毕业,现主要从事玉米遗传育种方面的研究工作。
杨克军,男,教授,博士研究生导师,E-mail:byndykj@163.com。
