HIV/AIDS患者HAART治疗后骨密度变化的研究
2016-08-07王晶晶陈宗锋张强李亚茹蔡娟赵汝刚李鑫赵昌松刘琨
王晶晶 陈宗锋 张强* 李亚茹 蔡娟 赵汝刚 李鑫 赵昌松 刘琨
1. 潍坊医学院,山东 潍坊 261053 2. 首都医科大学附属北京地坛医院,北京 100015
1996年,美籍华裔科学家何大一提出“鸡尾酒疗法”,即联合高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART)。HAART的使用提高了HIV/AIDS患者的免疫功能,降低了死亡率,提高了生活质量[1]。但是患者在治疗过程中,出现药物副反应,例如骨代谢紊乱。应用抗病毒药物后,HIV感染者出现骨量丢失,且骨量显著丢失发生在治疗后的12~24月[2],主要涉及核苷类逆转录酶抑制剂(NRTIs)和蛋白酶抑制剂(PIs)。目前,HAART导致骨代谢异常机制不明确。本研究旨在探讨比较不同HAART治疗时间的HIV/AIDS患者骨密度,前赡性预测HIV/AIDS患者骨代谢紊乱的风险。
1 材料和方法
1.1 研究对象
随机选择就诊于北京地坛医院的HIV/AIDS患者,研究对象共被分为4组:未接受HAART治疗组40例;接受HAART治疗1年组41例;接受HAART治疗2年组45例;接受HAART治疗3年以上组44例。纳入标准:① HIV确诊阳性,② 20~45岁男性。排除标准:①急性感染期的患者,②合并乙肝、丙肝患者,③出现AIDS相关并发症或进入AIDS期 (国家艾滋病诊疗指南规定),④合并严重肝肾功能障碍的患者。
1.2 研究方法
OPG、RANKL指标检测方法:所有患者空腹10 h,于次日8:00抽空腹血,离心取血浆,置于-80℃冰箱内备用,分别采用美国Raybiotech公司和美国Kappa试剂盒,以全自动多功能酶标仪(Multiskan MK3,Thermo,USA)检测。应用ELISA试剂盒定量检测HIV-1阳性和对照组血浆骨保护素(osteoprotegerin,OPG)和核因子κ B受体活化因子配体(receptor activator for nuclear factor-κ B ligand,RANKL)浓度。血浆HIV-1病毒载量测定应用HIV-1-RNA 3.0试剂盒,HIV-1RNA定量表示为每毫升血浆Copies的数量,检测极限为50 log10copies/mL。OPG试剂盒批内变异数<10%,RANKL试剂盒批内变异数为3%~5%。应用FACS Calibur流式细胞仪检测患者CD4+T细胞绝对计数。
骨密度测量方法:应用GE公司Achilles Express跟骨超声骨密度仪,骨密度根据跟骨硬度指数(stiffness index,SI)确定。同时测量宽波段超声衰减(broadband ultrasound attenuation,BUA)、超声速度(speed of sound,SOS),SI通过以下公式计算:SI=0.67 × BUA+0.28×SOS-420。测量工作由专人负责,统一测定受试者左足跟骨。
超声跟骨硬度指数计算方法及骨质疏松诊断标准:硬度指数以T值表示,T=(所测骨密度值-正常年轻人群平均骨密度)/正常年轻人群骨密度的标准差。跟骨骨密度较同性别成人峰值骨量均值下降2.5个标准差或以上为骨质疏松,下降1个标准差以上但未达到2.5个标准差者为骨量减少,以此来判断跟骨密度情况[3]。本研究中的患者相对年轻,选择使用Z得分,在相同的截止值t分数对骨量减少及骨质疏松的诊断。
1.3 统计学处理

2 结果
2.1 4组患者跟骨骨密度
经HAART治疗后患者的跟骨骨密度与未治疗患者相比降低,治疗>3年组跟骨骨密度值显著低于未治疗组,具有统计学意义(P<0.05),治疗≥3年组跟骨骨密度值低于治疗2年组,但无统计学意义。相关性分析表明跟骨骨密度与HAART时间呈负相关(r=-0.371,P=0.034)。治疗2年组、治疗≥3年组骨密度降低发生率高于未治疗组。
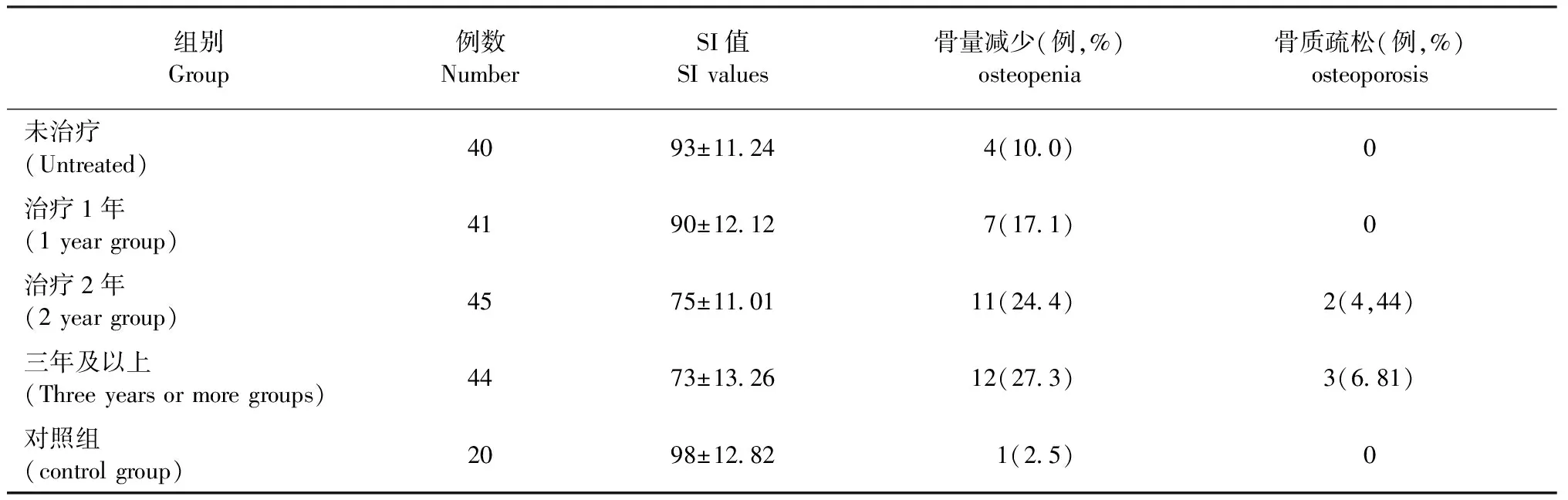
表1 各组患者跟骨SI和骨质疏松发生率的检测情况Table 1 Calcaneal SI and incidence of osteoporosis in different groups
2.2 4组患者基本情况
4组患者在年龄、体重、身高、BMI方面无明显统计学差异。治疗前CD4+T细胞计数、横断面CD4+T细胞计数和病毒载量的差异均具有统计学意义(P<0.05)。经HAART治疗后,患者HIV RNA水平明显降低,并且在1年内降低最显著;患者CD4+T细胞计数升高,并且在治疗的第12月内升高速度最快。

表2 4组患者基本情况Table 2 Basic information of patients in the 5
2.3 4组患者生化指标
治疗后的患者血清RANKL水平与未治疗患者相比明显升高,且RANKL/OPG比值升高,差异具有统计学意义(P<0.05)。

图1 各组患者OPG和RANKL的比较OPG和RANKL的单位分别为ng/L和pmol/LFig.1 Comparison of OPG and RANKL among the groups
3 讨论
规范化的HAART治疗降低了艾滋病患者的死亡率,延长了HIV/AIDS患者的生命周期,使其成为慢性疾病。长期的药物治疗引起了多种副作用,骨代谢紊乱是其中较易忽视的重要方面,骨量降低、骨质疏松,部分患者出现了骨质疏松性骨折,严重影响了患者的生存质量,并成为部分患者死亡的直接原因。正常人群中,骨量降低已被认为是骨质疏松性骨折的重要危险因素。HIV/AIDS患者骨质疏松的发生率明显升高。且有研究表明,HIV/AIDS患者中骨质疏松骨折发生率明显升高。跟骨中松质骨所占比例可到90%以上。而松质骨代谢较皮质骨快7倍左右,能明显反应骨代谢,可较准确的反应骨质丢失情况[4]。因此,我们选用跟骨骨密度作为预测患者骨代谢紊乱的指标。
本研究表明,治疗1年组患者骨密度与未治疗组之间骨密度无显著降低。而治疗2年组与治疗3年及以上组骨密度均较未治疗组骨密度显著减低,治疗2年组与治疗3年及以上组骨密度降低幅度相对较小,相关性分析表明,HAART治疗是骨密度降低的危险因素。
抗病毒治疗2年后骨密度与3年及以上组骨密度降低较初始应用HAART治疗降低幅度小,可能涉及到炎症的作用。近期研究表明,HIV感染或经抗病毒治疗后,病毒处于持续复制,使HIV感染患者长期处于慢性炎症状态[5]。研究发现,在艾滋病程中,炎症是引起骨代谢紊乱的重要因素。在HAART治疗12月后,患者HIV RNA基本达到检测水平以下,但是抗病毒治疗后患者与未治疗患者骨密度明显降低,可能与炎症的持续存在相关。HAART治疗1年后,HIV RNA降低到检测水平以下,但病毒血症持续存在。应用抗病毒药物治疗2年、3年及以上骨密度缓慢降低,病毒复制明显被抑制后,体内炎症处于同一水平上下波动,或者以缓慢水平降低,所以在治疗一段时间后骨密度降低幅度明显减小。
在接受抗病毒治疗后,骨密度降低已成为临床上较为普遍的现象。研究表明,接受HAART治疗后,HIV感染患者血清RANKL水平明显升高。OPG/RANK/RANKL系统在调节骨代谢中发挥重要作用,RANKL是由成骨细胞分泌的能够调节破骨细胞生成、分化和功能发挥的重要细胞因子。Giner等[6]研究表明,骨疏松模型中RANKL表达升高,而采用雌激素和雷洛昔芬(raloxifene)治疗后,骨密度增加,同时RANKL降低。前期的研究将HIV病毒载量与RANKL水平相联系,并且认为二者在引起骨密度降低过程中具有一致性,即HIV病毒载量与RANKL水平之间存在正相关[7]。本研究中,在接受抗病毒药物一段时间后HIV病毒载量明显降低,患者在接收HAART治疗后,血清RANKL水平明显升高,RANKL/OPG比例在治疗1年后升高,在治疗2年、3年及以上组降低。
本研究主要采用TDF+3TC+EFV方案,HAART治疗方案(含TDF方案)对BMD的影响尚无定论。本研究表明,在持续性应用HAART后,HIV患者骨密度降低。虽然短期内骨密度降低并不显著,但在HAART治疗过程中骨密度发生持续性的丢失。但是鉴于跟骨骨密度检测仪的敏感性,本研究采用的RANKL/OPG可作为检测骨密度降低的重要指标。众所周知,PI对骨密度的影响[8],同时有研究报道,高糖血症、高脂血症以及身体脂肪异常分布均与PI的使用有关[9],关于脂代谢与骨代谢之间的关系尚无定论。因此,在本研究中,患者的治疗方案均为一种NNRTI和两种NRTI,并不包含PI。
通过本研究的分析,我们认为,HAART治疗后患者存在不同程度骨密度降低。这与之前的研究结果相一致。虽然,骨密度降低具体原因尚不明确,但是我们的研究表明支持炎症、HAART的对骨密度的作用。在治疗的早期,应定期检查炎症指标、检测骨密度变化。
