葡萄酒泥酵母制备水溶性β-D-葡聚糖工艺优化及其纯化后抗氧化性分析
2016-08-06杨学山马腾臻韩舜愈甘肃农业大学生命科学技术学院甘肃兰州730070甘肃省葡萄与葡萄酒工程学重点实验室甘肃兰州730070甘肃农业大学食品科学与工程学院甘肃兰州730070
杨学山,祝 霞,李 颍,杨 婷,马腾臻,韩舜愈(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070;3.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
葡萄酒泥酵母制备水溶性β-D-葡聚糖工艺优化及其纯化后抗氧化性分析
杨学山1,2,祝 霞2,3,李 颍2,3,杨 婷2,3,马腾臻2,3,韩舜愈2,3
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070;3.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
以诱导自溶后的葡萄酒泥酵母细胞壁为试材,采用蛋白酶水解法,通过响应面分析法确定制备水溶性β-D-葡聚糖的最佳工艺条件,将粗品经Sephacryl S-400 HR凝胶柱层析纯化后,对其抗氧化性进行分析。结果表明,酶解制备水溶性β-D-葡聚糖的最佳工艺条件为浸提温度60 ℃、加酶量247 U/mL、pH 7.5、浸提时间1.5 h,得率为80.91%。凝胶柱层析纯化后得到3 种组分,比例依次为组分Ⅰ 68.08%、组分Ⅱ 13.97%、组分Ⅲ 8.79%,其中组分Ⅰ分子质量为100 065.18 D。纯化后的水溶性β-D-葡聚糖清除ABTS+·、羟自由基、DPPH自由基、O2-·和螯合Fe2+的EC50值分别为2.035、6.352、16.773、5.238、1.061 mg/mL,具有良好的抗氧化活性。
葡萄酒泥酵母;可溶性β-葡聚糖;提取纯化;抗氧化
葡萄酒发酵过程中产生的大量酵母细胞中含有丰富的多糖、氨基酸、维生素、酶及矿物质,是开发生物活性物质的优良资源[1]。但在实际生产中酒泥酵母常被当作饲料、肥料甚至垃圾处理,不仅未能充分体现其经济价值,而且形成了很大的环保压力,已成为葡萄加工业亟需解决的行业性问题[2-3]。
β-D-葡聚糖约占酵母细胞壁干物质含量的60%,具有抗肿瘤、抗辐射、抗氧化等功能[4-5],可广泛用于化妆品、食品、医药等领域[6-8]。研究[9-10]表明,酵母葡聚糖在水中的溶解度与其分子内部的聚合度、分支度和化学修饰有关,直接提取的β-D-葡聚糖水溶性差,限制了其实际应用。因此,探索安全、高效的增溶工艺,获得大分子质量的可溶性β-D-葡聚糖是促进其产业化推广的关键问题之一。目前已有通过化学修饰法制备可溶性β-D-葡聚糖的相关报道[11],但存在潜在安全隐患;生物酶是通过特异性或非特异性地作用于葡萄糖苷键,将多糖裂解为聚合度较低的低聚糖以增强其溶解性的新方法[12]。王成龙等[13]采用葡聚糖酶降解不溶性葡聚糖,由于葡聚糖酶可专一作用于葡聚糖主链的β-1,3-D-糖苷键,很容易将多糖降解为分子质量过低的低聚糖或寡糖,从而严重影响其生物活性,使获得的水溶性多糖失去应用价值。近年来,一些非专一性酶受到了重视,余奕珂等[14]采用来自于芽孢杆菌的Alcalase蛋白酶将酵母葡聚糖水解为分子质量较大的可溶性低聚糖,且保持了多糖生物活性及功能。
本实验以诱导自溶后的葡萄酒泥酵母细胞壁为原料,采用响应面分析法对酶法水解制备水溶性β-D-葡聚糖的工艺进行优化,并将粗品经Sephacryl S-400 HR凝胶柱层析纯化后,系统研究其体外抗氧化作用,以期为降低酵母多糖生产成本、拓展应用领域、促进葡萄酒泥酵母的资源化开发提供技术支持。
1 材料与方法
1.1 材料与试剂
葡萄酒酵母泥 甘肃祁连葡萄酒业有限公司;葡萄糖标准品 美国Sigma公司;中性蛋白酶、碱性蛋白酶、胰蛋白酶 中国Biosharp公司;兰色葡聚糖、Dextran标准品 美国Pharmacia公司;2,2′-联氮基-二(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、菲洛嗪、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH) 上海源叶生物科技有限公司;冰乙酸、异丙醇、无水乙醇、氯化钠、乙酸钠、蒽酮、乙二胺四乙酸等均为国产分析纯。
1.2 仪器与设备
AL204电子天平 梅特勒-托利多仪器(上海)有限公司;TDZ5-WS湘仪离心机 长沙湘仪离心机仪器有限公司;HH-1数显恒温水浴锅 上海梅香仪器有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;PHS-3C型pH计 上海雷磁有限公司。
1.3 方法
1.3.1 水溶性β-D-葡聚糖提取工艺流程
葡萄酒泥→诱导自溶→除甘露聚糖→除脂质→酶解→乙醇醇析(酶解液-乙醇体积比2∶1,12 h)→丙酮、乙醚洗涤(15 min,2 次)→透析→冷冻干燥→水溶性β-D-葡聚糖样品
1.3.2 操作要点
1.3.2.1 酵母自溶
参照本实验室已建立的方法,称取4 g葡萄酒泥酵母,溶于质量分数2% NaCl溶液、pH 4.5的醋酸-醋酸钠缓冲液,47.5 ℃诱导自溶33 h。
1.3.2.2 除甘露聚糖
称取2.5 g自溶后的酵母细胞壁,以料液比1∶23在124 ℃条件下(高温灭菌锅)热水浸提5 h,离心后取沉淀。
1.3.2.3 除脂质
将沉淀用蒸馏水洗涤2~3 次,加入3 mL体积分数为4%的冰乙酸溶液,室温条件下放置2 h,将离心后的沉淀用蒸馏水洗涤2 次,以料液比1∶2加入异丙醇,4 ℃静置过夜,离心取沉淀。
1.3.2.4 酶解
向沉淀中加一定量酶液,在适当pH值及温度条件下酶解一定时间,85 ℃灭酶15 min,离心取上清液。
1.3.2.5 透析
向上清液加入无水乙醇醇析,丙酮、乙醚洗涤后沉淀用蒸馏水溶解,所得溶液依次用蒸馏水透析48 h、蒸馏水透析24 h,透析完成后,将透析袋(8 000~14 000 D)内溶液进行冷冻干燥,即得水溶性β-D-葡聚糖。
1.3.3 水解酶的筛选
以中性蛋白酶、碱性蛋白酶、胰蛋白酶3 种蛋白酶为水解酶,在其各自最适酶解条件(参照产品说明书)下水解3 h(表1),以水溶性β-D-葡聚糖得率为评价指标,对3 种不同蛋白酶的酶解效果进行评价,筛选水解效果较好的酶。

表1 不同酶的最适酶解条件Table 1 Optimale nzymatich ydrolysisc on diti on sf ord ifferente nzymes
1.3.4 单因素试验设计
称取1 g葡聚糖沉淀,分散到20 mL的磷酸缓冲溶液中,加入碱性蛋白酶进行水解,分别考察浸提温度(50、55、60、65、70 ℃)、浸提时间(0.5、1.0、1.5、2.0、2.5 h)、加酶量(100、150、200、250、300 U/mL)和缓冲液pH值(6.0、6.5、7.0、7.5、8.0)对水溶性β-D-葡聚糖得率的影响。
1.3.5 响应面优化试验
在单因素试验的基础上,根据Box-Behnken试验设计原理,以水溶性β-D-葡聚糖得率为响应值,设计四因素三水平的响应面分析试验,优化提取工艺。
1.3.6 水溶性β-D-葡聚糖含量测定
1.3.6.1 标准曲线的制作
参照文献[15]的方法并修改,准确配制葡萄糖质量浓度为0、0.02、0.04、0.06、0.08、0.10 mg/mL,加入4 mL 0.2%蒽酮试剂,混合均匀后迅速冷却,煮沸10 min后取出,迅速冷却,室温放置10 min。于620 nm波长条件下比色,记录吸光度。以葡萄糖标准品质量浓度为横坐标,吸光度为纵坐标,得标准曲线方程为:y=7.202 9x+0.001 9,相关系数R2=0.999 3。
1.3.6.2 样品制备及测定
称取固体样品25 mg放入水解管中,加入2.7 mol/L的H2SO46.75 mL后封管,置于100 ℃沸水浴中水解3 h,冷却至室温,水解液转入容量瓶定容备用。取样液1 mL,按1.3.6.1节方法测吸光度,以标准曲线方程计算水溶性β-D-葡聚糖质量浓度。
1.3.7 水溶性β-D-葡聚糖得率计算

1.3.8 水溶性β-D-葡聚糖凝胶柱层析
1.3.8.1 水溶性β-D-葡聚糖纯化
取制备的水溶性β-D-葡聚糖样品进行凝胶柱层析,将其上样到已平衡好的Sephacryl S-400 HR凝胶柱(1.0 cm×50 cm)上。其中,上样量为10 mg,上样体积为1 mL,用含0.5 mol/L的NaCl溶液进行洗脱,洗脱流速为2 mL/min,自动收集器收集洗脱液,每管馏分2 mL,采用紫外分光光度法进行跟踪检测,收集合并主峰,测定水溶性β-D-葡聚糖含量[16]。
1.3.8.2 水溶性β-D-葡聚糖相对分子质量测定
凝胶柱用0.5 mol/L的NaCl溶液平衡60 h后分别用3 mg兰色葡聚糖和Dextran标准品(T500、T70、T40、T10)相继上柱,测得外水体积V0和洗脱体积V,以分子质量对数lgMw为纵坐标,V/V0为横坐标绘图,制作标准曲线。
将纯化的水溶性β-D-葡聚糖上样,分部收集流出液(1 mL/管)。水溶性β-D-葡聚糖采用蒽酮-硫酸法检测糖峰,分别测定洗脱体积V1,依据V1/V0从标准曲线求得样品分子质量[17]。
1.3.9 水溶性β-D-葡聚糖体外抗氧化活性测定
1.3.9.1 抗氧化物制备
参照文献[18]方法并修改,将分离制备的水溶性β-D-葡聚糖,采用活性炭脱色法去除其中的色素成分,100 ℃加热浓缩、干燥后配制质量浓度为1.1、1.6、2.1、2.6、 3.1、3.6、4.1 mg/mL的水溶性β-D-葡聚糖测定液,并配制相同质量浓度的阳性对照VC和EDTA溶液。
1.3.9.2 ABTS+·清除能力测定
参照文献[19]方法并修改。以VC作阳性对照,计算如式(2)所示:
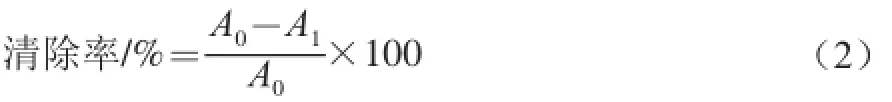
式中:A0为ABTS工作液和乙醇的吸光度;A1为ABTS工作液和水溶性β-D-葡聚糖的吸光度。
1.3.9.3 羟自由基清除能力测定
参照文献[20]。以VC为阳性对照,计算如式(3)所示:

式中:A0为空白对照吸光度;A1为水溶性β-D-葡聚糖存在条件下的吸光度;A2为只含水溶性β-D-葡聚糖的吸光度。
1.3.9.4 DPPH自由基清除能力测定
参照文献[20]。以VC为阳性对照,计算如式(4)所示:
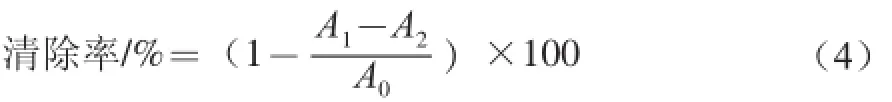
式中:A0为DPPH和磷酸钠盐缓冲液的吸光度;A1为DPPH和水溶性β-D-葡聚糖溶液的吸光度;A2为水溶性β-D-葡聚糖和磷酸钠盐缓冲液的吸光度。
参照[21]方法并修改。以VC为阳性对照,计算如式(5)所示:
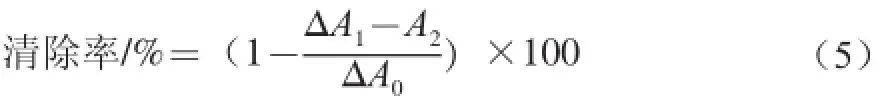
式中:ΔA0为邻苯三酚自氧化速率;ΔA1为加入水溶性β-D-葡聚糖水解液后邻苯三酚的氧化速率;A2为只含水溶性β-D-葡聚糖时的吸光度。
1.3.9.6 Fe2+螯合能力测定
参照[20]方法并修改。以EDTA为阳性对照,计算如式(6)所示:
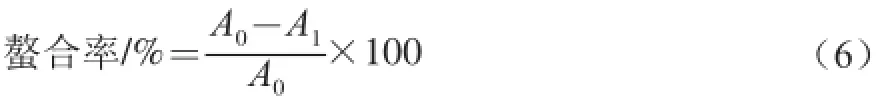
式中:A0为不含水溶性β-D-葡聚糖的吸光度;A1为在水溶性β-D-葡聚糖存在时的吸光度。
1.3.10 半数有效浓度(median effective concentration,EC50)计算
EC50是指清除率为50%时水溶性β-D-葡聚糖、VC或EDTA的质量浓度,采用Logit回归计算。EC50可作为评价抗氧化能力的重要参数,如某种物质的EC50低于10 mg/mL,则表明其具有很好的抗氧化活性[22]。
1.4 数据分析
实验设3次重复,数据采用Excel 2007软件进行整理和图表处理,SPSS 17.0进行显著性分析。
2 结果与分析
2.1 水解酶筛选结果

图1 3 种酶对水溶性 β-D-葡聚糖酶解效果Fig.1 Comparison of extraction efficiencies of water-soluble β-D-glucan with three enzymes
由图1可知,3 种蛋白酶中碱性蛋白酶对β-D-葡聚糖水溶化效果最好,在酶解时间为1.5 h时水溶性β-D-葡聚糖得率最大,达70.70%。胰蛋白酶和中性蛋白酶分别在1.5、2.0 h时达到最大52.66%和53.26%,均低于碱性蛋白酶。因此,选择碱性蛋白酶为水溶性β-D-葡聚糖制备工艺优化的最适用酶。
2.2 单因素试验结果
2.2.1 浸提温度对水溶性β-D-葡聚糖提取的影响

图2 浸提温度对水溶性 β-D-葡聚糖得率的影响Fig.2 Effect of temperature on the yield of water-soluble β-D-glucan
由图2可知,浸提温度为60 ℃时,水溶性β-D-葡聚糖得率最大,为71.76%,所以选择60 ℃为制备水溶性β-D-葡聚糖的较佳温度。当温度小于或大于60 ℃时,都会使得率降低,这是由于温度较低,活化分子数较少,未达到酶促反应的最适温度,反应不充分;温度过高,会增加构成酶本身蛋白质结构的分子热能,增加多重弱非共价键相互作用破裂的机会,最终导致酶的变性,导致水溶性β-D-葡聚糖得率下降[23]。
2.2.2 浸提时间对水溶性β-D-葡聚糖提取的影响
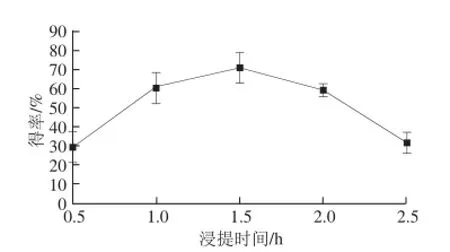
图3 浸提时间对水溶性 β- D-葡聚糖得率的影响Fig.3 Effect of extraction time on the yield of water-soluble β-D-glucan
由图3可知,浸提时间不同,水溶性β-D-葡聚糖得率也有所不同。当浸提时间为1.5 h时,水溶性β-D-葡聚糖得率最大,为71.01%,所以选择1.5 h为制备水溶性β-D-葡聚糖的较佳时间。当浸提时间小于1.5 h时,酶解过程不彻底,水溶性β-D-葡聚糖得率较低;若时间过长,会使葡聚糖降解,杂质相应的也被提取出来,也会导致得率降低[24]。
2.2.3 加酶量对水溶性β-D-葡聚糖提取的影响
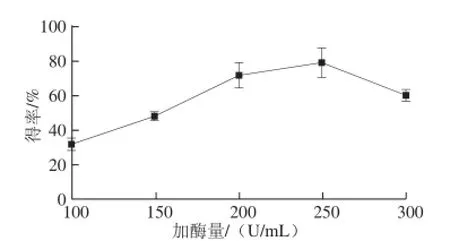
图4 加酶量对水溶性 β- D-葡聚糖得率的影响Fig.4 Effect of enzyme dosage on the yield of water-soluble β-D-glucan
由图4可知,随着加酶量的增加,水溶性β-D-葡聚糖得率呈现一个先上升后下降的趋势,在加酶量为250 U/mL时得率最大,为79.06%,因此选择250 U/mL为制备水溶性β-D-葡聚糖的较佳加酶量。当加酶量低于250 U/mL时,酶未能充分与底物接触并发挥水解作用,水解不彻底,导致得率降低[23];酶量过大,会大量作用于己经水解的葡聚糖,产生二糖、单糖等,从而导致水溶性β-D-葡聚糖得率降低。
2.2.4 pH值对水溶性β-D-葡聚糖提取的影响

图5 p H 值对水溶性 β-D-葡聚糖得率的影响Fig.5 Effect of pH on the yield of water-soluble β-D-glucan
由图5可知,不同pH值处理对水溶性β-D-葡聚糖的制备也有较明显影响。随着pH值的升高,水溶性β-D-葡聚糖得率增大,pH值达到7.5时得率最大,为79.06%。随后当pH值升高到8.0时,葡聚糖得率有轻微下降。究其原因是由于不同pH值处理会影响水解酶的活性,当pH值为7.5时,达到酶的最适pH值,水解效果最明显,而当pH值偏离最适pH值时,会对酶的空间结构造成破坏,使酶活降低。但由于所用碱性蛋白酶的最适pH值范围为7.0~8.0,因此,水溶性β-D-葡聚糖得率下降较少。
2.3 响应面试验结果
2.3.1 回归模型的确定

表2 Box-Behnken响应面试验结果Table 2 Results of Box-Behnken resp on se surfaceexperiments
利用Design-Expert 7.0软件对表2进行二次多项回归拟合试验和方差分析,反映浸提温度、浸提时间、加酶量和pH值对水溶性β-D-葡聚糖得率的影响,拟合所得多元二次回归方程如下:
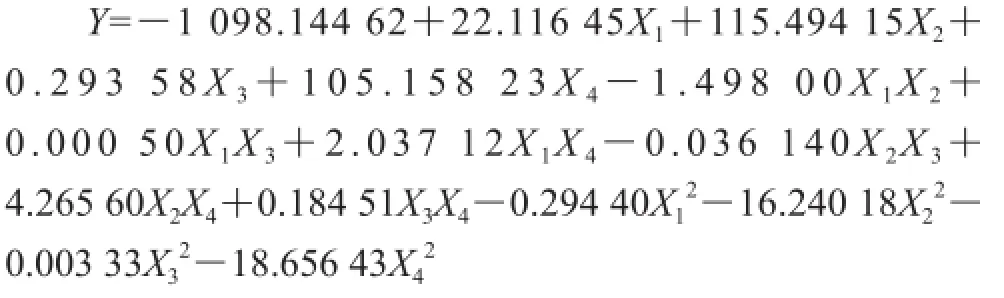
该方程决定系数R2=0.984 3,校正决定系数R=0.968 7,因此,可以充分描述独立变量对水溶性β-D-葡聚糖得率的影响。该模型回归方程P值小于0.000 1,模型极显著,模型拟合程度良好。
2.3.2 回归方程的方差分析
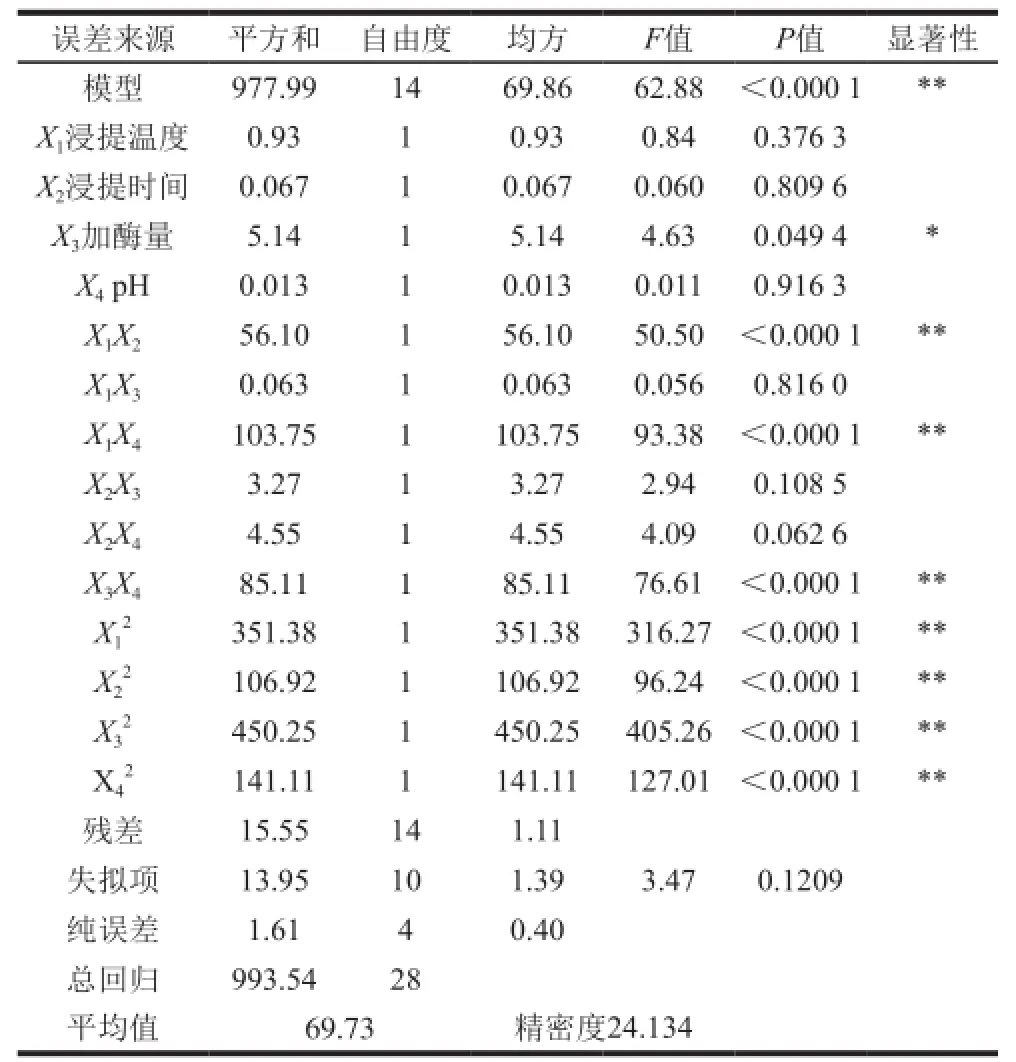
表3 回归方程各项的方差分析Table3 Analysis of variancef ora llthe terms of the regressi on e quati on
由表3可以看出,水溶性β-D-葡聚糖得率方程的一次项X3显著,二次项极显著,说明各具体因素对响应值的影响不是简单的线性关系。交互项X1X2、X1X4及X3X4极显著,说明X1和X2、X1和X4、X3和X4之间的交互作用很好,整个响应面基于各因素间的交互作用构成。另外,模型的变异系数为1.51%,证明回归方程拟合程度较好,说明试验具有很高的可信性和准确性。失拟项不显著,说明试验的误差很小。各因素的F值可以反映其对试验指标的重要性。F值越大,对试验指标的影响越大。从方差分析表可知各因素对水溶性β-D-葡聚糖得率的影响程度大小顺序为:加酶量>浸提温度>浸提时间>pH值。
2.3.3 各因素之间交互作用的响应面分析


图6 各因素交互作用对水溶性 β-D-葡聚糖得率影响的响应面Fig.6 Response surface plots showing the effect of temperature, time,enzyme dosage and pH on the yield of water-soluble β-D-glucan
由图6及回归方程方差分析可知,因素X1与X2、X1与X4、X3与X4交互作用显著,而X1与X3、X2与X3及X2与X4之间的交互作用不显著。
2.3.4 验证实验结果
由响应面和等高线图以及回归方程分析可知,制备水溶性葡萄酒泥酵母β-D-葡聚糖最佳工艺条件为:浸提温度59.82 ℃、浸提时间1.5 h、加酶量247.47 U/mL、pH 7.48。为检验响应面法所得结果的可靠性,采用上述优化提取条件制备水溶性β-D-葡聚糖,考虑到实际操作的便利,将提取工艺参数修正为浸提温度60 ℃、浸提时间1.5 h、加酶量247 U/mL、pH 7.5。按上述条件进行试验结果的验证,重复3次实际测得的水溶性β-D-葡聚糖得率分别为80.28%、81.12%、81.33%,平均得率为80.91%,与理论预测值(79.86%)相比,其相对误差约为1.31%。说明通过响应面优化得到的回归方程具有一定的实践指导意义。
2.4 分子质量测定结果
2.4.1 水溶性β-D-葡聚糖纯化
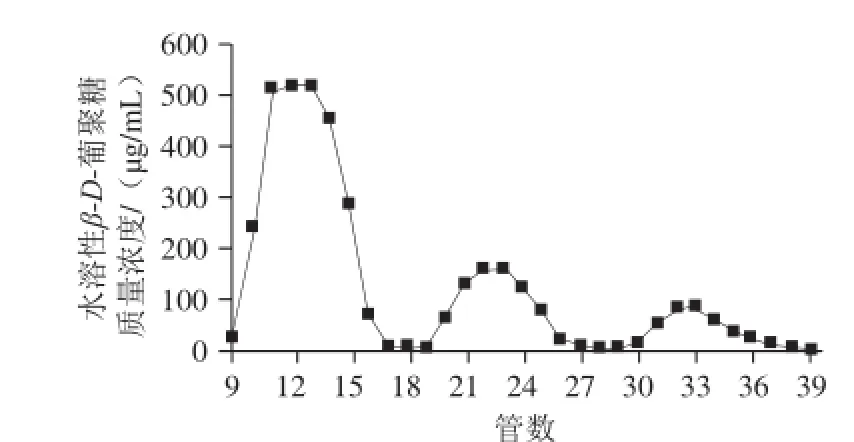
图7 水溶性 β-D-葡聚糖 S ep ha cry l S-400 HR柱凝胶层析洗脱曲线Fig.7 Elution curve of water-soluble β-D-glucan on Sephacryl S-400 HR column
由图7可知,不溶性β-D-葡聚糖经酶解后形成了片段不均一的水溶性糖成分,水解产物分为3类,分子质量较大的多糖组成的组分Ⅰ、分子质量较小的低聚糖组成的组分Ⅲ,以及分子质量介于两者之间的寡聚糖组成的组分Ⅱ。经蒽酮-硫酸法测定水溶性β-D-葡聚糖中各组分比例依次为组分Ⅰ 68.08%,组分Ⅱ13.97%,组分Ⅲ 8.79%。
2.4.2 分子质量计算结果
经Sephacryl S-400 HR凝胶层析,根据V/V0和标准品分子质量求得方程y=-0.632 7x+6.714 9,R²=0.991 7。以葡萄酒泥水溶性β-D-葡聚糖的洗脱体积V1/V0,最终得水溶性β-D-葡聚糖(组分Ⅰ)的分子质量为100 065.18 D。
2.5 水溶性β-D-葡聚糖体外抗氧化活性测定结果
2.5.1 水溶性β-D-葡聚糖对ABTS+·清除能力
由图8可知,水溶性β-D-葡聚糖清除ABTS+·能力存在质量浓度相关性。在0~4.1 mg/mL范围内清除率增加趋势较稳定;而VC在0~1.1 mg/mL范围内对其清除率迅速增加,1.1~4.1 mg/mL范围内增加趋势相当缓慢。当质量浓度达到4.1 mg/mL时,水溶性β-D-葡聚糖和VC 对ABTS+·清除率分别为73.16%、98.92%,EC50分别为2.035、0.467 mg/mL。
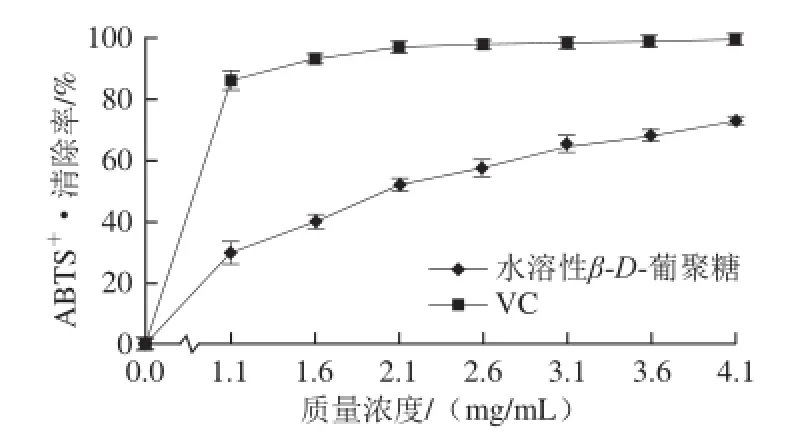
图8 水溶性 β- D-葡聚糖及 V C 对 A B TS +·的清除作用Fig.8 Scavenging effects of water-soluble β-D-glucan and VC against ABTS+·
2.5.2 水溶性β-D-葡聚糖对羟自由基清除能力
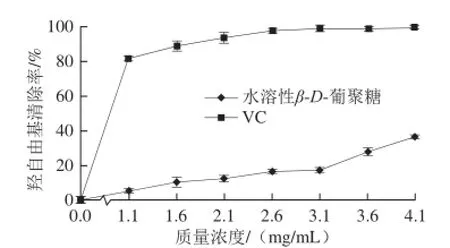
图9 水溶性 β-D-葡聚糖及 V C 对羟自由基的清除作用Fig.9 Scavenging effects of water-soluble β-D-glucan and VC against hydroxyl radical
由图9可知,水溶性β-D-葡聚糖具有一定的羟自由基清除能力,清除率随质量浓度的增加而增大。在0~3.1 mg/mL时,水溶性β-D-葡聚糖对羟自由基清除率增加缓慢,3.1~4.1 mg/mL范围内出现较明显的上升;而VC在0~1.1 mg/mL范围时,清除率增加明显,之后趋势变缓。当二者质量浓度达到4.1 mg/mL时,水溶性β-D-葡聚糖和VC对羟自由基清除率分别为36.49%、99.02%,EC50分别为6.352、0.603 mg/mL。
2.5.3 水溶性β-D-葡聚糖对DPPH自由基清除能力
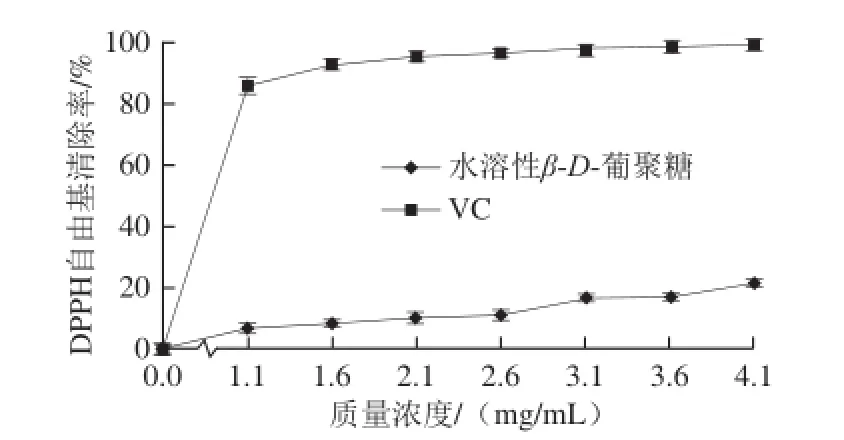
图10 水溶性 β- D-葡聚糖及 V C 对 D PP H自由基的清除作用Fig.10 Scavenging effects of water-soluble β-D-glucan and VC against DPPH radical
由图10可知,水溶性β-D-葡聚糖对DPPH自由基的清除能力在整个测试质量浓度范围内变化不明显。当质量浓度由1.1 mg/mL升高至4.1 mg/mL时,水溶性β-D-葡聚糖对DPPH自由基清除率由7.42%升高至21.51%,比阳性对照VC(98.89%)低77.38%。水溶性β-D-葡聚糖和VC清除DPPH自由基的EC50分别为16.773、0.440 mg/mL。

图11 水溶性 β-D-葡聚糖及 V C 对 O ¯·的清除作用2Fig.11 Scavenging effects of water-soluble β-D-glucan and VC against O
2.5.5 水溶性β-D-葡聚糖对Fe2+螯合能力
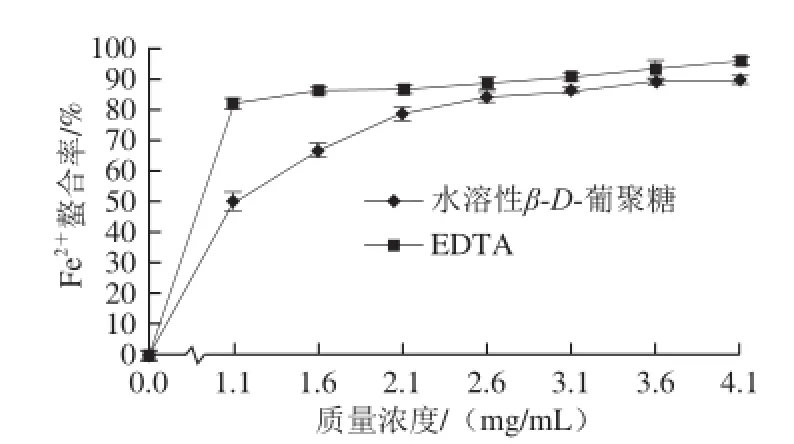
图12 水溶性 β-D-葡聚糖及 E D T A对 F e2+的螯合作用Fig.12 Fe2+ Chelating effects of water-soluble β-D-glucan and EDTA
由图12可知,水溶性β-D-葡聚糖具有较强的Fe2+螯合能力。当质量浓度达到4.1 mg/mL时,水溶性β-D-葡聚糖对Fe2+螯合率为89.85%,EDTA螯合率为95.61%,EC50分别为1.061、0.232 mg/mL。
3 结 论
以诱导自溶后的葡萄酒泥酵母细胞壁为试材,采用响应面分析法优化了酶解制备水溶性β-D-葡聚糖的提取工艺条件。结果显示,在酶解温度60 ℃、加酶量247 U/mL、pH 7.5的条件下酶解1.5 h制备得水溶性β-D-葡聚糖得率最大,达80.91%。经Sephacryl S-400 HR凝胶柱层析纯化后,水溶性β-D-葡聚糖中3 种组分比例依次为组分Ⅰ68.08%,组分Ⅱ 13.97%,组分Ⅲ 8.79%,其中组分Ⅰ分子质量为100 065.18 D。
体外抗氧化活性研究结果表明,水溶性β-D-葡聚糖对不同的自由基均有抗氧化作用。对清除ABTS+·、羟自由基、DPPH自由基、O·和螯合Fe2+的EC50分别为2.035、6.352、16.773、5.238 mg/mL和1.061 mg/mL,尤其对ABTS+·、O·的清除及螯合Fe2+作用尤为显著。因此,从葡萄酒泥酵母中制备纯化的水溶性β-D-葡聚糖是一种良好的天然抗氧化剂,可以应用于食品、化妆品等行业。
[1] 李莹, 苏婷婷, 王战勇.葡萄加工副产品的综合利用研究[J].中国农学通报, 2006, 17(4): 106-108.
[2] 郑鹤龄, 张斌, 潘洁, 等.葡萄酒泥农业应用效果研究[J].天津农业科学, 2006, 21(3): 47-48.
[3] 王淮, 唐治玉, 熊善柏.废啤酒酵母中β-1,3-D-葡聚糖的提取及成分分析[J].华中农业大学学报, 2006, 24(6): 626-629.DOI:10.13300/ j.cnki.hnlkxb.2005.06.021.
[4] 王静, 戴军, 陈尚卫, 等.提取酵母细胞壁中β-D-葡聚糖的新方法[J].食品与发酵工业, 2011, 37(1): 189-193.DOI:10.13995/ j.cnki.11-1802/ts.2011.01.043.
[5] LIMBERGER V M, FRANCISCO A D, CHAN A, et al.Barley β-glucans extraction and partial characterization[J].Food Chemistry,2014, 47(4): 84-89.
[6] LIU X Y, WANG Q, LIU H Z, et al.A new isolation method of β-D-glucans from spent yeast Saccharomyces cerevisiae[J].Food Hydrocolloids, 2008, 22(2): 239-247.
[7] BORCHANIA C, FONTEYNB F, JAMINB G, et al.Enzymatic process for the fractionation of baker's yeast cell wall (Saccharomyces cerevisiae)[J].Food Chemistry, 2014, 47(1): 108-113.
[8] 董兴叶, 孙楚, 刘瑶, 等.超声波法对燕麦β-葡聚糖提取及性质的影响[J].食品工业科技, 2014, 35(16): 294-297.DOI:10.13386/ j.issn1002-0306.2014.16.056.
[9] 王英杰, 苏理, 兰文忠, 等.水溶性β-1,3-葡聚糖制备及应用研究的进展[J].食品与药品, 2014, 23(2): 222-226.
[10] 黄国宏.酵母β-1,3-D-葡聚糖硫酸酯制备工艺的研究[J].食品工业科技, 2009, 30(8): 261-263.DOI:10.13386/ j.issn1002-0306.2009.08.009.
[11] 王庆华, 刘山, 崔炳权, 等.废弃酵母渣提取β-葡聚糖及其羧甲基化的研究[J].酿酒科技, 2009, 29(8): 120-122.DOI:10.13746/ j.njkj.2009.08.015.
[12] 张学况, 杜丽平, 王超, 等.酶解法增溶酵母(1→3)-β-D-葡聚糖的研究[J].食品与发酵工业, 2012, 38(7): 48-52.DOI:10.13995/ j.cnki.11-1802/ts.2012.07.012.
[13] 王成龙, 王英珍, 张健, 等.水溶性酵母葡聚糖的制备及应用研究进展[J].动物医学进展, 2010, 31(12): 128-131.
[14] 余奕珂, 白雪芳, 杜昱光.可溶性酵母葡聚糖的制备及其活性研究[J].中国生化药物杂志, 2010, 31(4): 254-257.
[15] 杨婷, 祝霞, 李颍, 等.葡萄酒泥酵母β-葡聚糖提取工艺条件优化[J].食品工业科技, 2015, 36(18): 286-289.DOI:10.13386/ j.issn1002-0306.2015.18.049.
[16] 许文涛, 张方方, 罗云波, 等.荞麦水溶性多糖的分离纯化及其分子质量的测定[J].食品科学, 2009, 30(14): 22-24.
[17] 张玉香, 尹卓荣.甘露糖蛋白的提纯及分子质量测定[J].酿酒科技,2005, 25(2): 72-74.DOI:10.13746/j.njkj.2005.04.027.
[18] 徐韧博.松塔多糖的分离纯化、结构鉴定及抗氧化活性研究[D].哈尔滨: 哈尔滨工业大学, 2013.
[19] WANG Y, YI L, HU Y.Optimization of polysaccharides extraction from Trametes robiniophila, and its antioxidant activities[J].Carbohydrate Polymers, 2014, 111(20): 324-332.
[20] MACHOVA E, BYSTRICKY S.Antioxidant capacities of mannans and glucans are related to their susceptibility of free radical degradation[J].International Journal of Biological Macromolecules,2013, 61(10): 308-311.
[21] YE C L, HU W L, DAI D H.Extraction of polysaccharides and the antioxidant activity from the seeds of Plantago asiatica L.[J].International Journal of Biological Macromolecules, 2011, 49(6): 466-470.
[22] LEE J, KOO N, MIN D B.Reactive oxygen species, aging, and antioxidativenutraceuticals[J].Comprehensive Reviews in Food Science and Food Safety, 2004, 42(3): 21-33.
[23] 晁正, 冉玉梅, 杨霞, 等.麦麸中低聚木糖的制备及抗氧化活性研究[J].核农学报, 2014, 21(4): 655-661.
[24] 马国刚, 王建中.超声波辅助提取青稞β-葡聚糖的工艺条件优化[J].食品科技, 2009, 34(11): 168-174.DOI:10.13684/j.cnki.spkj.2009.11.061.
Purification and Antioxidant Activities of Water-Soluble β-D-Glucan from Waste Wine Yeast
YANG Xueshan1,2, ZHU Xia2,3, LI Ying2,3, YANG Ting2,3, MA Tengzhen2,3, HAN Shunyu2,3
(1.College of Life Science and Technology, Gansu Agricultural University, Lanzhou 730070, China;2.Key Laboratory of Viticulture and Oenology, Gansu Province, Lanzhou 730070, China;3.College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
An enzymatic method was used to prepare water-soluble β-D-glucan from the autolyzed cell wall of waste wine yeast.Single factor method and response surface methodology were applied to optimize the extraction conditions.The watersoluble β-D-glucan was purified by Sephacryl S-400 HR gel column chromatography to investigate its antioxidant activities.The optimum conditions for β-D-glucan extraction were determined as follows: temperature, 60 ℃; enzyme dosage, 247 U/mL;pH, 7.5; and time, 1.5 h.Under these conditions, the yield of water-soluble β-D-glucan was 80.91%.Three components designated asⅠ, Ⅱ and Ⅲ were eluted from the chromatographic column, the contents of which were 68.08%, 13.97% and 8.79%, respectively.The relative molecular weight of componentⅠ was 100 065.18 D.Antioxidant activity studies showed that the purifed water-soluble β-D-glucan had good antioxidant activities with EC50values for scavenging, 2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate (ABTS+·), hydroxyl radical, 1,1-diphenyl-2-picrylhydrazyl radical (DPPH) radical and superoxide anion radical and chelating Fe2+of 2.035, 6.352, 16.773, 5.238 and 1.061 mg/mL, respectively.
wine yeast; water-soluble β-D-glucan; extraction and purification; antioxidant activities
10.7506/spkx1002-6630-201614005
TS261.9
A
1002-6630(2016)14-0024-08
杨学山, 祝霞, 李颍, 等.葡萄酒泥酵母制备水溶性β-D-葡聚糖工艺优化及其纯化后抗氧化性分析[J].食品科学, 2016,
37(14): 24-31.DOI:10.7506/spkx1002-6630-201614005. http://www.spkx.net.cn
YANG Xueshan, ZHU Xia, LI Ying, et al.Purification and antioxidant activities of water-soluble β-D-glucan from waste wine yeast[J].Food Science, 2016, 37(14): 24-31.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201614005. http://www.spkx.net.cn
2015-11-25
甘肃省农业生物技术研究与应用开发项目(GNSW-2013-21)
杨学山(1977—),男,副教授,硕士,研究方向为生物化学与生物产品开发。E-mail:yangxs@gsau.edu.cn
