葡萄糖酸亚铁固体脂质纳米粒的制备工艺研究
2016-08-06王琳琳童群义
王琳琳,童群义
(江南大学食品学院,江苏无锡 214122)
葡萄糖酸亚铁固体脂质纳米粒的制备工艺研究
王琳琳,童群义*
(江南大学食品学院,江苏无锡 214122)
摘要[目的]探索葡萄糖酸亚铁固体脂质纳米粒的制备方法。[方法]采用两步W/O/W乳化方式制备葡萄糖酸亚铁固体脂质纳米粒(SLN)。以包埋率为指标,研究内外相、油水相体积比,卵磷脂浓度对SLN包埋率的影响。[结果]试验确定当内相中水相与油相的体积比为0.2,外水相与内相乳状液的体积比为5∶1,卵磷脂浓度为5%时,SLN的包埋率取得最大值,为52.48%。在内水相引入海藻酸钠(1∶2,W/W)的结果表明,SLN的包埋率增大,为59.03%,粒径、Zeta电位和多分散系数发生变化。体外释放试验表明,SLN能起到保护葡萄糖酸亚铁经受胃酸环境的作用,并在模拟肠液中表现为突释的释放效果。[结论]固体脂质纳米粒对葡萄糖酸亚铁有较好的保护及释放效果,可为无机铁补充剂的生产提供新的技术手段。
关键词固体脂质纳米粒;葡萄糖酸亚铁;海藻酸钠
缺铁症,是常见的营养素缺乏症之一,是引起贫血的重要营养因素[1]。据预测,有20亿人口正面临贫血的危机,其中大部分是由于缺铁造成的[2]。缺铁会降低成人劳动能力,引起孕妇早产以及新生儿体重过低甚至死亡[3]。服用铁强化剂和铁补充剂是目前应对缺铁问题的主要手段[4]。
尽管亲水性亚铁盐具有生物利用性高和成本低的优点,但是当随食物摄入时,会刺激消化道,造成感官不适,严重的甚至引起恶心、腹痛[1]。另外,食品中的成分,诸如植酸和多酚,可以在消化道内结合铁离子并与之形成复合物,降低了无机铁盐的生物利用率,从而限制了亲水性无机铁盐的使用[5]。
固体脂质纳米体(solidlipidnanoparticle,SLN),是一种以酯类或类酯类作为载体的胶体运载系统,具有生物相容性和降解性好,毒性低,适用于在亲水性和亲油性成分的包埋和运输等特点,目前已应用在多肽、蛋白质、抗癌药物等物质的包埋。因此,将SLN技术应用于装载亚铁盐,可以避免药物的泄露,防止铁离子与食品中成分发生沉淀反应,起到保护铁离子的作用,并潜在提高亚铁离子的生物利用率。
葡萄糖酸亚铁是亲水性芯材,不易被SLN包载。近年来,以W/O/W两步乳化方法制备固体脂质纳米粒的技术,已成功用于包埋蛋白质等大分子物质[6]。鉴于此,笔者探索该法制备葡萄糖酸亚铁SLN的可能性,以硬脂酸作为固相,大豆软磷脂作为乳化剂,探究各工艺因素对SLN包埋率的影响,并考察在SLN内相中引用海藻酸钠对体系包埋率、粒径和Zeta电位的影响以及包埋体的体外释放情况。
1材料与方法
1.1材料
1.1.1主要原料及试剂。葡糖糖酸亚铁(FeG)、大豆卵磷脂、菲罗嗪、胃蛋白酶、胰蛋白酶、海藻酸钠(~ 250cps)、聚乙烯醇(分子量30 000~70 000),Sigma公司;乙醇,为分析纯试剂。
1.1.2主要仪器设备。细胞超声破碎仪,美国SONICS公司;恒温水浴锅,美国Fisher公司;超速离心机SorvallTMLYNX,美国ThermoScientific公司;动态散射纳米粒度分析仪,美国马尔文公司;酶标仪SynergyHT,美国biotek公司。
1.2方法
1.2.1固体脂质纳米粒的制备。将一定量大豆卵磷脂和50mg硬脂酸在60 ℃条件下溶于5mL乙醇中,加入浓度为5mg/mL的葡萄糖酸亚铁,浓度为10mg/mL的抗坏血酸,提前预热至相同温度的0.01mol/L盐酸溶液,超声乳化1min形成W/O型乳状液。将一定体积的同温度的1%聚乙烯醇溶液加入到乳状液中,相同超声间断处理2min,得到W/O/W乳状液。待冷却至室温,离心(20 644r/min,30min)处理乳状液,将得到的沉淀重新溶于5mL1%的聚乙烯醇溶液中,冰浴条件下,超声处理10min,得到固体脂质纳米粒混悬液(SLN)。将10mg/mL的海藻酸钠按不同质量比加入到内水相中,室温条件下搅拌混合2h后,用相同方法制备SA-SLN。
1.2.2包埋率的测定。采用菲罗嗪测定离心后的上清液中的铁离子浓度,间接测定铁离子含量,由下式计算包埋率:
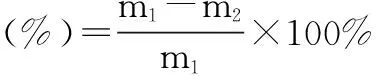
式中,m1为原料中葡萄糖酸亚铁的质量;m2为上清液中葡萄糖酸亚铁的质量。
铁离子标准曲线的制作:取10μL1mol/L标准氯化铁溶液用0.2mol/L盐酸稀释为1mmol/L,取出0、2、4、6、8和10μL置于 96孔板,用10%醋酸胺溶液(pH4.5)补充至100μL,加入10μL10%抗坏血酸溶液和40μL3mg/mL菲罗嗪显色剂,室温下放置30min后,用酶标仪在波长560nm下测定其吸光度A560 nm。以A560 nm值为纵坐标,铁离子摩尔浓度为横坐标绘制标准曲线(图1)。回归方程:y=0.087 3x+0.002 3,r=0.999 7;线性范围:0~10nmoL。

图1 铁离子摩尔浓度标准曲线Fig.1 Iron ion molar concentration standard curve
1.2.3粒径和Zeta电位的测定。采用粒径/Zeta分析仪测定粒径以及Zeta电位。 将1mL样品装入比色皿和Zeta电位比色皿。设定仪器参数:分散介质的折射指数为1.33,分散相折射指数为1.43,温度测定条件为25 ℃,散射角为173°。
1.2.4模拟释放试验。取一定体积的固态脂质纳米体与等体积模拟胃液或肠液混合,移入37 ℃、100r/min的恒温振荡水浴锅中释放,根据标准曲线测量设定时刻下铁离子的释放率。
模拟胃酸(pH2)由0.4% 氯化钠,0.5%胃蛋白酶和去离子水组成。模拟肠液(pH6.8)由6.8mg/mL磷酸二氢钠,5mg/mL胰蛋白酶和去离子水配制而成。
1.2.5数据统计与分析。文中数据为3次平行测定值的平均值。采用GraphPadPrism软件在0.05显著性水平下进行数据统计分析。
2结果与分析
2.1葡萄糖酸亚铁对SLN包埋率的影响由图2可以看出,SLN的包埋率随着葡萄糖酸亚铁的用量增加而降低。当葡萄糖酸亚铁用量为2.5mg时,SLN的包埋率为79.1%,而用量为5.0mg时,包埋率下降为52.47%,当亚铁盐用量继续增加时,包埋率降低。这与前人的研究具有相同结论[7-8],Zariwala等研究发现,铁用量与SLN的包埋率有负相关性,并推测造成此现象的原因可能是由于葡萄糖酸亚铁的强电解质属性影响了脂质囊体壁组成[7]。综合以上,选择葡萄糖酸亚铁的添加量为5.0mg。

图2 葡萄糖酸亚铁含量对SLN包埋率的影响Fig.2 The effect of ferrous gluconate content on the entrapment efficiency of SLN
2.2内相水相油相体积比对包埋率的影响由图3可以看出,随着内相水相与油相的比例增大,固体脂质纳米体对铁的包埋率先增大,在水相与油相体积比达到0.2时,包埋率取得最大值;当水相与油相体积比继续增大时,包埋率减小。这可能是由于油相体积不变,水相增大导致分散在水相外的油膜层变小,水相容易冲破油层而导致体系不稳定[10]。综合以上,选取内相中水相与油相的体积比为0.2。

图3 内相中水相与油相的体积比对固体脂质纳米体包埋率的影响Fig.3 Entrapment efficiency of SLN with different ratios(V/V)of aqueous and oil phase in internal phase
2.3外水相与内相乳状液的体积比对包埋率的影响由图4可以看出,随着外水相体积的增大,固体脂质纳米体对铁的包埋率逐渐增大,当外水相与内相乳状液的体积比大于5∶1时,包埋率基本稳定。这可能由于当外相水相体积逐渐增大时,被分散的内相乳滴相互之间碰撞的机会减少,稳定性提高。所以,选取5∶1作为外水相与内相乳状液的体积比。

图4 外水相与内相乳状液的体积比对固体脂质纳米体包埋率的影响Fig.4 Entrapment efficiency of SLN with different volume ratio of aqueous phase of external phase to W/O emulsion of internal phase
2.4大豆卵磷脂含量对包埋率的影响磷脂,尤其大豆卵磷脂,广泛用作有效成分和药物的塑形剂[6]。因其具有两亲分子特性和较好的生理兼容性,常被用于SLN的制备中。由图5可以看出,随着卵磷脂用量的上升,包埋率逐渐并且显著增加。当达到3.5%时,包埋率缓慢增大。这可能是由于芯材表面的乳化层已有效地稳定了内相液滴的结构,乳化层增厚带来的效果逐渐不显著。
2.5大豆卵磷脂含量对粒径和多分散系数的影响由图6可以看出,卵磷脂浓度增加,固体脂质纳米体的粒径逐渐减小,这是因为随着乳化剂用量的增加,乳滴表面聚集的乳化层增加,降低了油水界面间的表面张力,提高了稳定性。同时,分散系数减小,说明体系中的粒子形态更均匀。综合图5的结果,选择卵磷脂浓度5%为最佳条件。
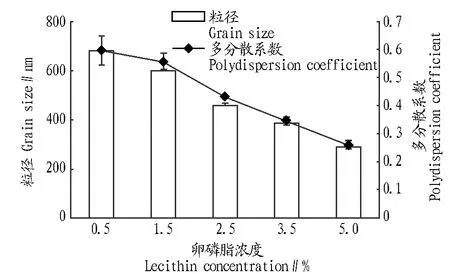
图6 卵磷脂浓度对固体脂质纳米体粒径和多分散系数的影响Fig.6 The influence of lecithin concentration on the size and PDI of SLN
2.6海藻酸钠的引入对SLN包埋率的影响海藻酸钠,是一类多糖大分子,其溶液中带有大量阴离子。当海藻酸钠分子与亚铁离子混合后形成海藻酸钠与亚铁的络合物,引入固体脂质纳米粒时,可能会影响亚铁的包埋率及SLN的性质。
由图7可以看出,海藻酸钠的引入对SLN的包埋率产生了显著的影响。随着海藻酸钠用量的增加,SLN对葡萄糖酸亚铁的包埋率减小;当海藻酸钠与葡萄糖酸亚铁的质量比为1∶2和1∶1时,SA-SLN的包埋率高于对照组,而当比值为2∶1时,包埋率明显低于对照组。造成此现象的原因可能是海藻酸钠分子中的羧基基团使其带有大量负电荷,通过静电作用与带正电荷的二价铁离子发生交联[11],二价铁离子分布在海藻酸钠分子链上,同时海藻酸钠的线性网络结构阻止了内水相液滴的聚集,维持了体系的稳定,提高了固体纳米体对Fe2+的包埋率。但是,当铁离子浓度一定,多糖分子浓度增大,海藻酸钠作为多糖大分子,对铁离子的空间阻碍作用增大,并与二价铁离子争夺乳化剂的亲水端,破坏了乳状液的稳定性,导致包埋率降低。

图7 SA-SLN在不同海藻酸钠与葡萄糖酸亚铁的质量比下的包埋率Fig.7 Entrapment efficiency of SA-SLN with different ratios(W/W)to ferrous gluconate
2.7海藻酸钠对SLN粒径、Zeta电位以及多分散系数的影响表1显示,海藻酸钠的加入对固体纳米粒的粒径、Zeta电位以及多分散系数产生显著影响。随着海藻酸钠与葡萄糖酸亚铁的质量比增大,粒径明显增大,多分散系数显示粒径分布混乱不均一。这是由多糖大分子海藻酸钠以及与二价铁离子形成的络合物造成的空间体积增大的缘故。Zeta电位表现为随着海藻酸钠浓度的增大而降低,原因是海藻酸钠带有大量阴离子,一部分大分子裸露在外表面而引起表面电位的降低。添加海藻酸钠的固体脂质纳米粒的Zeta电位值大于-30mV,而对照组为-22.27mV,说明引入海藻酸钠使得粒子间排斥力强于对照组,预示着体系更加稳定。
2.8SLN和SA-SLN的体外释放在模拟胃液释放试验中,由于样品的流体性质,SLN悬浊液在胃液环境停留的时间短,故采用30min作为释放时间[12]。经研究发现,SLN在pH2的模拟胃液环境下释放3.79%的芯材铁,SA-SLN在相同条件下释放3.43%,低于未加海藻酸钠的SLN,说明SLN在低pH的胃酸环境下稳定,且有效保护芯材,防止泄漏。
图8的结果显示,SLN和SA-SLN在模拟肠液中呈现出快速释放的现象,并且在30min的释放时间之后缓慢释放。此现象的原因可能是,在释放介质环境下,附在固脂粒表层的二价铁离子逐渐释放出来。与SLN在30min释放18.57%药物相比,SA-SLN呈现出更高的释放率,为22.32%,推测原因为当SLN在释放时,由于聚合物的参与,聚合物在颗粒表面逐渐舒展溶解,形成通路,Fe2+与外界介质的接触增大,释放率提高,从而为固体脂质纳米粒在无机铁离子吸收部位释放提供了可能性。

表1 SLN的物理化学特征

图8 SLN 和SA-SLN在模拟肠液中的释放Fig.8 Release of SLN and SA-SLN in simulated intestinal fluid
3结论
该试验运用W/O/W乳化法成功制备了葡萄糖酸亚铁固体脂质纳米粒,并考察了内外相、油水相体积比以及卵磷脂浓度对SLN包埋率的影响,确定当内相中水相与油相的体积比为0.2,外水相与内相乳状液的体积比为5∶1,卵磷脂浓度为5%时,SLN的包埋率取得最大,为52.48%。海藻酸钠的引入,由于与二价铁离子发生静电作用,对SLN的包埋率、粒径及Zeta电位产生了影响。当海藻酸钠与葡萄糖酸亚铁的质量比为1∶2时,SLN的包埋率取得最大,为59.03%,优于对照组。释放试验结果显示,SLN在模拟胃液中可以保护药物,并且在模拟肠液介质中实现释放。综上,固体脂质纳米体作为新型药物传递释放系统,为无机亚铁的包埋提供了新的技术手段。
参考文献
[1]BURCHUMJ,ROSENTHALL.Lehne’spharmacologyfornursingcare[M].Elsevier-HealthSciencesDivision,2015.
[2]WorldHealthOrganization.Micronutrientdeficiencies[EB/OL].(2014)[2016-04-01].http://www.who.int/nutrition/topics/ida/en/.
[3]BRABINBJ,PREMJIZ,VERHOEFFF.AnanalysisofAnemiaandchildmortality[J].Journalofnutrition,2001,131(2):636-645.
[4]ZIMMEIMANMB,HURRELLRF.Nutritionalirondeficiency[J].Lancet,2007,370(9586):511-520.
[5]HURRELLR.Howtoensureadequateironabsorptionfromiron-fortifiedfood[J].Nutritionreviews,2002,60(7):7-15.
[6]FRICKERG,KROMPT,WENDELA,etal.Phospholipidsandlipid-basedformulationsinoraldrugdelivery[J].Pharmaceuticalresearch,2010,27(8):1469-1486.
[7]ZARIWALAMG,ELSAIDN,JACKSONTL,etal.Anovelapproachtooralirondeliveryusingferroussulphateloadedsolidlipidnanoparticles[J].Internationaljournalofpharmaceutics,2013,456(2):400-407.
[8]XIASQ,XUSY.Ferroussulfateliposomes:Preparation,stabilityandapplicationinfluidmilk[J].Foodresearchinternational,2005,38(3):289-296.
[9]MEHNERTW,MADERK.Solidlipidnanoparticlesproduction,characterizationandapplications[J].Advanceddrugdeliveryreviews,2012,64:83-101.
[10] 王传好,曹光群,孙谦.W/O/W型多重乳状液的制备及应用概述 [J].日用化学工业,1991,3(8):23-32.
[11]XINYJ,BLIGHMW,KINSELAAS,etal.Effectofirononmembranefoulingbyalginateintheabsenceandpresenceofcalcium[J].Journalofmembranescience,2016,497:289-299.
[12]LINHC,PRATHERC,FISHERRS,etal.Measurementofgastrointestinaltransit[J].Digestivediseasesandsciences,2005,50(6):989-1004.
[13]MUKHIJAK,SINGHALK,ANGMOS,etal.Potentialofalginateencapsulatedferricsaccharatemicroemulsionstoameliorateirondeficiencyinmice[J].Biologicaltraceelementresearch,2016,172(1):179-192.
作者简介王琳琳(1992-),女,北京人,硕士研究生,研究方向:食品资源与利用。*通讯作者,教授,博士,从事碳水化合物资源与利用研究。
收稿日期2016-04-22
中图分类号TS 201.1
文献标识码A
文章编号0517-6611(2016)16-090-04
StudyonPreparationTechniqueofFerrousGluconate-LoadedSolidLipidNanoparticles
WANGLin-lin,TONGQun-yi*
(FoodScienceSchool,JiangnanUniversity,Wuxi,Jiangsu214122)
Abstract[Objective] The aim was to explore preparation method of ferrous gluconate-loaded solid lipid nanoparticles. [Method] The ferrous gluconate solid lipid nanoparticles (SLN) was prepared by W/O/W double emulsion techniques. The influences of volume ratio of outer/ inner phase, aqueous/oil phase of internal phase and concentration of lecithin applied as the surfactant on the entrapment efficiency of SLN were investigated. [Result] The maximal entrapment efficiency, 52.48%, was obtained under the circumstances of 0.2 as the aqueous/oil phase of internal phase, 5∶1 as the volume ratio of outer/ inner phase, and 5% as concentration of lecithin. The addition of sodium alginate with weight ratio of 1∶2 to ferrous gluconate posed a positively impact on the entrapment efficiency, which was 59.03% and affected the size, Zeta potential and polydispersion index as well. The in vitro release profile showed that SLN could keep integrity in simulated gastric fluid and went through a burst release in simulated intestinal fluid. [Conclusion] SLN could protect the drug from disintegration and release in the active site and be a new method to produce inorganic iron salts supplementation.
Key wordsSolid lipid nanoparticle (SLN); Ferrous gluconate; Sodium alginate
