纤维素酶与表面活性剂的相互作用及其在洗涤剂中的应用
2016-08-06于跃,张剑
于 跃,张 剑
纤维素酶与表面活性剂的相互作用及其在洗涤剂中的应用
于跃,张剑
(山西大学化学化工学院,山西 太原 030006)
摘要:研究了表面活性剂对纤维素酶活力的影响,并通过动态光散射(DLS)、荧光光谱及傅里叶变换衰减全反射红外光谱(ATR-FTIR)探讨了表面活性剂和纤维素酶的相互作用机理。DLS实验结果显示,阴离子表面活性剂吸附到了纤维素酶表面,使得阴离子表面活性剂-纤维素酶体系中的zeta电位分布在较低的负电荷区域;而非离子表面活性剂-纤维素酶与蒸馏水-纤维素酶体系中的zeta电位的分布没有明显的区别。荧光和ATR-FTIR实验说明了阴离子表面活性剂对纤维素酶的二级结构和侧链的微环境都有很大的影响。此外,对比了添加与未添加纤维素酶的洗衣液对国标污布JB-03的去污力,通过光学显微镜及扫描电镜(SEM)观察国标污布洗涤前后织物表面,发现将纤维素酶添加到洗衣液能明显提高洗衣液的去污能力。
关键词:纤维素酶;表面活性剂;动态光散射;荧光光谱;ATR-FTIR;去污力
引 言
纤维素酶是将纤维素水解成纤维二糖和葡萄糖的一组复杂酶系的总称,又可称纤维素酶系[1]。纤维素酶能通过3种酶的协同作用[2],将纤维素有效水解成葡萄糖,这3种酶分别是内切葡聚糖酶、外切葡聚糖酶和 β-葡萄糖苷酶[3]。纤维素酶常应用于纺织、动物饲料、污水处理、酿造等行业[4-5]。
纤维素酶去污机理不同于蛋白酶和淀粉酶的去污机理,纤维素酶用于洗涤时,作用在棉纤维上,能将污垢剥落下来,同时纤维素酶能扩大织物纤维中的空穴和毛细管,赋予织物一系列有价值的服用性能,如轻薄感、手感柔软、吸水性好、抗起球等[6]。随着人们对天然制品的重新重视,纯棉制品越来越受到消费者的欢迎,而且人们也越来越重视环境保护,因此,将纤维素酶应用到棉织物的洗涤中得到了越来越多的关注。
表面活性剂是洗涤剂中主要的成分,素有“工业味精”之称,它是指具有固定的亲水亲油基团,能在溶液表面定向排列并能使溶液表面张力显著下降的一类物质[7]。表面活性剂和纤维素酶都对污垢有清理效用,两者配合使用能更好地去除污物,并且减少表面活性剂的使用比例,进而减轻环境污染。目前,国内外关于纤维素酶的去污机理[8-9]及其在洗涤中的应用[10-11]研究较多,也有一些研究[12-13]报道了表面活性剂对纤维素酶水解的影响;对表面活性剂与纤维素酶的作用机理也进行了推测,但是很少有报道用相应的表征手段对该机理给出合理的解释。本文选择了8种表面活性剂,对纤维素酶活力的影响进行研究,并采用DLS、荧光光谱及红外光谱对表面活性剂和纤维素酶之间的作用机理给出可能的解释,以期为纤维素酶在液体洗涤剂中应用提供参考依据。
1 实验材料与方法
1.1 材料
试剂:3,5-二硝基水杨酸,天津市光复精细化工研究所;酒石酸钾钠,天津市光复科技发展有限公司;无水亚硫酸钠,天津市北辰方正试剂厂;无水葡萄糖,天津市光复精细化工研究所;羧甲基纤维素钠(CMC),天津市光复精细化工研究所;纤维素酶,山西勇宁记科技有限公司;氢氧化钠,北京化工厂。以上均用分析纯试剂。
表面活性剂:十二烷基苯磺酸钠(LAS),Sigma公司;十二烷基磺酸钠(LS),天津市大茂化学试剂厂;脂肪醇聚氧乙烯醚硫酸钠(AES),宁波门萨化工有限公司;脂肪醇聚氧乙烯醚(AEO),益海嘉里有限公司。
国标污布JB-03(皮脂污布),标准配方洗衣液,均为中国日用化学工业研究院产品。市售洗衣液,购买于沃尔玛超市。
1.2 仪器
DHG-9140电热鼓风干燥箱,上海齐欣科学仪器有限公司;84-1A磁力搅拌器,上海司乐仪器有限公司;UV-2602型紫外分光光度计,尤尼柯(上海)仪器有限公司;Zetasizer Nano-ZS激光粒度仪,英国马尔文仪器有限公司;F-4500型荧光光度计,日本日立公司;Nicolet Nexus FTIR傅里叶红外光谱仪,美国Nicolet公司;WSD-3C全自动白度仪,北京康光光学仪器有限公司;RHLQⅡ型立式去污机,中国日用化学工业研究院;XSP-8CA型光学显微镜,上海光学仪器厂;日立TM3000台式电子显微镜(SEM),日本株式会社日立制作所。
1.3 测试
1.3.1 酶活力 取4支试管各加入0.5 ml CMC底物,与待测酶液一起在50℃水浴下加热5 min;在第1~3试管中各加入0.5 ml待测液,并在50℃水浴中反应15 min;反应完毕后在4支试管中各加入DNS试剂1.5 ml,并在第4支试管中补加0.5 ml的待测酶液;取出并摇匀4支试管后在沸水浴中反应5 min;取出迅速冷却至室温,用水定容至5.0 ml,以第4支试管试液为对照,在530 nm波长条件下测量第1~3试管的吸光度后计算酶活力。酶活力计算公式如下:

式中,A为吸光度值;n为酶液的稀释倍数;V为加入反应的待测酶液量,ml;t为待测液与底物的反应时间,min。
1.3.2 zeta电位 动态光散射仪器采用Malvern公司的Zetasizer Nano ZS设备,光源是氦氖气体激光(λ=633 nm),探测角为90°。用蒸馏水配制质量分数为1%的纤维素酶,测其zeta电位;质量分数均为1%表面活性剂与纤维素酶混合反应1 h后,测纤维素酶的zeta电位分布。取1 ml待测液注入到zeta电位毛细管样品池,恒定样品温度为25℃,每个样品的zeta电位由该样品测量3次平均而得。
1.3.3 荧光光谱 分别配制质量分数为 1%的表面活性剂10 ml,再向其中添加0.1 g的纤维素酶,室温下,置于磁力搅拌器上反应1 h后,利用荧光分光光度计,固定激发波长280 nm,激发狭缝10 nm,发射狭缝10 nm,激发光谱采用间隔0.2 nm,反射光谱采用间隔1 nm,响应时间0.1 s,室温下扫描300~420 nm。
1.3.4 傅里叶变换衰减全反射红外光谱(ATRFTIR) 配制表面活性剂与纤维素酶混合液,其中表面活性剂及纤维素酶质量分数均为 1%。取适量放在表面皿上,40℃干燥成膜,并在干燥器中保存1 d待测。傅里叶变换衰减全反射红外光谱仪测试参数:扫描次数64次,分辨率为4 cm-1,波数范围900~3500 cm-1。
1.3.5 白度测定 在室温条件下,采用型号为WSD-3C的全自动白度仪对实验污布进行白度值测定。测定时,对每块布的正反面各测1次,取平均值。以三刺激值中的蓝值表示白度。在一定条件下,白度值越高,表明去污力越强。
1.3.6 光学显微镜 采用 XSP-8CA 型光学显微镜观测国标污布JB-03在洗涤前后的纤维特征,用黄色滤光片,通过连接在显微镜上的图像采集装置采集,然后放大倍数设定标尺,本实验采用的放大倍数为10倍。
1.3.7 SEM 测试 在 15 kV电压下,采用日立TM3000台式电子显微镜测定国标污布JB-03洗涤前后的表观形貌。
1.4 洗涤实验
立式去污机转速120 r·min-1,洗涤20 min,洗涤温度30℃,水的硬度250 mg·kg-1(以CaCO3计,配制方法同GB/T 13174—2008);洗衣液的质量浓度为2 g·L-1,洗涤液体积为1 L。污布种类:国标污布JB-03(皮脂污布)。去污测试时,每块污布裁成直径6 cm的圆片,所有被测污布均放入同一缸中测定,每缸4片。比较污布洗涤前后的白度差值,得到洗涤剂的去污效果。

图1 阴离子表面活性剂对纤维素酶活力的影响Fig.1 Effect of anionic surfactants on cellulase activity
2 结果与讨论
2.1 阴离子表面活性剂对纤维素酶的影响
2.1.1 阴离子表面活性剂对纤维素酶活力的影响分别配制质量分数为1%的阴离子表面活性剂LAS、LS、带有不同EO链的AES(2EO)和AES(3EO)的溶液,研究该浓度的阴离子表面活性剂对质量分数为 1%的纤维素酶活力的影响。将纤维素酶和表面活性剂溶液放在磁力搅拌器上反应,每隔1 h测一次酶活,实验结果如图1所示。
由图可知,4种阴离子表面活性剂对纤维素酶活力都有很大影响,在反应1 h后,纤维素酶剩余酶活力均不足60%。4种阴离子表面活性剂对纤维素酶失活影响顺序是:LAS>LS>AES(3EO)>AES(2EO)。从结构上看,LAS比LS多一个苯环,却对纤维素酶有更强的失活作用。这一现象可能是由于芳香环的磺化,提高了LAS的两亲性[14],使得LAS表现出优于其他表面活性剂的表面活性。
氧原子电负性大于碳和硫原子,氧硫键中成键电子对偏移向氧原子,因此AES钠盐分子中负电基团所带电荷分布比LAS和LS分子要更加分散,其与金属离子形成的化学键极性较小。所以,AES在水溶液中电离度小于LAS和LS,其对酶活性中心附近电荷影响较小[15]。
而对于不同EO链的AES,高EO的AES水合作用更强[16],故 AES(3EO)在水中有更强的电离程度,所以AES(3EO)对纤维素酶的失活影响更大。2.1.2 阴离子表面活性剂对纤维素酶zeta电位的影响 质量分数均为 1%的阴离子表面活性剂与纤维素酶混合反应1 h后,测纤维素酶的zeta电位分布,如图2所示。

图2 纤维素酶在阴离子表面活性剂影响下的zeta电位图Fig.2 Zeta potential distributions of cellulase in solutions of four anionic surfactants
由图可知,蒸馏水-纤维素酶体系的zeta电位分布在-10~10 mV之间,而在LAS-纤维素酶、LS-纤维素酶、AES(3EO)-纤维素酶和 AES(2EO)-纤维素酶体系中,zeta电位分别分布在-108~54、-94~-28、-57~8和-49~14 mV。加入阴离子表面活性剂后,纤维素酶的zeta电位分布在较低的负电荷区域,这是由于阴离子表面活性剂中带有电离度较大的磺酸基团,使阴离子表面活性剂吸附到了纤维素酶表面[17-18],从而导致了纤维素酶的结构发生改变。
2.1.3 阴离子表面活性剂对纤维素酶荧光光谱的影响 质量分数均为 1%的纤维素酶及阴离子表面活性剂LAS、LS和AES作用1 h后的纤维素酶的荧光谱图,如图3所示。

图3 阴离子表面活性剂对纤维素酶荧光光谱的影响Fig.3 Fluorescence spectrum of cellulase in solutions of four anionic surfactants1—LAS+cellulase; 2—LS+cellulase; 3—AES(2EO)+cellulase;4—AES(2EO)+cellulase; 5—deionized water +cellulase
图3是在280 nm的波长下对纤维素酶进行荧光激发,得到的主要是蛋白质内部的色氨酸、酪氨酸的光谱图[19-21]。如图所示,在不同阴离子表面活性剂的影响下,纤维素酶的荧光强度和最大发射波长均不同。蒸馏水-纤维素酶体系中纤维素酶的最大发射波长在338 nm处,而LAS-纤维素酶、LS-纤维素酶、AES(2EO)-纤维素酶和AES(3EO)-纤维素酶体系中,纤维素酶最大发射波长分别为333、334、336和337 nm,发生了蓝移,且荧光强度有所增强。
在纤维素酶中加入阴离子表面活性剂后,其最大发射波长发生了蓝移,说明在阴离子表面活性剂的影响下,纤维素酶发色基团的疏水性增强,非极性的色氨酸更加倾向于分布在纤维素酶的疏水部位,导致了纤维素酶原有的有序结构遭到破坏,从而影响了纤维素酶的酶活力[22-23]。在阴离子表面活性剂的作用下,纤维素酶的荧光强度增强,这是由于表面活性剂与纤维素酶之间静电引力的存在,导致纤维素酶分子结构展开[24-26],使得隐藏在纤维素酶分子内的色氨酸、酪氨酸等发色基团更多地暴露在溶剂中。
荧光实验表明,阴离子表面活性剂使纤维素酶中色氨酸和酪氨酸所处的微环境发生了变化,这些变化导致了纤维素酶结构的变化,从而对纤维素酶的活性产生了影响。其中,纤维素酶在LAS的影响下,其蓝移波数最大,荧光强度增强也最多,这与LAS对纤维素酶酶活力影响最大这一实验结果一致。
2.1.4 阴离子表面活性剂对纤维素酶ATR-FTIR光谱的影响 质量分数均为 1%的纤维素酶及阴离子表面活性剂LAS、LS和AES作用1 h后的纤维素酶的红外谱图,如图4所示。

图4 阴离子表面活性剂对纤维素酶ATR-FTIR光谱的影响Fig.4 ATR-FTIR spectrum of cellulase in solutions of four anionic surfactants1— cellulase; 2—LAS +cellulase; 3—LS +cellulase; 4—AES(2EO) +cellulase; 5—AES(3EO)+cellulase
如图所示,1409 cm-1处反映的是纤维素酶结构中的CH3基团;1303和1235 cm-1处反映的是酰胺Ⅲ带的α螺旋和β折叠结构,在阴离子表面活性剂作用后,1409、1303、1235、cm-1处的红外吸收峰均发生了变化(表1)。
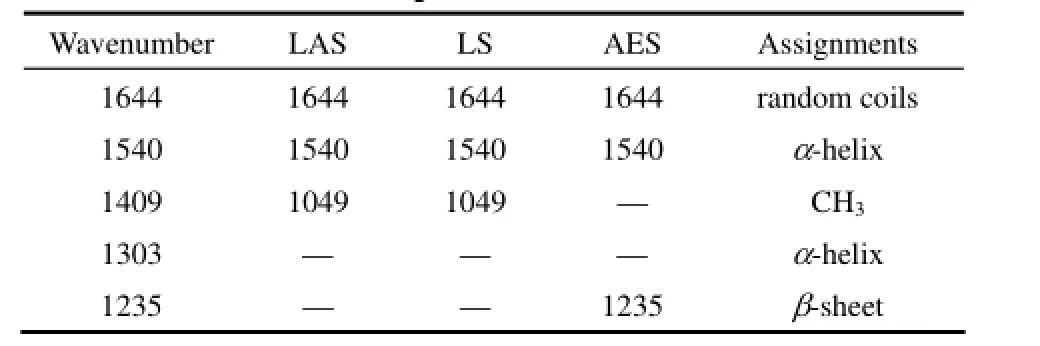
表1 在阴离子表面活性剂影响下纤维素酶ATR-FTIR光谱的特征峰归属[27]Table 1 Characteristic peaks of cellulase influenced by anionic surfactants and its assignments in ATR-FTIR spectrum[27]
经LAS和LS作用后,1303和1235 cm-1处峰消失,这些现象说明在LAS和LS的影响下,纤维素酶的主链构象中的α螺旋、β折叠结构遭到了破坏。在AES的影响下,1409 cm-1处CH3基团振动峰和1303 cm-1的α螺旋峰消失,说明AES引起了纤维素酶二级构象的变化。
2.2 非离子表面活性剂对纤维素酶的影响
2.2.1非离子表面活性剂对纤维素酶活力的影响分别配制质量分数为1%的不同EO链的非离子表面活性剂AEO2、AEO3、AEO7和AEO9的溶液,研究该浓度的AEO对质量分数为1%的纤维素酶活力的影响。将纤维素酶和表面活性剂溶液放在磁力搅拌器上反应,每隔1 h测一次酶活,实验结果如图5所示。
由图可知,比起阴离子表面活性剂,AEO对纤维素酶活力的抑制作用并不明显,纤维素酶活力均保持在90%以上。可能的原因:非离子表面活性剂在水溶液中只有疏水力,不产生静电斥力,大部分对酶的三维结构不干预,酶的构象改变很小,因此对纤维素酶活力影响不大[28]。
从图还可看出,不同EO链的AEO对纤维素酶活性影响稍有不同,这与不同EO链的AEO在水中的溶解度有关,高EO链的AEO9在水中的溶解度较大[29],在水中更易于纤维素酶发生作用,故AEO9在水中表现为对纤维素酶有更强的作用。
2.2.2 非离子表面活性剂对纤维素酶zeta电位的影响 质量分数均为1%非离子表面活性剂AEO与纤维素酶混合反应1 h后,测纤维素酶的zeta电位分布,如图6所示。
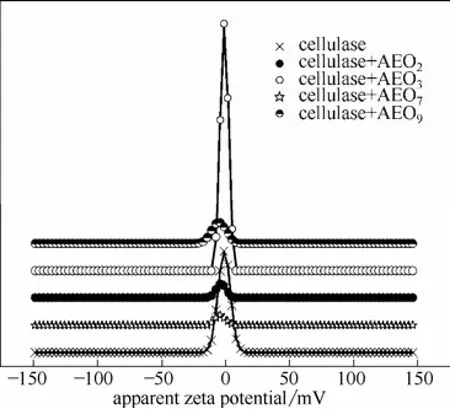
图6 纤维素酶在非离子表面活性剂影响下的zeta电位图Fig.6 Zeta potential distributions of cellulase in solutions of four nonionic surfactants
由图可知,蒸馏水-纤维素酶体系zeta电位分布在-10~10 mV之间,AEO2-纤维素酶、AEO3-纤维素酶、AEO7-纤维素酶和 AEO9-纤维素酶体系中,zeta电位分别分布在-11~8、-10~8、-13~7和-17~8 mV。由此可知,AEO对纤维素酶的电位分布影响很小,该实验结果与文献[30]中所报道的AEO在水溶液中不以离子形式存在,通过氢键与纤维素酶作用,而这种氢键作用对纤维素酶影响很小的结论相符。

图7 非离子表面活性剂对纤维素酶荧光光谱的影响Fig.7 Fluorescence spectrum of cellulase in solutions of four nonionic surfactants1—AEO2+cellulase; 2—AEO3+cellulase; 3—AEO7+cellulase;4—AEO9+cellulase; 5—deionized water +cellulase
2.2.3 非离子表面活性剂对纤维素酶荧光光谱的影响 如图7所示,与蒸馏水-纤维素酶体系中纤维素酶的荧光光谱相比,AEO2-纤维素酶和 AEO3-纤维素酶体系中,纤维素酶的荧光峰的位置和强度变化很小,由此可知,AEO2和AEO3对纤维素酶结构的影响较小。在AEO7-纤维素酶和AEO9-纤维素酶体系中,纤维素酶的荧光峰的位置没有发生变化,但荧光强度略有增强,这一现象说明AEO7和AEO9使得纤维素酶分子内的色氨酸、酪氨酸等发色基团更多暴露在溶剂中,从而纤维素酶的荧光强度增强。2.2.4 非离子表面活性剂对纤维素酶ATR-FTIR光谱的影响 质量分数均为1%的纤维素酶和AEO作用1 h后的纤维素酶的红外谱图,如图8所示。

图8 非离子表面活性剂对纤维素酶ATR-FTIR光谱的影响Fig.8 ATR-FTIR spectrum of cellulase in solutions of AEO91—cellulase; 2—AEO2+cellulase; 3—AEO3+cellulase; 4—AEO7+cellulase;5—AEO9+cellulase
由图可知,AEO作用后的纤维素酶和原纤维素酶的红外谱图大致相同,说明 AEO对纤维素酶构象没有产生影响。在1350 cm-1[31]处CH2伸缩振动峰强度明显增强,这是由AEO结构中的CH2显现出来的红外吸收峰所致。
3 纤维素酶在混合表面活性剂体系中的性能测试
3.1 混合表面活性剂对纤维素酶活力的影响
通常洗涤剂中的表面活性剂是由非离子表面活性剂和阴离子表面活性剂组成。由以上实验可知,本实验所用的阴离子表面活性剂中AES(2EO)和非离子表面活性剂AEO2对纤维素酶活力的影响较小,笔者进一步考察AES(2EO)/AEO2两种表面活性剂复配后对纤维素酶活力的影响。国内外报道[32-33]其配比为(1:4)~(4:1)。将这两种表面活性剂按不同的比例混合,控制表面活性剂总浓度为1%,如图9所示。
由图可知,添加了非离子表面活性剂AEO2后,能改善AES(2EO)与纤维素酶的兼容性,但AES (2EO)/AEO2低配比时,AES(2EO)与纤维素酶的兼容性还不尽如人意,随着 AES(2EO)/AEO2配比值升高,情况明显好转,当AES(2EO)/AEO2为1:4时,反应5 h后,纤维素酶剩余酶活力为76%。由此可知,虽然AES(2EO)对纤维素酶活的影响较大,但与AEO2复配后,纤维素酶活力显著提高,其原因是阴离子表面活性剂与非离子表面活性剂复配后,形成了混合胶束,非离子表面活性剂插入到阴离子表面活性剂为主的胶束中,从而降低了相邻分子间的电荷斥力,因此形成更小的胶束,同时每个胶束的电荷密度下降,对酶活力的影响变小[34]。

图9 AES(2EO)/AEO2复配后对纤维素酶活力的影响Fig.9 Influence on cellulase activity by AES(2EO)/AEO2mixture
3.2 纤维素酶在洗衣液中的洗涤性能测试
将国标污布JB-03按GB/T 13174—2008规定进行洗涤,洗涤白度值如图10所示。

图10 国标污布在洗衣液中的洗涤效果Fig.10 Washing effect of standard soiled cloth in liquid detergents
由图可知,在相同的洗涤条件下,国标污布JB-03在标准配方洗衣液、市售洗衣液、添加0.3% 和 1%纤维素酶的市售洗衣液中洗涤后的白度值分别为13.09、15.81、18.43和20.81,由此可知,洗衣液中添加纤维素酶能明显提高其对国标污布JB-03的去污力。其中,将洗衣液中纤维素酶的质量分数从 0.3%升高至 1%时,该白度值相应增加2.38,即加大洗衣液中纤维素酶的浓度,能明显提高洗衣液对国标污布JB-03的去污力。
3.3 国标污布洗涤效果图
将国标污布分别置于标准液、市售洗衣液、添加质量分数分别为0.3%和1%纤维素酶的市售洗衣液中,按GB/T 13174—2008规定进行洗涤后,用光学显微镜和 SEM观察该国标污布在洗涤前后的污布表面,结果如图11所示。

图11 不同处理污布的光学显微镜图片(a~d)和SEM图片(e~f)Fig.11 Optical microscope and SEM images
由光学显微镜图 11(a)可以观察到,未经洗涤的国标污布表面看起来发黑,且污布纤维间的孔隙较小,说明该污布上的污渍镶嵌在纤维表面及其缝隙,进一步地通过SEM观察到[图11(e)],国标污布表面纤维之间夹杂着污垢,整体看起来纤维排列较杂乱,且单根纤维黏附着较多的污垢,表面粗糙。
将该国标污布在标准液、市售洗衣液、添加质量分数分别为0.3%和1%纤维素酶的市售洗衣液中洗涤后,通过光学显微镜图11(b)~(d)可以明显看出污布表面明显变得干净,纤维之间的缝隙变大,而且纤维颜色较明亮,说明污布表面以及纤维缝隙间的污渍被去除。而这一现象通过 SEM看得更为清楚,由SEM图11(f)~(h)可以观察到,经洗涤后的国标污布表面纤维间的污垢及单根纤维上附着的污渍被去除,纤维表面变得平滑,尤其经添加纤维素酶的洗衣液处理过的国标污布表面纤维整体排列较整齐,单根纤维表面更加干净平滑。
4 结 论
(1)阴离子表面活性剂LAS、LS和AES对纤维素酶有很强的失活作用,而非离子表面活性剂AEO对纤维素酶活力影响不大。
(2)DLS、荧光和ATR-FTIR实验表明,阴离子表面活性剂使纤维素酶失活的原因是阴离子表面活性剂会引起纤维素酶结构发生变化。而非离子表面活性剂在水溶液中不以离子形式存在,通过氢键与纤维素酶作用,该作用不会引起纤维素酶结构的改变。
(3)将纤维素酶添加到洗衣液中,能明显提高洗衣液对国标污布JB-03的去污力。
References
[1] PEREZ J, MUNOZ-DORADO J, DE LA RUBIA T, et al. Biodegradation and biological treatments of cellulose, hemicelluloses and lignin an overview [J]. Int. Microbiol., 2002, 5: 53-63. DOI: 10.1007/s10123-002-0062-3.
[2] BHAT M K, BHAT S. Cellulose degrading enzymes and their potential industrial applications [J]. Biotechnol. Adv., 1997, 15: 583-620. DOI: 10.1016/S0734-9750(97)00006-2.
[3] 项瑾, 梁毅, 陈楠. 等温滴定量热法和荧光滴定法研究十二烷基硫酸钠与纤维素酶的结合[J]. 化学学报, 2003, 61(12): 1949-1954.
XIANG J, LIANG Y, CHEN N. Studies on the binding of sodium dodecyl sulfate to cellulase by isothermal titration calorimetry and fluorescence titration [J].Acta Chimica Sinica, 2003, 61(12): 1949-1954.
[4] MANDELS M. Applications of cellulases [J]. Biochem. Soc. Trans., 1985, 13: 414-416.
[5] BEGUIN P, AUBERT J P. The biological degradation of cellulose [J]. FEMS Microbiol., 1994, 13: 25-58. DOI: 10.1016/0168-6445(94)90099-X.
[6] LEE I, EVANS B R, WOODWARD J. The mechanism of cellulase action on cotton fibers: evidence from atomic force microscopy [J]. Ultramicroscopy, 2000, 82: 213-221. DOI: 10.1016/S0304-3991(99)00158-8.
[7] LIANG Y S, YUAN X Z, ZENG G M, et al. Effects of surfactants on enzyme-containing reversed micellar system [J]. Sci. China Chem., 2011, 54: 715-723. DOI: 10.1007/s11426-011-4266-2.
[8] 于跃, 张剑. 纤维素酶降解纤维素机理的研究进展[J]. 化学通报, 2016, 79(2): 118-122.
YU Y, ZHANG J. Research progress in cellulose degradation by cellulase [J]. Chemistry Online, 2016, 79(2): 118-122.
[9] 和田恭尚. 酶在洗涤剂中的应用现状及展望[J]. 日用化学工业, 2005, 35(1): 30-35.
WADA Y. Status and prospect of application of enzyme in detergent products [J]. China Surfactant Detergent & Cosmetics, 2005, 35(1):30-35.
[10] HOSHINO E, CHIWAKI M, SUZUKI A, et al. Improvement of cotton cloth soil removal by inclusion of alkaline cellulase from Bacillus sp. KSM-635 in detergents [J]. Journal of Surfactant and Detergents, 2000, 3: 317-326.
[11] VASCONCELOS A, CAVACO-PAULO A. Enzymatic removal of cellulose from cotton/polyester fabric blends [J]. Cellulose, 2006, 13: 611-618. DOI: 10.1007/s10570-06-9063-2.
[12] MIZUTANI C, SETHUMASHAVAN K, HOWLEY P, et al. Effect of a nonionic surfactant on Trichoderma cellulase treatments of regenerated cellulose and cotton yarns [J]. Cellulose, 2002, 9: 83-89.
[13] 姚兰, 赵建, 谢益民, 等.木质素结构以及表面活性剂对木质素吸附纤维素酶的影响[J]. 化工学报, 2012, 63(8): 2612-2616.
YAO L, ZHAO J, XIE Y M, et al. Effect of lignin structure and surfactant on cellulase adsorption by lignin [J]. CIESC Journal, 2012, 63(8): 2612-2616.
[14] XIA J, CHEN X, NNANNA I A. Activity and stability of Penicillium cyclopium lipase in surfactant and detergent solutions [J]. J. Am. Chem. Soc., 1996: 115-20. DOI: 10.1007/BF02523457.
[15] 沈兵兵.复合酶在液体洗涤剂中的应用[D]. 上海: 华南理工大学, 2012: 32-33.
SHEN B B. Application of composite enzymes in liquid laundry detergent [D]. Shanghai: South China University of Technology, 2012: 32-33.
[16] COX M F, 吴姣莲. 烷基链长和EO含量对AES性能的影响[J]. 日用化学品科学, 1990, (5): 1-9.
COX M F,WU J L. Effect of alkyl chain length and EO chain on AES [J]. Detergent & Cosmetics, 1990, (5): 1-9.
[17] 史兴旺. 新颖表面活性剂对牛血清蛋白(BSA)结构的影响研究[D].济南: 山东大学, 2008: 49-51.
SHI X W. Studies on the effects of novel surfactants on the structures of bovine serum albumin(BSA) [D]. Jinan: Shandong University, 2008: 49-51.
[18] 叶进富. 蛋白质Zeta电位与离子交换层分析的相关性研究[D]. 杭州: 浙江大学, 2006: 33-35.
YE J F. Zeta potential of protein and its correlation to separation behavior of ion exchange chromatography [D]. Hangzhou: Zhejiang University, 2006: 33-35.
[19] 刘微, 李萌, 任皓威, 等. 荧光、紫外和红外光谱分析人乳和牛乳β-酪蛋白的功能和构象差异[J]. 光谱学与光谱分析, 2014, 34(12): 3283-3287. DOI: 10.3964/j.issn.100-0593(2014)12-3281-07.
LIU W, LI M, RENG H W, et al. Comparison of the function and conformation of human β-casein and bovine β-casein by spectroscopic study [J]. Spectroscopy and Spectral Analysis, 2014, 34(12): 3283-3287. DOI: 10.3964/j.issn.100-0593(2014)12-3281-07.
[20] 刘媛, 谢孟峡, 康娟. 三七总皂甙对牛血清白蛋白溶液构象的影响[J]. 化学学报, 2003, 61(8): 1305-1310.
LIU Y, XIE M X, KANG J. Influence of total saponins of Panax notoginseng on the conformation of BSA[J]. Acta Chimica Sinica, 2003, 61(8): 1305-1310.
[21] 马萍, 迟燕华, 庄稼, 等. 骨螺紫及其铜配合物与人血清白蛋白相互作用的光谱学研究[J]. 高等学校化学学报, 2009, (8): 1509-1515.
MA P, CHI Y H, ZHUANG J, et al. Spectroscopic studies on the interaction of murexide and murexide-copper complex with human serum albumin [J].Chemical Journal of Chinese Universities, 2009, (8): 1509-1515.
[22] 马林, 魏志强, 黄爱民, 等. 丙三醇对水溶液中血红蛋白构象的影响——荧光猝灭和动态光散射研究[J]. 化学学报, 2009, 67(14): 1566-1572.
MA L, WEI Z Q, HUANG A M, et al. Influence of glycerol on the conformation of hemoglobin in aqueous solutions: a study of fluorescence quenching and dynamic light scattering [J]. Acta Chimica Sinica, 2009, 67(14): 1566-1572.
[23] 魏晓芳, 西明, 刘会洲. pH诱导牛血清白蛋白芳香氨基酸残基微环境变化的光谱分析[J]. 光谱学与光谱分析, 2000, 20(4): 556-559. DOI: 10.3321/j.issn:1000-0593.2000.04.028.
WEI X F, XI M, LIU H Z. Spectral study of the microenviroment change of aromatic amino-acid residues in BSA induced by pH [J]. Spectroscopy and Spectral Analysis, 2000, 20(4): 556-559. DOI: 10.3321/j.issn:1000-0593.2000.04.028.
[24] NIELSEN A D, ARLETH L, WESTH P. Analysis of proteinsurfactant interactions — a titration calorimetric and fluorescence spectroscopic investigation of interactions between Humicola insolens cutinase and an anionic surfactant [J]. Biochimica et Biophysica Acta, 2005, (1752): 124-132. DOI: 10.1016/j.bbapap.2005.08.001.
[25] BROCKHINKE A, PLESSOW R, DITTRICH P, et al. Analysis of the local conformation of proteins with two-dimensional fluorescence techniques [J]. Appl. Phys., 2000, (71): 755-763. DOI: 10.1007/ s00340000384.
[26] LAKOWICZ J R. Principles of Fluorescence Spectroscopy [M]. 3rd ed. Springer, 2006: 529-575.
[27] VONGSVIVUT J, HERAUD P, ZHANG W, et al. Rapid determination of protein contents in microencapsulated fish oil supplements by ATR-FTIR spectroscopy and partial least square regression (PLSR) analysis [J]. Food and Bioprocess Technology, 2014, 7: 265-277. DOI: 10.1007/s11947-013-1122-8.
[28] 袁久刚, 文艺. 表面活性剂对纤维素酶水洗性能的影响[J]. 纺织学报, 2014, 35(5): 78-82. DOI: 10.13475/j.fzxb.201405007805.
YUAN J G, WEN Y. Effect of surfactant on cellulase bio-washing [J]. Journal of Textile Research, 2014, 35(5): 78-82. DOI: 10.13475/j.fzxb. 201405007805.
[29] 余多慰, 袁生. 绿色木霉纤维素酶分子内氢键特征的研究[J]. 光谱学与光谱分析, 2005, 25(4): 544-547.
YU D W, YUAN S. Hydrogen-bond state analysis of cellobiohydrolase Ⅱ molecule from Trichoderma viride [J]. Spectroscopy and Spectral Analysis, 2005, 25(4): 544-547.
[30] ZHANG J, ZHANG J. Study on the interaction of alkaline protease with main surfactants in detergent [J]. Colloid and Polymer Science, 2015, 9: 1-9. DOI: 10.1007/s00396-015-3777-3.
[31] GUILLEN M D, CABO N. Characterization of edible oils and lard by Fourier transform infrared spectroscopy. Relationships between composition and frequency of concrete bands in the fingerprint region [J]. J. Am. Chem. Soc., 1997, 74: 1281-1286. DOI: 10.1007/ s11746-997-0058-4.
[32] 董荣, 李江华, 陈银生. 液体洗涤剂组分对青霉脂肪酶活性的影响[J]. 日用化学品科学, 2000, 23(S1): 100-102.
DONG R, LI J H, CHEN Y S. Effects of liquid detergent components on activity of penicillium lipase [J]. Detergent & Cosmetics, 2000, 23(S1): 100-102.
[33] IVANOV I B, KRALCHEVSKY P A. Stability of emulsions under equilibrium and dynamic conditions [J]. Colloids and Surfaces A, 1997: 155.
[34] 梁运姗, 袁兴中, 曾光明, 等. 表面活性剂在逆胶束酶反应系统中的作用机制[J]. 中国科学: 化学, 2011, 41(5): 763-775.
LIANG Y S, YUAN X Z, ZENG G M, et al. Effects of the surfactants on enzyme-containing reversed micellar system [J]. Scientia Sinica Chimica, 2011, 41(5): 763-775.
2015-12-30收到初稿,2016-03-14收到修改稿。
联系人:张剑。第一作者:于跃(1984—),男,硕士研究生。
Received date: 2015-12-30.
中图分类号:TQ 028.8
文献标志码:A
文章编号:0438—1157(2016)07—3023—09
DOI:10.11949/j.issn.0438-1157.20151989
基金项目:2016年度山西省重点研发计划国际合作项目(利用高分子材料自组装固定化碱性蛋白酶的研究)。
Corresponding author:ZHANG Jian, zhangjian0923@vip.sina.com
Interaction of cellulase with surfactants and their application in detergent
YU Yue, ZHANG Jian
(School of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, Shanxi, China)
Abstract:Effects of surfactants on cellulase activity were studied. The interaction mechanism between surfactants and cellulase was discussed by dynamic light scattering (DLS), fluorescence spectrum and ATR-FTIR. The DLS results showed that anionic surfactants were adsorbed onto cellulase surface, which made cellulase zeta potential distribute in the lower negative charge region. There was no obvious difference of cellulase zeta potential between in nonionic surfactants and deionized water. As shown in spectroscopy, the anionic surfactants had stronger influence on the main chain and side chain of cellulase than nonionic surfactant AEOs. The washing performance data of liquid detergent with and without cellulase indicated that adding cellulase into liquid detergent can enhance detergency of liquid detergent.
Key words:cellulase; surfactant; DLS; fluorescence spectrum; ATR-FTIR; detersive power
