pcDNA3-hNGF真核表达载体的构建及其在大鼠骨髓基质干细胞中的表达
2016-08-06贝朝涌蒋林彬徐威陈宁
粟 谋 贝朝涌* 蒋林彬 徐威, 陈宁
1.桂林医学院附属医院四肢创伤骨科 541001 2.桂林医学院生物技术学院 541004
神经生长因子(Nerve Growth Factor, NGF)在促进骨折愈合修复中是重要生长因子之一[1]。骨髓基质干细胞(Bone Marrow Stromal Cells, BMSCs)是目前已成为应用较广泛的骨组织工程重要种子细胞[2,3]。基因组织工程给我们提供了良好的方法,它利用基因转染技术使得编码特定功能因子的基因转至种子细胞里或生物活性基质材料,让转染细胞表达目的基因及产物,在体内促进细胞的增殖、分化而发挥正常的生理功能。
本研究实验利用PCR方法扩增hNGF基因cDNA,构建重组质粒pcDNA3-hNGF并转染至大鼠BMSCs中,检测其表达活性。为骨折的基因治疗提供实验依据。
1 材料与方法
1.1试剂及材料 hNGF基因片段、TIANGEN逆转录试剂盒、无内毒素质粒大提取试剂盒、凝胶回收试剂盒、限制性内切酶HindⅢ、BamHI、pcDNA3质粒载体、T4-DNA连接酶(NEB)、DH5α大肠杆菌(武汉淅玛生物技术有限公司),DMEM(Low Glu)细胞培养基、胎牛血清(Hyclone)、DNA marker(南宁天地扬生物有限公司),Lipofectamine 2000脂质体转染试剂(invitrogen公司),RIPA裂解液、BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒(上海碧云天生物技术有限公司),ab52918NGF抗体(ABCAM公司),辣根过氧化物酶标记的山羊抗兔二抗(北京中杉金桥生物技术有限公司)。大鼠第5代BMSCs细胞由本课题组分离培养。
1.2方法
1.2.1真核表达载体pcDNA3-hNGF的构建及鉴定:① 引物的设计 根据GenBank公布的hNGF-cDNA。用Primer Premier 5.0软件设计引物。交由武汉淅玛生物技术有限公司合成。
上游引物: 5′-CCCAAGCTTGCCGCCACCA TGTCCATGTTGTTCTACACTCTGA -3′(含限制酶切位点HindⅢCCCAAGCTT),
下游引物: 5′- CGCGGATCCTCAGGCTCTTCTC ACAGCCTTCCTGCTGA -3′(含限制酶切位点BamHI CGCGGATCC)。②目的基因的扩增 将hNGF基因片段按如下PCR程序扩增:预变性:94 ℃,3 min;变性:94 ℃,30 sec;退火:56 ℃,30 sec;延伸:72℃,1 min;共35个循环。1.5%琼脂糖凝胶电泳检测PCR结果,用DNA纯化试剂盒纯化提取hNGF目的基因的PCR产物。③真核表达质粒pcDNA3-hNGF的构建及鉴定 目的DNA片段和pcDNA3分别进行HindⅢ和BamHI双酶切,琼脂糖凝胶电泳检测并线性化载体,用DNA纯化试剂盒回收酶切DNA片段。酶切后的pcDNA3 线性质粒和目的DNA 片段与T4DNA 连接酶建立连接反应,16℃连接20 h至T载体上。取连接反应的产物转化大肠杆菌DH5α,接种在含有氨芐青霉素的培养皿上,倒置培养12~16 h。根据蓝白斑进行筛选,取阳性克隆进行细菌培养,提取质粒HindⅢ和BamHI双酶切鉴定,并送测序鉴定。
1.2.2重组质粒pcDNA3-hNGF转染大鼠BMSCs及Western blot检测:复苏冻存于液氮中的第5代大鼠BMSCs,培养于含10%胎牛血清的DMEM低糖培养基中,将细胞转入6孔板中,分为3组:A组为脂质体转染组, B组为脂质体包裹的空质粒转染组,C组为脂质体包裹hNGF的重组质粒转染组。取纯化的pcDNA3-hNGF及空载体pcDNA3各4 μg,按Lipofectamine2000说明书进行操作,将各组载体转染大鼠BMSCs。收集转染后72 h各组细胞,RIPA细胞裂解液裂解后,使用BCA蛋白浓度测定试剂盒测定蛋白浓度。10%聚丙烯酰胺凝胶电泳后,将蛋白转移到PVDF膜上。加入ab52918NGF抗体,使用辣根过氧化物酶标记的二抗孵化,通过超敏ECL法检测试剂盒检测目的蛋白条带。
2 结果
2.1扩增的hNGF基因
PCR扩增hNGF基因,经琼脂糖凝胶电泳检测,可见扩增得到约720 bp的片段。DNA序列测定表明扩增片段的核苷酸序列与GenBank上的hNGF编码区基因完全一致(图1)。

图1 hNGF cDNA扩增后琼脂糖电泳结果DL1000 Marker(Left to right):100bp、250bp、500bp、750bp、1000bpFig.1 Results of hNGF cDNA amplification agarose gel electrophoresis
2.2基因重组质粒pcDNA3-NGF的鉴定
2.2.1双酶切验证
使用HindⅢ、BamHI对2份重组质粒pcDNA3-hNGF进行双酶切电泳鉴定。产生和hNGF cDNA大小一致的片段(图2)。
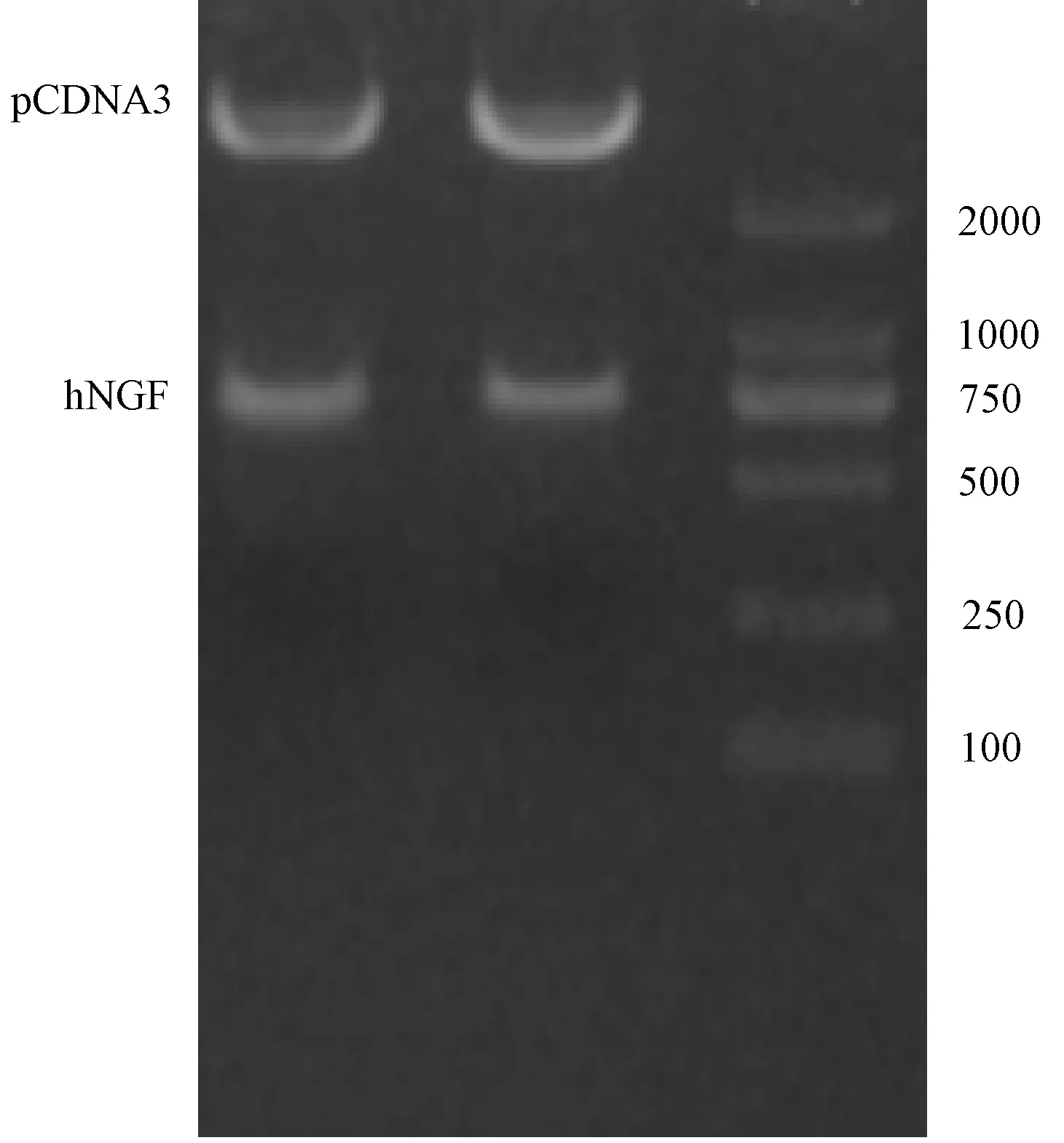
图2 pcDNA3-NGF双酶切电泳结果DL2000 Marker(从左往右):100bp、250bp、500bp、750bp、1000bp、2000bp1,2泳道:双酶切后pcDNA3-hNGF 3泳道:DL2000 MarkerFig.2 Results of pcDNA3-NGF double digestion electrophoresis.DL2000 Marker(Left to right):100bp、250bp、500bp、750bp、1000bp、2000bpLanes 1,2: pcDNA3-hNGF after double digested.Lane 3: DL2000 Marker
2.2.2测序鉴定结果:将NGF基因经HindⅢ、BamHI双酶切反应载体和pcDNA3 连接后,成功构建pcDNA3-hNGF,重组质粒送武汉淅玛生物技术有限公司进行基因测序与对比分析,测序结果显示重组质粒pcDNA3-hNGF插入的序列与GenBank 中hNGF上的序列完全一致。
2.3Western blot检测pcDNA3-hNGF在BMSCs中的表达
收集转染后72 h各组细胞行Western blot 检测hNGF表达情况。Western blot 检测到hNGF质粒转染组有明显的阳性条带,而空质粒转染组及脂质体转染组的条带较弱(图3)。

图3 Western blot 检测hNGF蛋白表达Fig.3 Western blotting protein detection of hNGF expressionA: liposomal transfection group; B: empty plasmid transfection group; C: hNGF plasmid group
3 讨论
有研究表明NGF对骨折愈合修复有明显影响[4,5]。NGF对骨组织的愈合作用在各方面、各层次相互交叉。它促进骨折处的血液供应, 对骨折过程中的各种炎性细胞的调节;促进肽能神经纤维长入骨组织;增加骨折处的钙沉积,促进成骨细胞的成骨增加成骨细胞活性;直接或间接地促进骨母细胞分化为软骨细胞或骨细胞, 刺激骨细胞增殖分化,从而加速骨折愈合[6-8]。本实验通过构建pcDNA3-hNGF表达质粒,利用基因转染技术,使hNGF基因转染至BMSCs,并在BMSCs表达hNGF目的基因蛋白。通过该生长因子在骨折局部的持续稳定表达,在体内促进软骨细胞或骨细胞增殖、分化,从而达到促进骨折愈合的作用。
基因治疗的关键环节之一是如何有效地将目的基因导入靶细胞内并使其稳定表达。目前研究有病毒法和非病毒法[9,10]。两者各有利弊。脂质体介导基因转染是常用的非病毒转染法之一,其不存在病毒的污染,相对安全。但是,脂质体具有一定的细胞毒性,尤其是高浓度的脂质体可以使细胞裂解;并且不同的细胞系对不同的脂质体介导的基因转染的反应有差异,因此研究者必须在每个细胞系中采用最优化的转染比例[11,12]。脂质体介导基因转染的效率与细胞接种密度、生长状态、DNA和脂质体剂量、转染时间等多种因素有关,其中DNA与脂质体的比例最为重要。在实验中,我们发现当DNA的剂量1 μg时,脂质体剂量超过1 μL以后,脂质体的细胞毒性就非常明显,转染后的BMSCs的生长和分化受到极大影响。因此,本实验根据Lipoefctmaine试剂盒推荐的最佳细胞密度(2×105/2ml/孔)、生长状态(70%-80%融合),通过确定的DNA和脂质体剂量(1 μg∶3 μL),达到了较高的转染效率和促BMSCs增殖和定向分化作用。
综上所述,本实验利用PCR方法扩增hNGF基因片段, 将hNGF基因片断与T载体连接,构建T-hNGF质粒载体后转化到大肠杆菌DH5α筛选阳性克隆, 分别用HindⅢ和BamHI双酶切T-hNGF质粒和pcDNA3真核表达载体, 将克隆载体中hNGF基因重组到pcDNA3真核表达载体作酶切电泳、DNA 测序鉴定,测序结果显示重组质粒pcDNA3-hNGF插入的序列与GenBank 中hNGF上的序列完全一致。pcDNA3-hNGF转染至大鼠BMSCs后,经Western blot 检测,证明重组质粒pcDNA3-hNGF转染BMSCs后能在大鼠BMSCs过表达hNGF蛋白。
因此,本研究成功构建了pcDNA3-hNGF真核表达质粒,从而为应用神经生长因子修饰的骨髓基质干细胞进行骨折治疗研究奠定实验基础。
