松墨天牛转铁蛋白基因克隆及生物信息学分析
2016-08-05蔡紫玲刘琪司
蔡紫玲,刘琪司,林 同
(华南农业大学林学与风景园林学院,广东 广州 510642)
松墨天牛转铁蛋白基因克隆及生物信息学分析
蔡紫玲,刘琪司,林 同
(华南农业大学林学与风景园林学院,广东 广州 510642)
转铁蛋白是一类非血红素结合铁的β1-球蛋白,广泛分布于脊椎动物和无脊椎动物体内。克隆了松墨天牛转铁蛋白基因(登录号:KU213914),命名为MaTf,其核苷酸序列全长为2 549 bp,包含一个2 178 bp的开放阅读框(ORF)和一个371 bp的带有加尾信号的3'非编码区(3'UTR)。采用生物信息学方法分析MaTf的编码蛋白,结果显示:松墨天牛转铁蛋白分子量约为80 ku,等电点为7.36,为稳定蛋白,有信号肽,不含跨膜结构域,有1个糖基化位点,有平均分布在整条肽链的43个磷酸化位点。二级结构多为随机卷曲,仅有21.52%α螺旋,24%β片层(延伸链)结构,能形成三段卷曲螺旋,为亲水性蛋白,N端和C端各有1个TR_FER结构域。
松墨天牛;转铁蛋白;生物信息学;结构域
蔡紫玲,刘琪司,林同.松墨天牛转铁蛋白基因克隆及生物信息学分析[J].广东农业科学,2016,43(4):117-123.
松墨天牛(Monochamus alternatus)是毁灭性病害松材线虫(Bursaphelenchus xylophilus)的主要媒介昆虫,也是松树的重要蛀干害虫。松墨天牛的寄主植物多为松属(Pinus)植物,包括黑松(Pinus thunbergii)、马尾松(Pinus massoniana)、云南松(Pinus yunnanensis)、赤松(Pinus densiflora)等[1],也可危害冷杉属(Abies)、黄杉属(Pseudotsuga)、落叶松属(Larix)、铁杉属(Tsuga)和雪松属(Cedrus)等[2]。另外,松墨天牛分布广泛,已成为国内南方松林最具危险性的天牛[3]。
转铁蛋白(Transferrin),又称为运铁蛋白、铁传递蛋白、嗜铁蛋白、铁糖蛋白,是一类非血红素结合铁的β1-球蛋白,广泛分布于脊椎动物和无脊椎动物体内[4]。转铁蛋白为单链糖基化蛋白,相对分子质量约为70~80 ku,等电点一般呈酸性,糖基约占6%,在N端和C端各有一个高同源性的球形结构域,每个结构域含有1个可逆性结合Fe3+离子位点和1个阴离子结合位点[5]。由于转铁蛋白具有螯合铁离子的能力,因此转铁蛋白主要负责输送铁离子到红细胞作为合成血红蛋白使用,或者运输到机体内其他需铁的部位[6]。另外,铁离子是细菌生长的必要因子,因此转铁蛋白也能够抗菌杀菌,有自我保护的抗病作用[7]。
在昆虫纲中,有关转铁蛋白的研究报道有鳞翅目的云杉卷叶蛾(Choristoneura fumiferana)[8]、小菜蛾(Plutella xylostella)[9]、棉铃虫(Helicoverpa armigera)[10]、水稻二化螟(Chilo suppressalis Walker)[11],双翅目的白纹伊蚊(Aedes albopictus)[12]、淡色库蚊(Culex pipiens pallens)[13]、埃及伊蚊(Aedes aegypti)[14-15]、刺舌蝇 (Glossina morsitans)[16],膜翅目的蜜蜂(Apis mellifera)[17]、红火蚁[18](Solenopsis invicta Buren)。但尚未有相关鞘翅目昆虫转铁蛋白的报道。本研究成功克隆了松墨天牛转铁蛋白基因cDNA序列全长,并分析其核苷酸序列基本特征及其推导氨基酸序列的理化特性、信号肽、疏水性、跨膜结构、二级结构、结构功能等,为研究昆虫转铁蛋白分子特征提供依据,也为深进一步研究昆虫转铁蛋白与抗药性机制提供了分子依据。
1 材料与方法
1.1 试验材料
1.1.1 供试天牛 松墨天牛在广州市从化区马尾松次生林诱捕所得,将整只成虫经液氮迅速冷冻后,置于-80℃冰箱保存。
1.1.2 主要试剂 E.Z.N.A.TMTotal RNA Kit II总RNA试剂盒购于OMEGA公司;3'-Full RACE Core Set with PrimeScriptTMRTase试剂盒、pMD20-T Vector、E.coli DH5 α Competent Cells购自TaKaRa公司;通用型DNA纯化回收试剂盒为天根生物有限公司产品;LB培养基配置试剂(Yeeast Extract、Tryptone Powder、NaCl)、IPTG及X-Gal等为上海生工生物工程有限公司产品。
1.2 松墨天牛转铁蛋白基因cDNA的克隆
1.2.1 总RNA提取 取约20 mg松墨天牛成虫样本,加液氮研磨成粉末状,根据RNA抽提试剂盒(OMEGA公司)说明书进行总RNA提取操作。通过琼脂糖凝胶电泳检测RNA质量,经微量紫外分光光度仪(Nanodrop 2000)检测RNA浓度后,置于-80℃冰箱保存。
1.2.2 引物设计 从实验室构建的松墨天牛cDNA文库中筛选含有完整5'端的转铁蛋白基因序列,采用引物设计软件Primer premier 5.0,根据引物设计原则设计3'RACE引物:Outer:5'- GTCACACAGGAATAGGGCG-3',Inner:5'-GGAAGAGCAAAGGCGGACG-3'。
1.2.3 松墨天牛转铁蛋白3'RACE扩增 以总RNA反转录的cDNA为模板,以特异性引物Outer 和Inner为引物进行巢式PCR,Outer PCR反应体系:3'RACE Outer Primer(10 μmol/L) 2 μL,10 ×LA PCR Buffer II(Mg2+Free)4 μL,MgCl2(25 mmol/L) 3 μL,cDNA 3 μL,1×cDNA Dilution Buffer II 7 μL,Gene Specific Outer Prier(10 μmol/L) 2 μL,TaKaRaLA Taq® (5 U/μL) 0.25 μL,加水至50 μL。PCR程序:94℃ 3 min;94℃ 30 s、55℃ 30 s、72℃ 1 min,20个循环;72℃ 10 min。
Inner PCR反应体系:dNTP Mixture (2.5 mmol/L each) 8 μL,10×LA PCR Buffer II (Mg2+Free)5 μL,MgCl2(25 mmol/L) 5 μL,TaKaRaLA Taq® (5 U/μL) 0.5 μL,3'RACE Inner Primer(10 μmol/L) 2 μL,1st PCR产物 1 μL,Gene Specific Inner Primer(10 μmol/L) 2 μL,加水至50 μL。PCR反应程序:94℃ 3 min;94℃ 30 s、55℃ 30 s、72℃ 1 min,30个循环;72℃ 10 min。
1.2.4 DNA纯化及T-载体连接 3'RACE产物经琼脂糖凝胶电泳后,切下含目的片段的电泳条带,按通用型DNA纯化回收试剂盒说明书进行Inner PCR产物回收。取纯化的Inner PCR产物4 μL,1 μL pMD20-T Vetor,DNA Ligation Mix 5 μL,加dH2O至10 μL进行T-载体连接,放在4℃冰箱24 h。
1.2.5 重组质粒转化及序列测定 取T-载体连接产物4 μL转化到50 μL感受态大肠杆菌DH5α中,涂布于含有氨苄青霉素、IPTG和X-gal的LB培养基平板,37℃培养12 h。提取白色菌落的单克隆体进行菌落PCR鉴定,再挑取4个阳性克隆送上海生物工程有限公司测序。
1.3 序列分析
1.3.1 松墨天牛转铁蛋白基因编码蛋白的理化性质分析 测定序列拼接完成后,经NCBI的BLASTp程序鉴定为一种松墨天牛转运蛋白基因的序列,将序列提交到GenBank数据库(序列号:KU213914)。通过NCBI数据库的BLASTp程序、ORF Finder(Open Reading Frame Finder)(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)以及ProtParm(http://web.expasy.org/protparam/)对序列进行在线分析,确定转铁蛋白基因序列的编码区并预测其编码蛋白质的理化性质,进行稳定性和半衰期的评估;信号肽预测采用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP-4.1/)在线分析;跨膜结构域分析利用在线工具TMHMM (http://www.cbs.dtu.dk/services/TMHMM/);糖基化位点采用DictyOGlyc 1.1 Serve(http://www.cbs.dtu.dk/services/DictyOGlyc/)预测;磷酸化位点采用NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测;疏水性采用Expasy提供的在线工具ProtScale程序(http://web.expasy.org/protscale/)分析。
1.3.2 松墨天牛转铁蛋白基因编码蛋白的结构及功能分析 利用GOR在线工具(https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)完成蛋白质的二级结构预测,并通过COILS Server(http://www.ch.embnet.org/software/COILS_form.html)分析其卷曲螺旋结构;利用SWISS-MODEL(http://swissmodel.expasy.org/)在线进行同源建模;利用SMART(http://smart.emblheidelberg.de/)对其结构域进行预测。
1.3.3 基于昆虫转铁蛋白基因推导的氨基酸序列分析 采用软件DNAMAN对松墨天牛与其他12种昆虫转铁蛋白氨基酸序列进行同源性比对,而系统发育树则通过Clustalx和MEGA4软件(NJ法)构建。
2 结果与分析
2.1 松墨天牛转铁蛋白核苷酸序列组成
以松墨天牛cDNA为模板,采用3'RACE克隆得到转铁蛋白cDNA序列,其核苷酸序列及其编码的氨基酸序列已提交GenBank(登录号:KU213914),命名为MaTf。MaTf的全长cDNA序列有2 549 bp,包含一个2 178 bp的开放阅读框(ORF)和一个371 bp的带有加尾信号的3'非编码区(3'UTR)。
2.2 MaTf理化性质
MaTf共有725个氨基酸,计算分子量约为80 ku,分子式为C3561H5611N967O1080S33,等电点为7.36,预测MaTf是一类稳定蛋白,这些为MaTf蛋白质的分离和纯化提供了依据。
2.3 昆虫转运蛋白氨基酸序列比对
经过 B L A S T p分析松墨天牛的转铁蛋白,搜索并筛选了 1 2种昆虫的转铁蛋白,分别为Apriona germari(AAW70172.1)、Tribolium castaneum(XP_001808066.1)、Protaetia brevitarsis(ABI31834.1)、Zootermopsis nevadensis(KDR19744.1)、Mastotermes darwiniensis(AAN03488.1)、Romalea microptera (AAQ62963.2)、Nephotettix cincticeps (BAQ94504.1) 、Papilio xuthus (KPI94090.1)、Apis dorsata (XP_006608191.1)、Aedes aegypti (XP_001647578.1)、Drosophila melanogaster (AAC67389.1)、Glossina morsitans morsitans (AAM46784.3)。使用DNAMAN软件对氨基酸序列进行同源性比对,发现松墨天牛与桑天牛(Apriona germari)的同源性最高,氨基酸一致性在90%以上;与赤拟谷盗(Tribolium castaneum)、白星花金龟(Protaetia brevitarsis)的同源性较高,氨基酸一致性在70%以上,与其余昆虫的同源性较低,氨基酸一致性在43%~59%之间(图1)。
2.4 基于昆虫转运蛋白的系统发育树
采用Clustalx和MEGA4对松墨天牛和7个目12种昆虫的转铁蛋白氨基酸序列建立系统进化树(图2),结果显示,桑天牛、赤拟谷盗、白星花金龟同属于鞘翅目,与松墨天牛的亲缘关系较为接近,云南野生大蜜蜂、柑桔凤蝶等与松墨天牛的亲缘关系最远。
2.5 信号肽、跨膜结构域及翻译后修饰分析
信号肽位于初生蛋白的N端,一般由15~30个氨基酸残基组成,是一段能引导新合成肽链转移到内质网上的多肽[19]。经过Singal IP 4.1在线分析,以0.5分为阈值,C分值0.715在20位点,Y分值0.780在20位点,S分值0.956在1位点,信号肽计算结果为“Yes”,即表示松墨天牛转铁蛋白N端有信号肽,为分泌蛋白。
TMHMM采用马氏模型,综合跨膜区螺旋长度、亲疏水性和膜蛋白拓扑学等特性,能有效地预测肽链的跨膜区及膜内外区。根据TMHMM Server分析,结果显示松墨天牛转铁蛋白不含跨膜结构域,且整条肽链都位于膜外。
采用DictyOGlyc在线软件对MaTf氨基酸序列的糖基化位点进行分析,发现MaTf含有1个糖基化位点,位于196位,为丝氨酸。

图1 松墨天牛与12种昆虫的转运蛋白氨基酸序列的同源比对
NetPhos2.0 Server磷酸化位点分析MaTf,结果发现磷酸化位点在整条肽链上的分布较平均,计算分值>0.5的有:丝氨酸(Ser)磷酸化位点20个,苏氨酸(Thr)磷酸化位点8个,酪氨酸(Tyr)磷酸化位点15个。
2.6 二级结构、卷曲螺旋及疏水性分析
GOR在线预测松墨天牛转铁蛋白的二级结构,结果(图3)表明,α螺旋占21.52%,β片层(延伸链)结构占24%,随机卷曲最多,占 54.48%,并不存在β转角等其他结构。根据COILS Server分析,MaTf有3段序列可形成卷曲螺旋。MaTf疏水性最大分值为3.456、在第8位点,而最小分值为-2.811、在第27位点,为亲水蛋白。

图2 基于松墨天牛与12种昆虫转运蛋白构建的系统发育树

图3 MaTf二级结构GOR分析
2.7 同源建模与功能结构域分析
提交MaTf氨基酸序列到SWISS-MODEL在线软件进行分析,结果显示该蛋白的三维结构分子(图4)有明显的两个分区折叠。
根据SMART在线工具分析,MaTf存在两个功能结构域,为TR_FER(图5)。第1个功能结构域位于32~378个氨基酸残基,第2个机构域位于379~725个氨基酸残基。
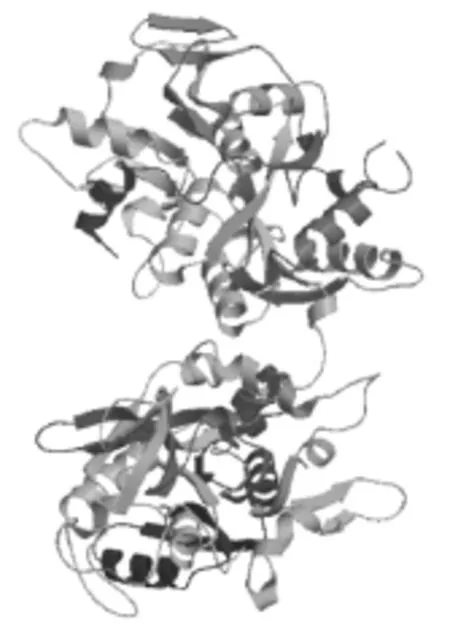
图4 MaTf的同源建模SWISS-MODEL分析

图5 MaTf的结构功能域SMART分析
3 讨论
作为脊椎动物和无脊椎动物体内转运铁离子的主要蛋白,转运蛋白在成红细胞合成血红蛋白过程中起重要作用,表现在其结构上的保守性。本试验克隆了松墨天牛转铁蛋白(MaTf)基因cDNA的全长序列,其推导的氨基酸序列长达725个氨基酸残基。通过生物信息学分析,MaTf含有信号肽,不含跨膜结构域,二级结构大部分为随机卷曲,21.52%为α螺旋,24%为β片层(延伸链)结构,在300~600之间能形成两段卷曲螺旋。根据SMART对MaTf的功能结构域分析,MaTf有两个TR_FER功能结构域,经过比对其他昆虫序列,发现除了双翅目昆虫有且仅有1个TR_FER结构域外[20],其他鞘翅目、等翅目、直翅目、半翅目、膜翅目的昆虫均有两个TR_FER。通过比对人转铁蛋白序列,得知人转铁蛋白也含有两个TR_FER结构域。转铁蛋白这两个功能类似的结构域有一定的同源性,都保留了结合铁原子和碳酸阴离子的氨基酸位点,被认为是机体进化过程中以基因复制方式形成的,可加强对铁离子的转运能力[21-22]。由于鞘翅目昆虫比双翅目昆虫更为进化,前者比后者在C端多1个TR_FER结构域,可能发挥更丰富的生理功能。
由于转铁蛋白具有抗菌杀菌的功能,对大肠埃希菌生长有明显抑制作用,因此在昆虫中可作为新的抗性检测的基因靶标[13]。2011年王霄等[12]验证了转铁蛋白基因在白纹伊蚊溴氰菊酯抗性品系高表达,推测该基因可能与蚊虫抗性机制相关。人转铁蛋白N端半分子能在体外表达并具有活性,因此在医学界被作为药物运输载体应用于临床阶段[23]。目前未见有关于昆虫转铁蛋白基因外源表达的研究报道,将来可利用该基因进行昆虫抗性监测。
[1]Bartlett A C.Genetic changes during insect domestication.advances and challenges in insects rearing[M].ARS,USDA New Orlean,1984:1-8.
[2]杨建霞.松墨天牛对寄主植物的适应性与松材线虫危害特性的研究[D].南京:南京农业大学,2008.
[3]杨建霞,郝德君,周曙东,等.寄主植物对松墨天牛的营养效应及对体内酯酶与羧酸酯酶活性的影响[J].林业科学,2009,45(1):97-100.
[4]Gomme P T,Mc Cann K B,Bertolini J.Transferrin:structure,function and potential therapeutic actions [J].Drug Discov Today,2005(10):267-273.
[5]Brock J H.Transferrins,Metalloproteins[M].Hongkong:Machillan Press,1985:183.
[6]Aisen P,Listowsky I.Iron transport and storage proteins.Ann.Rev.Biochem[J].1980,49:357-393.
[7]Wang J,Chen G,Filebeen C,et al.Insights on regulation and function of the iron regulatory protein 1 (IRP1)[J].Hemoglobin,2008,32(1):109-115.
[8]Ampasala D R,Zheng S C,Retnakaran A,et al.Cloning and expression of a putative transferrin cDNA of the spruce budworm,Choristoneura fumiferana[J].Insect Biochemistry and Molecular Biology,2004,34:493-500.
[9]Kim J,Kim Y.A viral histone H4 suppresses expression of a transferrin that plays a role in the immune response of the diamondback moth,Plutella xylostella[J].Insect Molecular Biology,2010,19 (4),567-574.
[10]Zhang L,Shang Q,Lu Y,et al.A transferrin gene associated with development and 2-tridecanone tolerance in Helicoverpa armigera[J].Insect Molecular Biology,2015,24(2):155-166.
[11]Sonoda S,Maruyama T,Izumi Y,et al.Molecular cloning,nucleotide sequence and gene expression of a transferring gene from the rice stem borer,Chilo suppressalis Walker(Lepidoptera:Crambidae)[J].Appl.Entomol.Zool.,2004,39(3):463-468.
[12]王霄,谭文彬,程鹏,等.三种品系白纹伊蚊转铁蛋白基因表达量的比较分析.国外医学医学地理分册[J].2011,32(3):182-187.
[13]吴松泉,王光丽,周武,等.淡色库蚊转铁蛋白在毕赤酵母中的分泌表达及其抑菌活性的初步研究[J].2014,32(1):38-41.
[14]Zhou G L,Velasquez L S,Geiser D L,et al.Differential regulation of transferrin 1 and 2 in Aedes aegypti[J].Insect Biochemistry and Molecular Biology,2009,39:234-244.
[15]Harizanova N,Georgieva T,Dunkov B C,et al.Aedes aegypti transferrin.Gene structure,expression pattern,and regulation[J].Insect Molecular Biology,2005,14(1):79-88
[16]Guz N,Attardo G M,Wu Y,et al.Molecular aspects of transferring expression in the tsetse fly(Glossina morsitans morsitans)[J].Journal of Insect Physilogy,2007,53:715-723.
[17]do Nascimento A M,Cuvillier-Hot V,Barchuk A R,et al.Honey bee(Apis mellifera) transferringene structure and the role of ecdysteroids in the developmental regulation of its expression[J].Insect Biochemistry and Molecular Biology,2004,34 :415-424.
[18]Valles S M,Pereira R M.Developmental expression of a transferrin in the red imported fire ant,solenopsis invicta[J].Florida Entomologist,2005,88(4):541-543.
[19]郑斌,詹希美.信号肽序列及其在蛋白质表达中的应用[J].生物技术通讯,2005,16(3):296-298.
[20]龚晓林,张洁,李显航,等.家蝇转铁蛋白基因的克隆和生物信息学分析[J].生物信息学,2012,10 (4):234-237.
[21]Lambert L A,Perri H,Halbrooks P J,et al.Evolution of the transferrin family:conservation of residues associated with iron and anion binding[J].Comp Biochem Physiol B Biochem Mol Biol,2005,142 (2):129-41.
[22]Chatilata,Gehars.Phosphorylation of T cell membrane proteins by activators of protein kinases[J].J Immunol,1988,140(12):4308-4314.
[23]Qian Z M,Li H Y,Sun H Z,et al.Targeted drug delivery via the transferring receptorm ediated endocytosis pathway[J].Pharm acological Reviews,2002 (4):561-587.
(责任编辑 崔建勋)
Cloning and bioinformatics analysis of transferring gene of Monochamus alternatus
CAI Zi-ling,LIU Qi-si,LIN Tong
(College of Forestry and Landscape Architecture,South China Agricultural University,Guangzhou 510642,China)
Abstracts:Transferrin,a non-heme iron beta1 globulin,is widely distributed in vertebrate and invertebrate animals.The gene of transferrin of Monochamus alternatus (GenBank accession number is KU213914) was cloned and named as MaTf in this study.The whole length of MaTf was 2 549 bp,including 2 178 bp open reading frame (ORF) and 371 bp non-encoding region with a tail signal.Bioinformatics methods were used to analyze the characteristics of MaTf.The results showed that MaTf was a stable protein with molecular weight of 80 ku and isoelectric point of 7.36.There was a signal peptide,one glycosylation site,and 43 phoshorylaton sites in MaTf.The transmembrane domain structure was not found.Random curls,alpha helix (21.52%) and beta extension structure (24%) existed in the secondary structure,forming three sections of coiled coil.MaTf was a hydrophilic protein with TR_FER structures in the N and C terminals.
Monochamus alternatus;transferrin;bioinformatics;domain
S476.9;Q789
A
1004-874X(2016)04-0117-07
10.16768/j.issn.1004-874X.2016.04.023
2015-12-19
广东省自然科学基金(1414050001666)
蔡紫玲(1992-),女,在读硕士生,E-mail:1274800271@qq.com
林同(1969-),男,博士,副教授,E-mail: lintong@scau.edu.cn
