Sirt1调控软骨细胞自噬在骨关节炎中作用及机制
2016-08-05李春亮李钊伟
李春亮,李钊伟,秦 凤
(青海大学附属医院创伤骨科,西宁 810000)
Sirt1调控软骨细胞自噬在骨关节炎中作用及机制
李春亮,李钊伟△,秦凤
(青海大学附属医院创伤骨科,西宁 810000)
[摘要]目的探讨沉默信息调节因子1(Sirt1)调控软骨细胞自噬在骨关节炎(OA)中作用及机制的研究。方法免疫组织化学及逆转录PCR(RT-PCR)法检测人OA软骨和正常软骨中Sirt1的表达,Ⅱ型胶原酶消化软骨获得软骨细胞,单丹磺酰尸胺(MDC)法检测OA软骨细胞及正常软骨细胞自噬水平,并分析二者相关性;Sirt1激动剂白藜芦醇干预OA软骨细胞,并通过MDC法检测OA软骨细胞自噬水平,Western blot及RT-PCR法检测酵母自噬基因Atg/Vps30同源基因(Beclin-1)及微管相关蛋白1轻链3(LC3)蛋白及mRNA表达水平,烟酸己可碱(Hoechst)染色检测OA软骨细胞凋亡情况,Western blot检测B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)及哺乳动物雷帕霉素靶蛋白(mTOR)通路激活情况,分光光度法检测各组天冬氨酸蛋白水解酶(Caspase-3)活性。结果OA软骨中Sirt1蛋白及mRNA表达量都显著低于正常软骨中表达量(P<0.01),OA软骨细胞自噬水平低于正常软骨细胞(P<0.01),OA中软骨Sirt1表达量与自噬水平正相关;Sirt1激动剂白藜芦醇能显著提高OA软骨细胞自噬水平(P<0.01),提高自噬基因Beclin-1及LC3蛋白及mRNA表达量(P<0.01),并抑制mTOR磷酸化(P<0.01),从而抑制OA软骨细胞凋亡(P<0.01),下调Bax表达(P<0.01),上调Bcl-2表达(P<0.01),降低Caspase-3活性(P<0.01)。结论Sirt1在OA中低表达,并与软骨细胞自噬水平正相关,提高Sirt1表达水平后能显著能够显著抑制OA自噬,并抑制OA软骨细胞凋亡,这可能是通过mTOR信号通路实现的。
[关键词]骨关节炎;软骨细胞;自噬;沉默信息调节因子1
骨关节炎(osteoarthritis,OA)是一种多发于老年人的慢性退行性关节疾病,以关节软骨破坏和关节周围骨质增生为主要病理特征,主要与年龄、性别、遗传因素等有关[1-3]。目前OA发病机制主要围绕在关节软骨如何维持细胞和细胞外基质代谢的动态平衡上,而近年来也发现自噬在OA发病过程中起着重要作用[4-5]。沉默信息调节因子1(silent information regulation of transcription 1,Sirt1)是sirtuins家族研究最为广泛的一员,在神经退变性疾病、糖尿病、肿瘤、炎症、衰老等疾病中通过自噬参与其病理过程[6]。此外Sirt1在人OA软骨细胞外基质合成、细胞存活,以及抗炎作用中起着重要作用[7-8],并能通过对自噬相关蛋白去乙酰化从而调节细胞自噬水平[6,9]。因此推测,Sirt1可能通过调节OA软骨细胞自噬水平从而参与软骨细胞凋亡。所以本研究拟探讨Sirt1是否通过调控OA软骨细胞自噬,从而为Sirt1成为OA治疗靶点提供理论依据。
1资料与方法
1.1一般资料软骨组织取自2014年8月至2015年8月本院骨科进行膝关节置换术的30名OA患者(根据美国风湿性学会2008年制订的OA诊断标准,通过病史、临床检查和X线片确诊)。其中,男12例,女18例,年龄57~86岁,平均70岁。正常关节软骨10例,取自因创伤根据截肢的膝关节股骨头软骨,根据病史,术前X线片及术后肉眼观察排除标本退行性变,肿瘤、感染、类风湿炎症和明显骨质疏松等结构性破坏。正常关节软骨中,男7例,女3例,年龄19~42岁,平均31岁。患者对取材知情并同意,本试验亦经医学伦理委员会批准。
1.2方法
1.2.1主要试剂与仪器兔抗Sirt1人多克隆抗体购自北京博奥森生物技术有限公司;兔抗B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、哺乳动物雷帕霉素靶蛋白(mTOR)及p-mTOR单克隆抗体购自Epitmics公司;鼠抗甘油醛3-磷酸脱氢酶(GADPH)抗体,含半胱氨酸的天冬氨酸水解酶3(Caspase-3)检测试剂盒购自碧云天生物技术研究所;兔抗酵母自噬基因Atg/Vps30同源基因(Beclin-1)及微管相关蛋白1轻链3(LC3)多克隆抗体购自Abcam公司;白藜芦醇购自Sigma公司;Ⅱ型胶原酶,胎牛血清,达尔伯克(氏)改良伊格尔(氏)培养基(DMEM/F-12)购自Gibco公司。ChemiDocTMXRS凝胶成像系统购自Bio-Rad公司;Tecan Infinite F200/M200型多功能酶标仪购自瑞士TECAN集团公司,AF6000荧光显微镜购自德国Leica公司。
1.2.2免疫组织化学检测标本经二甲苯脱蜡,100%、95%、80%乙醇脱水,流水冲洗,抗原修复,马血清进行抗原封闭,一抗封闭,二抗封闭,苏木素浸泡,盐酸乙醇浸泡,流水冲洗至反蓝,梯度乙醇脱水,二甲苯透明,吹干后中性树胶封片,后镜检。Sirt1阳性染色为淡黄色、棕黄色,定位于细胞核。
1.2.3逆转录PCR(RT-PCR)检测总RNA的提取参考Trizol试剂盒 (Invitrogen) 使用说明书,整个提取处于无RNAase的环境下。引物设计见表1,通过一步法RT-PCR试剂盒将RNA逆转录成cDNA并进行PCR扩增,获取5 μL扩增产物用于下一步2%的琼脂糖胶进行检测并拍照。引物分别加入25 μL PCR反应体系中,反应条件为94 ℃变性45 s,59 ℃复性45 s,72 ℃延伸60 s,共35个循环。
1.2.4软骨细胞的制备及分组[1-2]无菌环境下,充分漂洗软骨组织标本,用眼科剪剪碎至1 mm3大小。并依次用0.25%的胰蛋白酶及0.20%的胶原酶分别消化30 min 及2 h。获得单细胞悬液后,用10%胎牛血清的DMEM/F-12培养基重悬细胞,37 ℃和5% CO2培养箱中培养,约4~5 d细胞开始融合,实验使用第2~3代细胞。细胞分为OA组及Sirt1激动剂白藜芦醇组(白藜芦醇组)。
1.2.5单丹磺酰尸胺(MDC)染色细胞自噬囊泡体能与MDC特异性结合,在荧光显微镜下呈蓝色。于6孔板中制备OA软骨细胞爬片,于37 ℃和5% CO2培养箱中培养24 h,再加入10 μmol/L白藜芦醇或不加任何刺激物进行干预培养24 h后,加入0.05 mmol/L MDC于37 ℃孵育15 min,磷酸盐缓冲液(PBS)洗涤3次,4%多聚甲醛固定15 min,PBS洗涤3次,并置于含有防荧光猝灭剂的载破片上,避光作用5~10 min后,荧光显微镜下观察拍照。

表1 RT-PCR引物
1.2.6烟酸已可碱(Hoechst)染色将OA软骨细胞培养于6孔板,于37 ℃和5% CO2培养箱中培养24 h后,加入10 μmol/L白藜芦醇或不加任何刺激物进行干预培养24 h,后按照Hoechst染色试剂盒说明书进行操作,染色,固定,显微镜下进行观察并拍照。
1.2.7Western blot检测将OA软骨细胞培养于6孔板,于37 ℃和5% CO2培养箱中培养24 h后,加入10 μmol/L白藜芦醇或不加任何刺激物进行干预培养24 h。收集细胞,加入裂解液裂解,冰浴30 min,每隔10 min震荡5 s,以1×104r/min 4 ℃离心15 min,获得蛋白样品。根据二喹啉甲酸(BCA)试剂盒对蛋白浓度进行测定。蛋白上样,十二烷基磺酸钠(SDS)凝胶电泳,后湿法转膜。将膜浸入一抗溶液孵育,4 ℃过夜;漂洗后,浸入二抗溶液(1∶100)中室温孵育1~2 h。将膜取出漂洗,在膜上滴加ECL曝光液,在凝胶成像系统中曝光。用“Quantity one”软件对各抗体条带灰度值进行统计。
1.2.8Caspase-3活性检测将OA软骨细胞培养于6孔板,于37 ℃和5% CO2培养箱中培养24 h后,加入10 μmol/L白藜芦醇或不加任何刺激物进行干预培养24 h,按Caspase-3分光光度法检测试剂盒进行检测。
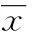
2结果
2.1Sirt1蛋白及mRNA在人OA软骨及正常软骨组织中的表达与正常软骨组织比较,OA软骨组织中Sirt1蛋白阳性表达显著降低(5.42±0.43vs.2.87±0.25),OA软骨组织中Sirt1 mRNA表达亦显著降低(0.98±0.09vs.0.38±0.06),差异均有统计学意义(P<0.01),见图1、2。

A:正常软骨组织;B:OA软骨组织。
图1Sirt1蛋白在人OA软骨及正常软骨组织中的表达

*:P<0.01,与正常软骨细胞比较。
图2Sirt1mRNA在人OA软骨及正常软骨组织中的表达
2.2OA软骨细胞及正常软骨细胞中自噬水平与正常软骨细胞比较,OA软骨细胞自噬水平降低[(30.45±5.17)%vs.(6.35±0.45)%,P<0.01],见图3。

A:正常软骨细胞;B:OA软骨细胞。
图3OA软骨细胞及正常软骨细胞中自噬水平
2.3OA软骨细胞中Sirt1表达自噬水平的相关性Person分析结果发现,OA软骨细胞中Sirt1表达量与自噬水平正相关(r=0.783,P<0.01)。

A:OA组;B:白藜芦醇组。
图4Sirt1表达上调后对OA软骨细胞凋亡的影响

*:P<0.01,与OA组比较。
图5Sirt1表达上调后对OA软骨细胞中自噬蛋白表达量的影响
2.4Sirt1表达上调后对OA软骨细胞中自噬水平的影响与OA软骨细胞组织比较,白藜芦醇刺激Sirt1表达上调后,OA软骨细胞自噬水平升高[(6.49±0.53)%vs.(26.89±3.12)%,P<0.01]。并使凋亡自噬基因Beclin-1及LC3蛋白及mRNA表达量上调(P<0.01),见图4、5。

A:OA组;B:白藜芦醇组。
图6Sirt1表达上调后对OA软骨细胞凋亡的影响
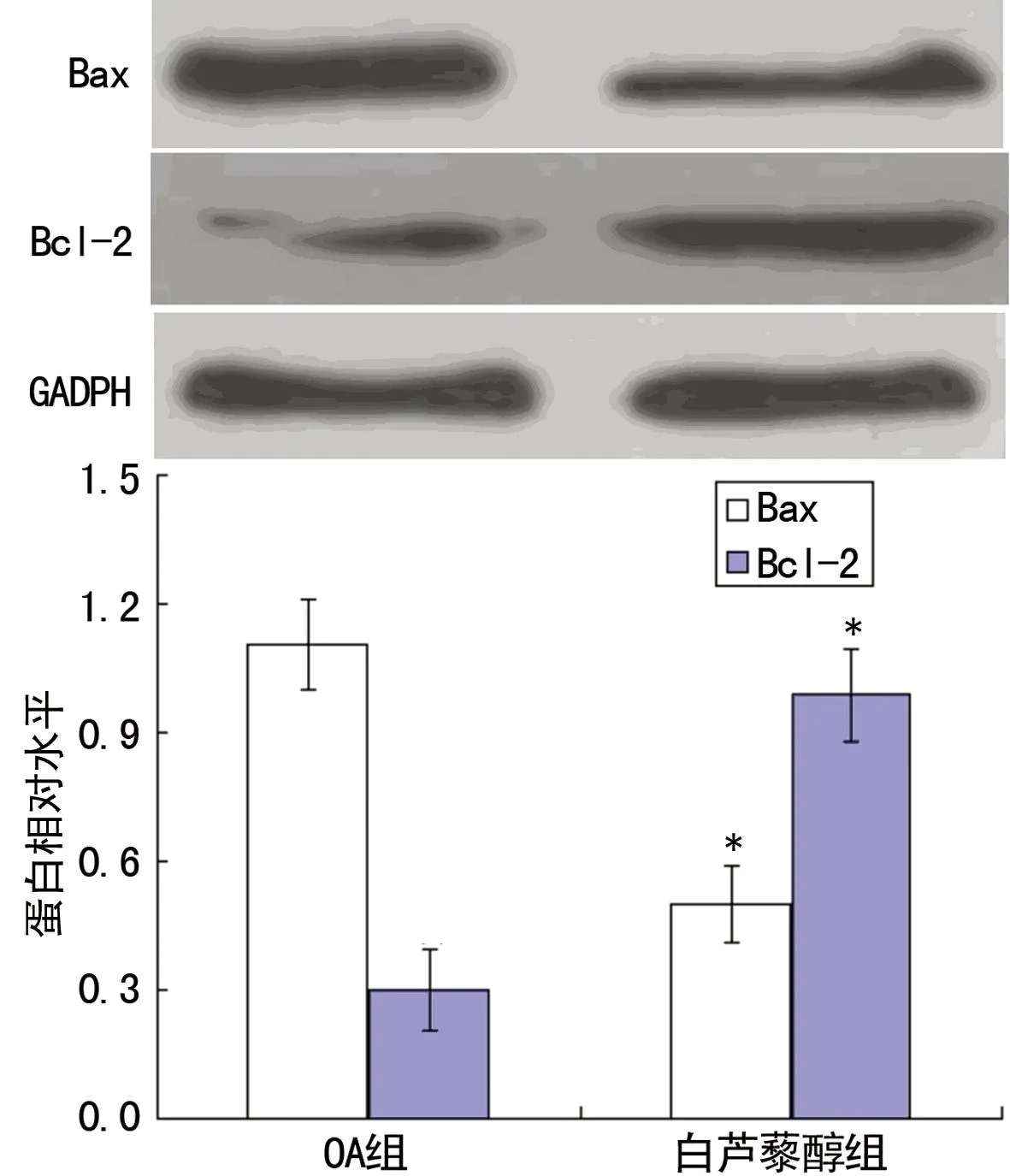
*:P<0.01,与OA组比较。
图7Sirt1表达上调后对OA软骨细胞中Bax及Bcl-2表达量的影响

*:P<0.01,与OA组比较。
图8Sirt1表达上调后对OA软骨细胞中>Caspase-3活性的影响

*:P<0.01,与OA组比较。
图9Sirt1表达上调后对OA软骨细胞mTOR信号通路的影响
2.5Sirt1表达上调后对OA软骨细胞凋亡的影响与OA软骨细胞组比较,白藜芦醇刺激Sirt1表达上调后,OA软骨细胞凋亡率显著下降[(28.71±3.24)%vs.(6.76±0.39)%,P<0.01)],并上调Bcl-2蛋白表达(P<0.01),下调Bax蛋白表达(P<0.01),抑制Caspase-3活性(P<0.01),见图6~8。
2.6Sirt1表达上调后对OA软骨细胞mTOR信号通路的影响与OA软骨细胞组比较,白藜芦醇刺激Sirt1表达上调后,OA软骨细胞中mTOR磷酸化水平显著降低(P<0.01),见图9。
3讨论
细胞自噬是生物体在生理或病理条件下的应激反应,可通过溶酶体清除受损或老化的细胞器,从而维持细胞内外环境稳定和代谢平衡。研究发现,自噬功能的缺失或增强,在神经性疾病、骨骼肌病变、肿瘤、炎症及衰老等病理过程中起着重要作用[6]。自噬也可称之为Ⅱ型程序性细胞死亡,参与OA软骨退变,Caramés等[10]研究发现小鼠OA模型中自噬相关蛋白ULK1,Beclin1,LC3的表达量减少。Almonte-Becerril等[11]通过免疫组织化学和Western blot证实动物OA模型中同时存在细胞凋亡及细胞自噬。后续的研究也证实通过提高OA自噬水平能显著的抑制OA软骨退变[12]。本研究结果与上述报道一致,OA软骨细胞中自噬水平显著低于正常软骨细胞。所以研究软骨细胞自噬作用机制有助于一步了解OA发病机制,同时也为OA治疗提供新的思路。
研究已证实Sirt1与OA的发生、发展密切相关。如Fujita等[13]证实OA关节软骨细胞比正常关节软骨细胞中表达量降低。与本研究结果相一致,在人OA软骨组织Sirt1表达量显著低于正常软骨组织。同时Matsuzaki等[14]证实Sirt1-CKO小鼠比野生型8周C57BL6/J小鼠更容易发展为OA,并伴随着胶原X,人基质金属蛋白酶13(MMP-13)水平的上升,提示软骨细胞中Sirt1的缺失加速小鼠OA模型的形成。Gabay 等[15]进一步证实Sirt1 KO小鼠软骨表达发生变化,凋亡程度提高,软骨退变加速。Gagarina等[16]证实Sirt1能促进OA软骨特异性基因表达。说明Sirt1在OA中起着保护性作用。本研究进一步通过Person分析发现,OA软骨中Sirt1低表达水平与低自噬水平正相关,同时Marino等[9]提出Sirt1能通过调节自噬蛋白乙酰化水平或蛋白水平来调控细胞的自噬水平。Powell等[17]进一步研究Sirt1促进前列腺癌细胞自噬体成熟。从而说明OA中Sirt1不仅与软骨自噬水平相关,还可参与调控软骨细胞自噬。所以,在此基础上本研究进一步探讨Sirt1对于OA自噬水平的调控作用。
Li等[18]证实白藜芦醇通过提高OA小鼠中Sirt1活性,降低缺氧诱导因子2α(HIF-2α),MMP13及一氧化氮合成酶(iNOS)表达,从而抑制OA小鼠软骨退变。siRNA干扰人软骨细胞中Sirt1的表达,促使TUNEL阳性细胞数目,聚ADP核糖聚合酶(PARP)及Caspases-3,9片段数量,Bax表达量都显著提高,Bcl-2表达量下降,而白藜芦醇激活Sirt1表达,能扭转此变化[19]。从而说明Sirt1有可能通过上调OA软骨细胞自噬水平,达到抑制软骨细胞凋亡的作用。因此本研究采用Sirt1激动剂白藜芦醇干预OA软骨细胞,结果表明白藜芦醇能使OA软骨细胞自噬水平显著提高,同时自噬蛋白Beclin1及LC3表达量显著上调。进一步检测OA凋亡情况,结果表明OA软骨细胞凋亡率下降。Bax表达量显著降低,Bcl-2表达量显著上升,Caspase-3活性下降,说明Sirt1能通过调节OA软骨细胞自噬水平影响OA软骨细胞凋亡。
细胞的自噬作用受多种信号通路的影响,如丝裂原活化蛋白激酶(MAPK)信号通路,mTOR信号通路,Bcl-2信号通路等。其中mTOR信号研究最为广泛,已经证实mTOR信号通路能调控肾脏上皮细胞,心肌细胞,神经胶质细胞,肿瘤细胞,淋巴细胞等多种细胞中自噬功能的产生[20]。Bohensky等[21]证实通过HIF/AMPK/mTOR信号途径调节软骨细胞自噬。Caramés等[22]研究证实mTOR抑制剂雷帕霉素可以通过诱导自噬起到保护OA软骨的作用。Zhang等[23]也发现通过阻断mTOR信号通路可以防止大鼠OA的发生。因此本研究探讨了白藜芦醇刺激OA软骨Sirt1表达上调后,mTOR信号通路的激活情况,结果表明白藜芦醇干预后,OA软骨细胞中mTOR磷酸化水平显著提高。同时mTOR信号通路对细胞增殖也具有调控作用[24]。并且Zhao等[25]证实外源性刺激单倍体干细胞能促进Sirt1表达,且是通过mTOR通路产生的,而单倍体干细胞中Sirt1敲除后,会导致细胞凋亡并伴随p53及Caspase-3的激活。从而推测Sirt1不仅通过阻断mTOR信号通路来干扰OA软骨细胞的自噬水平,也通过此信号通路来干预OA软骨细胞凋亡情况。
综上所述,Sirt1在OA软骨组织中低表达,并与软骨细胞自噬水平正相关,通过上调Sirt1表达水平,可显著上调OA软骨细胞自噬水平,并进一步抑制细胞凋亡及调控凋亡相关蛋白的表达,此过程可能与mTOR信号通路有关。
参考文献
[1]Zhang XH,Xu XX,Xu T.Ginsenoside Ro suppresses interleukin-1beta-induced apoptosis and inflammation in rat chondrocytes by inhibiting NF-kappaB[J].Chin J Nat Med,2015,13(4):283-289.
[2]Zhang X,Xu X,Xu T,et al.beta-Ecdysterone suppresses interleukin-1 beta-induced apoptosis and inflammation in rat chondrocytes via inhibition of NF-kappaB signaling pathway[J].Drug Dev Res,2014,75(3):195-201.
[3]Musumeci G,Szychlinska MA,Mobasheri A.Age-related degeneration of articular cartilage in the pathogenesis of osteoarthritis:molecular markers of senescent chondrocytes [J].Histol Histopathol,2015,30(1):1-12.
[4]张谢卓,徐超,伊力哈木·托合提.自噬与软骨细胞生存及软骨损伤[J].中国组织工程研究,2015,19(20):3236-3241.
[5]杨戈,林达生,练克俭.自噬与骨组织细胞及骨类疾病[J].国际骨科学杂志,2014,35(3):181-183.
[6]余小艳,张艳林,曹勇军,等.组蛋白脱乙酰酶SIRT1与细胞自噬[J].中国病理生理杂志,2013,29(8):1520-1524.
[7]Dvir-Ginzberg M,Steinmeyer J.Towards elucidating the role of SirT1 in osteoarthritis[J].Front Biosci (Landmark Ed),2013,18:343-355.
[8]Lim HD,Kim YS,Ko SH,et al.Cytoprotective and anti-inflammatory effects of melatonin in hydrogen peroxide-stimulated CHON-001 human chondrocyte cell line and rabbit model of osteoarthritis via the SIRT1 pathway[J].J Pineal Res,2012,53(3):225-237.
[9]Marino G,Morselli E,Bennetzen MV,et al.Longevity-relevant regulation of autophagy at the level of the acetylproteome[J].Autophagy,2011,7(6):647-649.
[10]Caramés B,Taniguchi N,Otsuki S,et al.Autophagy is a protective mechanism in normal cartilage,and its aging-related loss is linked with cell death and osteoarthritis [J].Arthritis Rheum,2010,62(3):791-801.
[11]Almonte-Becerril M,Navarro-Garcia F,Gonzalez-Robles A,et al.Cell death of chondrocytes is a combination between apoptosis and autophagy during the pathogenesis of osteoarthritis within an experimental model [J].Apoptosis,2010,15(5):631-638.
[12]Barranco C.Osteoarthritis:activate autophagy to prevent cartilage degeneration? [J].Nat Rev Rheumatol,2015,11(3):127.
[13]Fujita N,Matsushita T,Ishida K,et al.Potential involvement of SIRT1 in the pathogenesis of osteoarthritis through the modulation of chondrocyte gene expressions [J].J Orthop Res,2011,29(4):511-515.
[14]Matsuzaki T,Matsushita T,Takayama K,et al.Disruption of Sirt1 in chondrocytes causes accelerated progression of osteoarthritis under mechanical stress and during ageing in mice [J].Ann Rheum Dis,2014,73(7):1397-1404.
[15]Gabay O,Zaal KJ,Sanchez C,et al.Sirt1-deficient mice exhibit an altered cartilage phenotype[J].Joint Bone Spine,2013,80(6):613-620.
[16]Gagarina V,Gabay O,Dvir-Ginzberg M,et al.SirT1 enhances survival of human osteoarthritic chondrocytes by repressing protein tyrosine phosphatase 1B and activating the insulin-like growth factor receptor pathway [J].Arthritis Rheum,2010,62(5):1383-1392.
[17]Powell MJ,Casimiro MC,Cordon-Cardo C,et al.Disruption of a Sirt1-dependent autophagy checkpoint in the prostate results in prostatic intraepithelial neoplasia lesion formation [J].Cancer Res,2011,71(3):964-975.
[18]Li W,Cai L,Zhang Y,et al.Intra-articular resveratrol injection prevents osteoarthritis progression in a mouse model by activating SIRT1 and thereby silencing HIF-2alpha [J].J Orthop Res,2015,33(7):1061-1070.
[19]Takayama K,Ishida K,Matsushita T,et al.SIRT1 regulation of apoptosis of human chondrocytes [J].Arthritis Rheum,2009,60(9):2731-2740.
[20]Kim YC,Guan KL.mTOR:a pharmacologic target for autophagy regulation [J].J Clin Invest,2015,125(1):25-32.
[21]Bohensky J,Leshinsky S,Srinivas V,et al.Chondrocyte autophagy is stimulated by HIF-1 dependent AMPK activation and mTOR suppression[J].Pediatr Nephrol,2010,25(4):633-642.
[22]Caramés B,Hasegawa A,Taniguchi N,et al.Autophagy activation by rapamycin reduces severity of experimental osteoarthritis [J].Ann Rheum Dis,2012,71(4):575-581.
[23]Zhang Y,Vasheghani F,Li YH,et al.Cartilage-specific deletion of mTOR upregulates autophagy and protects mice from osteoarthritis [J].Ann Rheum Dis,2015,74(7):1432-1440.
[24]Rostaing L,Kamar N.mTOR inhibitor/proliferation signal inhibitors:entering or leaving the field? [J].J Nephrol,2010,23(2):133-142.
[25]Zhao H,Yang L,Cui H.SIRT1 regulates autophagy and diploidization in parthenogenetic haploid embryonic stem cells [J].Biochem Biophys Res Commun,2015,464(4):1163-1170.
作者简介:李春亮(1978-),主治医师,硕士,主要从事四肢创伤研究。 △通讯作者,E-mail:lizhaowei5120@sina.com。
doi:·经验交流·10.3969/j.issn.1671-8348.2016.15.029
[中图分类号]R684.3
[文献标识码]B
[文章编号]1671-8348(2016)15-2118-05
(收稿日期:2015-11-08修回日期:2016-02-11)
