多发性硬化与视神经脊髓炎患者磁共振检查的对比研究
2016-08-05陈培材饶俊平宋宏中余利生罗凌云戴永强
陈培材 饶俊平 宋宏中 余利生 罗凌云 戴永强
多发性硬化与视神经脊髓炎患者磁共振检查的对比研究
陈培材饶俊平宋宏中余利生罗凌云戴永强
514000 梅州,中山大学附属第三医院粤东医院神经内科(陈培材,饶俊平,宋宏中,余利生,罗凌云);510630 广州,中山大学附属第三医院神经内科(戴永强)
【摘要】目的探讨MRI对多发性硬化(MS)和视神经脊髓炎(NMO)的鉴别价值。方法 92例MS患者(MS组)和57例NMO患者(NMO组)在发病急性期(发病30 d内)均接受了头颅MRI扫描,其中49例MS患者和57例NMO患者还接受了全脊髓MRI扫描,比较2组MRI表现的差异。结果MS患者和NMO患者的MRI表现存在多种差异,NMO组头颅病灶的检出率明显低于MS组(57.89% vs.96.74%,P<0.05)。相比NMO组,MS组更多患者符合Barkhof空间多发标准(59.78% vs.8.77%,P<0.05)。NMO组强化病灶、皮层下病灶、小脑病灶出现率均少于MS组(P均<0.05)。NMO患者脊髓病灶的出现率、出现强化、脊髓肿胀率及线样征的出现率均高于MS组,病灶纵向长度明显超过MS患者(P均<0.05)。结论MRI对MS和NMO有较高的鉴别价值。
【关键词】多发性硬化;视神经脊髓炎;磁共振检查
多发性硬化(MS)和视神经脊髓炎(NMO)是不同的中枢神经系统炎性脱髓鞘疾病。既往NMO曾被认为是MS的亚型,表明两者存在很多相似之处,特别在临床症状不典型时或疾病早期,MS与NMO难以鉴别[1]。近年来随着研究的进展,不少学者发现两者在发病机制、临床表现、影像学、预后等多方面存在差异[2]。其中MRI在MS与NMO的诊断和鉴别诊断中发挥着重要的作用。作为炎性脱髓鞘疾病,MS与NMO的病灶可以广泛存在于中枢神经系统的各个部位,包括大脑、视神经和脊髓。既往有关MS与NMO的MRI研究多局限于某个特定部位[3-4]。在本研究中,笔者将全面比较MS与NMO患者头颅和脊髓MRI病灶的差异,寻找两者的鉴别要点。
对象与方法
一、研究对象
连续收集2010年1月至2015年10月在中山大学附属第三医院粤东医院和中山大学附属第三医院神经内科住院的MS患者92例(MS组)、NMO患者57例(NMO组)作为研究对象,分别符合2010年McDonald的MS诊断标准和2006年Wingerchuk的NMO诊断标准。
二、方法
在发病急性期(发病30 d内),对所有患者进行头颅MRI检查(美国GE公司1.5T磁共振仪),扫描层面3~5 mm,参数为:T1加权像及增强像(400/15.5 ms, TR/TE),T2加权像(2 500~3 500/100 ms, TR/TE),液体衰减反转恢复序列(FLAIR)(8 800/120 ms, TR/TE)。其中49例MS患者和57例NMO患者还接受了全脊髓MRI扫描。比较2组患者的一般情况以及颅脑MRI病灶分布部位、脊髓MRI病灶长度、MRI病灶形态特点、是否有强化等。
三、统计学处理
结果
一、MS组与NMO组基本临床资料比较
2组均以女性患者为多,与MS组相比,NMO组女男比例更高、病情严重程度更重(P均<0.05),在年龄和病程上2组间比较差异无统计学意义(P均>0.05)。

表1 MS组与NMO组基本临床资料比较
注:aEDSS为扩展残疾状态量表
二、MS组与NMO组头颅MRI检查结果比较
NMO组头颅MRI病灶的检出率虽然明显低于MS组(P<0.05),但也达到了57.89%,多数不具有MS典型病灶的特点,而具有NMO典型特点的病灶在MS和NMO患者中均非常少见。相比NMO组,MS组更多患者符合Barkhof空间多发标准(P<0.05)。NMO组强化病灶、皮层下病灶、小脑病灶出现率均少于MS组(P均<0.05)。
三、MS组与NMO组脊髓MRI检查结果比较
49例MS患者中29例发现脊髓病灶,57例NMO患者中52例发现脊髓病灶,后者检出率明显高于前者(P<0.05)。另外NMO组出现强化及脊髓肿胀率均高于MS组,病灶纵向长度明显长于MS组,线样征的出现率较MS组更高(P均<0.05)。
讨论
通过本研究我们发现,MS患者和NMO患者的MRI病灶存在诸多不同。MS患者头颅MRI病灶出现率明显高于NMO患者,更加符合MS典型病灶特点和Barkhof空间多发标准;NMO患者脊髓MRI病灶的出现率和病灶长度明显超过MS患者,线样征的出现率更高。
与既往研究类似,MS患者头颅MRI异常率很高,达到96.74%。学者们最初认为,除了视神经炎和脊髓炎,NMO患者不应出现大脑、小脑和脑干损伤,但是近年的研究显示可有超过半数的NMO患者出现颅内病灶[5]。本研究中NMO患者颅内病灶出现率达到了57.89%,与近期的一些研究一致[5-6]。另外,MS患者有86.96%出现MS典型病灶,NMO患者仅有19.30%[7]。水通道蛋白4表达丰富的部位主要包括第三、四脑室周围和下丘脑,位于这些部位的病灶被视为NMO典型病灶,2组NMO典型病灶的出现率均低[6]。MS患者强化病灶的出现率为31.52%,NMO患者仅为7.02%。从病灶具体分布来看,MS患者侧脑室旁和皮层下病灶的出现率明显高于NMO,小脑病灶的出现率与NMO患者也有差异。由上可见,鉴别MS、NMO的MRI差异要点在于是否出现MS典型病灶,而非NMO典型病灶,即出现了MS典型病灶则高度提示患MS,而出现NMO典型病灶对两者的鉴别价值不大。在病灶分布上,位于侧脑室旁和皮层下的病灶对两者的鉴别具有重大意义。2组视神经病灶的出现率均低,不排除我们未单独进行视神经的MRI扫描所致。近期一项研究显示,20例MS患者和11例NMO患者共有59只眼的视神经出现MRI病灶[3]。

表2 MS组与NMO组头颅MRI病灶特点比较 例(%)
注:aMS典型病灶,位于侧脑室旁,呈圆形或卵圆形,直径≥3 mm,与侧脑室垂直分布。bNMO典型病灶,第三、四脑室周围和下丘脑的脱髓鞘病灶。cBarkhof空间多发标准,至少满足以下4项中的3项:①1个普通钆增强的病灶或9个T2高信号病灶;②至少1个幕下病灶;③至少1个近皮质病灶;④至少3个脑室周围病灶。同时病灶直径在3 mm以上,1个脊髓增强病灶等同于1个颅内增强病灶,1个脊髓T2病灶等同于1个颅内病灶
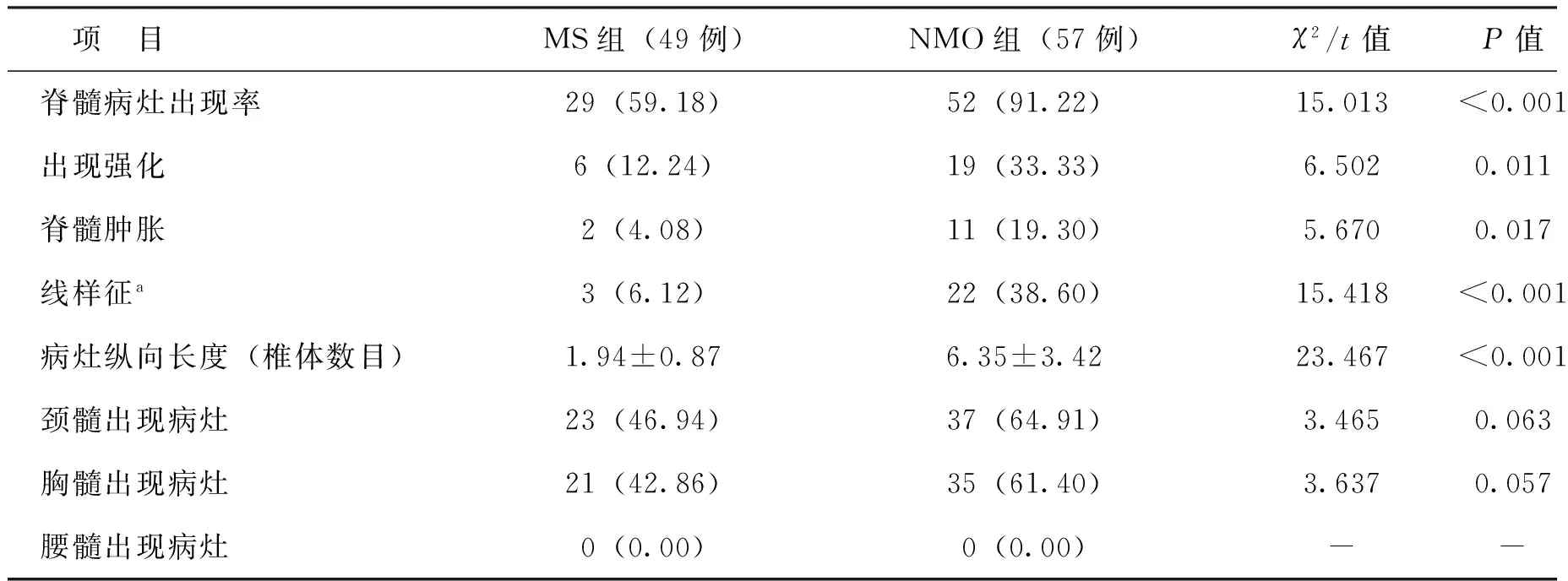
表3 MS组与NMO组脊髓MRI病灶特点比较 例(%)
注:a线样征指同时在MRI矢状位和横断面同时出现以下特征的病灶,①矢状位显示为呈线样的连续病灶;②横断面显示为主要侵犯中央灰质、对称性的病灶
本研究中MS患者脊髓病灶的出现率尽管低于NMO,但也达到了59.18%。在出现强化和脊髓肿胀方面,NMO患者的出现率均高于MS患者。NMO患者线样征的出现率明显高于MS患者,提示线样征对两者的鉴别意义重大,近期有研究显示线样征还能在疾病早期对NMO进行鉴别诊断[8]。从病灶长度来看,NMO患者病灶纵向长度明显长于MS患者,这与NMO的诊断标准一致,长脊髓病灶高度提示为NMO[2]。
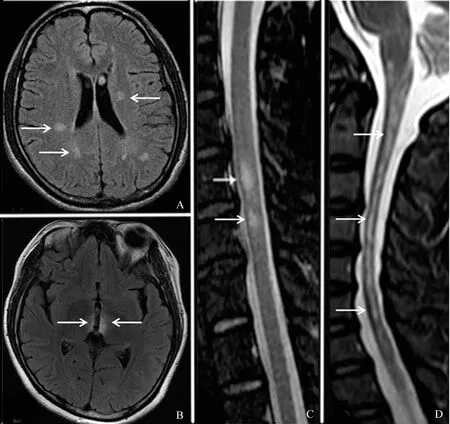
图1 MS与NMO患者头颅及脊髓MRI表现
A:MS头颅典型病灶,位于侧脑室旁,呈圆形或卵圆形;B:NMO头颅典型病灶,双侧下丘脑受累;C:MS脊髓病灶,长度较短,偏心分布;D:NMO脊髓病灶,长度大于3个脊椎节段,位于脊髓中心,线样分布
本研究中59.78%的MS患者符合Barkhof空间多发标准,NMO患者仅有8.77%。2016年最新的MS影像学诊断标准有了很大的简化,在空间多发方面,满足以下5条中的2条即可:①3个或以上侧脑室周围病变;②1个或多个幕下病变;③1个或多个脊髓病变;④1个或多个视神经病变;⑤1个或多个皮质、皮质下病变[9]。与Barkhof空间多发标准相比,2016年的新标准在发病部位上增加了视神经,从4个部位变成5个,而满足多发的条件从3个减少为2个。由于本研究未单独对视神经进行MRI扫描,因此不能统计符合新标准的几率。近期国内一项研究显示,MS和NMO患者接受视神经MRI扫描,均具有很高的病灶检出率[3]。本研究NMO患者脊髓病灶出现率达91.22%,头颅病灶出现率达57.89%,这些均提示NMO患者很容易达到新诊断标准的空间多发要求。西方人群的NMO发病率很低,约占中枢神经系统脱髓鞘疾病的1%~2%,而在亚洲国家可达20%~48%,本研究连续入组的NMO患者例数也达到了38.26%(57/149)。因此,新诊断标准适合应用于NMO发病率低的西方人群,在应用于NMO发病率相对高的亚洲人群时应谨慎[10-12]。而由于Barkhof空间多发标准的条件更加严格,在本研究中其对MS和NMO的鉴别有较大的价值。
综上所述,MS和NMO患者MRI表现存在不少差异,MS患者头颅病灶出现率、符合Barkhof空间多发标准的几率明显高于NMO患者,NMO患者脊髓病灶的出现率、线样征的出现率和脊髓病灶长度明显超过MS患者,对两者的鉴别有重要意义。但是对于NMO高发的地区,不能简单套用影像学诊断标准,还需结合临床表现及其他检查对两者作进一步的鉴别。
参考文献
[1]Mealy MA, Wingerchuk DM, Greenberg BM, Levy M. Epidemiology of neuromyelitis optica in the Unitied States:a multicenter analysis. Arch Neurol, 2012,69(9):1176-1180.
[2]Wingerchuk DM, Lennon VA, Pittock SJ, Lucchinetti CF, Weinshenker BG. Revised diagnostic criteria for neuromyelitis optica. Neurology,2006,66(10):1485-1489.
[3]秦军,高勇安,秦文.多发性硬化和视神经脊髓炎视神经病变MRI研究.临床放射学杂志,2015,34(3):337-340.
[4]胡冰,杨洋,邹艳,康庄,邝思驰,罗琳,沈敏,单鸿.磁共振波谱和扩散张量成像对多发性硬化的诊断.新医学,2010,41(10):640-644.
[5]Kim SH, Kim W, Li XF, Jung IJ, Kim HJ. Clinical spectrum of CNS aquaporin-4 autoimmunity.Neurology,2012,78(15):1179-1185.
[6]Rueda Lopes FC, Doring T, Martins C, Cabral FC, Malfetano FR, Pereira VC, Alves-Leon S, Gasparetto EL.The role of demyelination in neuromyelitis optica damage: diffusion-tensor MR imaging study.Radiology,2012,263(1):235-242.
[7]Matsushita T, Matsuoka T, Ishizu T, Kikuchi H, Osoegawa M, Kawano Y, Mihara F, Ohyagi Y, Kira J. Anterior periventricular linear lesions in optic-spinal multiple sclerosis: a combined neuroimaging and neuropathological study. Mult Scler, 2008,14(3):343-353.
[8]Cai W, Tan S, Zhang L, Shan Y, Wang Y, Lin Y, Zhou F, Zhang B, Chen X, Zhou L, Wang Y, Huang X, Men X, Li H, Qiu W, Hu X, Lu Z. Linear lesions may assist early diagnosis of neuromyelitis optica and longitudinally extensive transverse myelitis, two subtypes of NMOSD. J Neurol Sci,2016,15(360):88-93.
[9]Filippi M, Rocca MA, Ciccarelli O, De Stefano N, Evangelou N, Kappos L, Rovira A, Sastre-Garriga J, Tintorè M, Frederiksen JL, Gasperini C, Palace J, Reich DS, Banwell B, Montalban X, Barkhof F;MAGNIMS Study Group. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurol,2016,15(3):292-303.
[10]Cossburn M, Tackley G, Baker K, Ingram G, Burtonwood M, Malik G, Pickersgill T, te Water Naudé J, Robertson N. The prevalence of neuromyelitis optica in South East Wales. Eur J Neurol,2012,19(4):655-659.
[11]Asgari N, Lillevang ST, Skejoe HP, Falah M, Stenager E, Kyvik KO.A population-based study of neuromyelitis optica in Caucasians.Neurology,2011,76(18):1589-1595.
[12]Pandit L, Kundapur R.Prevalence and patterns of demyelinating central nervous system disorders in urban Mangalore, South India.Mult Scler,2014,20(12):1651-1653.
(本文编辑:洪悦民)

DOI:10.3969/j.issn.0253-9802.2016.07.008
通信作者,戴永强,E-mail:dyq_ny@163.com
(收稿日期:2016-04-10)
Study of magnetic resonance imaging on differential diagnosis between multiple sclerosis and neuromyelitis optica
ChenPeicai,RaoJunping,SongHongzhong,YuLisheng,LuoLingyun,DaiYongqiang.
DepartmentofNeurology,YueDongHospitaloftheThirdAffiliatedHospitalofSunYat-senUniversity,Meizhou514000,ChinaCorrespondingauthor,DaiYongqiang,E-mail:dyq_ny@163.com
【Abstract】ObjectiveTo evaluate the differential diagnostic value of magnetic resonance imaging (MRI) between multiple sclerosis (MS) and neuromyelitis optica(NMO). MethodsNinety two MS (MS group) and 57 NMO patients (NMO group)underwent head MRI during the acute onset stage (within 30 d after onset). Among them, 49 MS and 57 NMO cases received spinal MRI. The MRI characteristics between two groups were statistically compared. ResultsThe MRI findings significantly differed between the MS and NMO patients. Compared with the NMO group, MS patients had a significantly higher risk of brain lesion (96.74% vs. 57.89%, P<0.05), and a significantly higher proportion of MS patients met Barkhof criteria (59.78% vs. 8.77%, P<0.05).The incidence of enhanced lesion, subcortical lesion and cerebellar lesion in the NMO group was considerably lower compared with that in the MS group (all P<0.05). Compared with MS patents, NMO counterparts had a significantly higher incidence of spinal cord lesion, enhanced lesion, spinal cord edema and string signs and a considerably larger vertical diameter of the lesion (all P<0.05). ConclusionMRI examination is of clinical significance in the differential diagnosis between MS and NMO.
【Key words】Multiple sclerosis; Neuromyelitis optica; Magnetic resonance imaging
