PRC1高表达与前列腺癌生化复发的相关性研究
2016-08-05韩兆冬罗宏伟林卓远梁应科陈果吴永定何慧婵
韩兆冬 罗宏伟 林卓远 梁应科 陈果 吴永定 何慧婵
PRC1高表达与前列腺癌生化复发的相关性研究
韩兆冬罗宏伟林卓远梁应科陈果吴永定何慧婵
510180 广州,广州市第一人民医院泌尿外科(韩兆冬),中心实验室(韩兆冬,罗宏伟,林卓远,梁应科,陈果,吴永定);510230 广州,广州医科大学附属第一医院 广东省泌尿外科重点实验室(何慧婵)
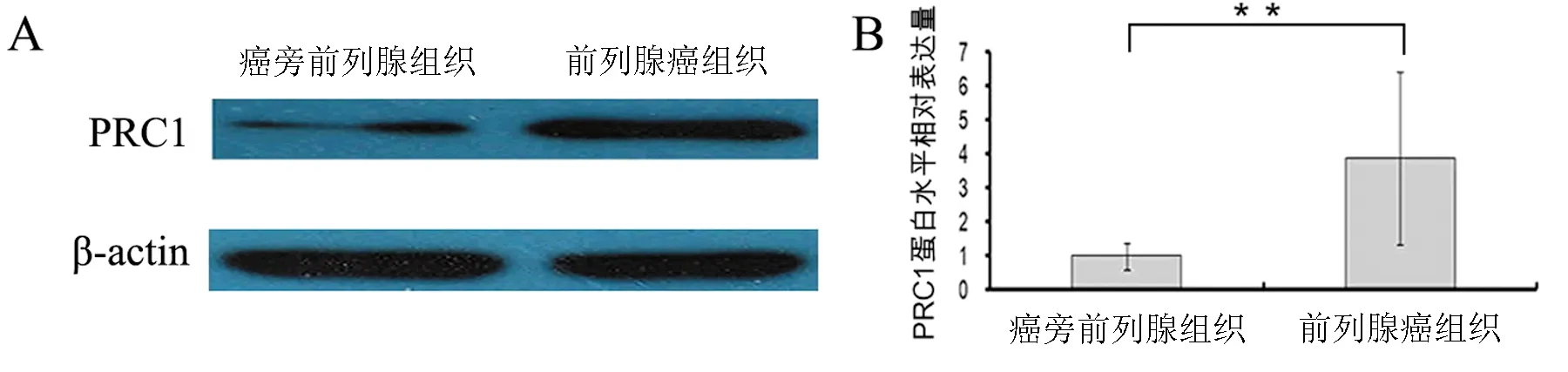
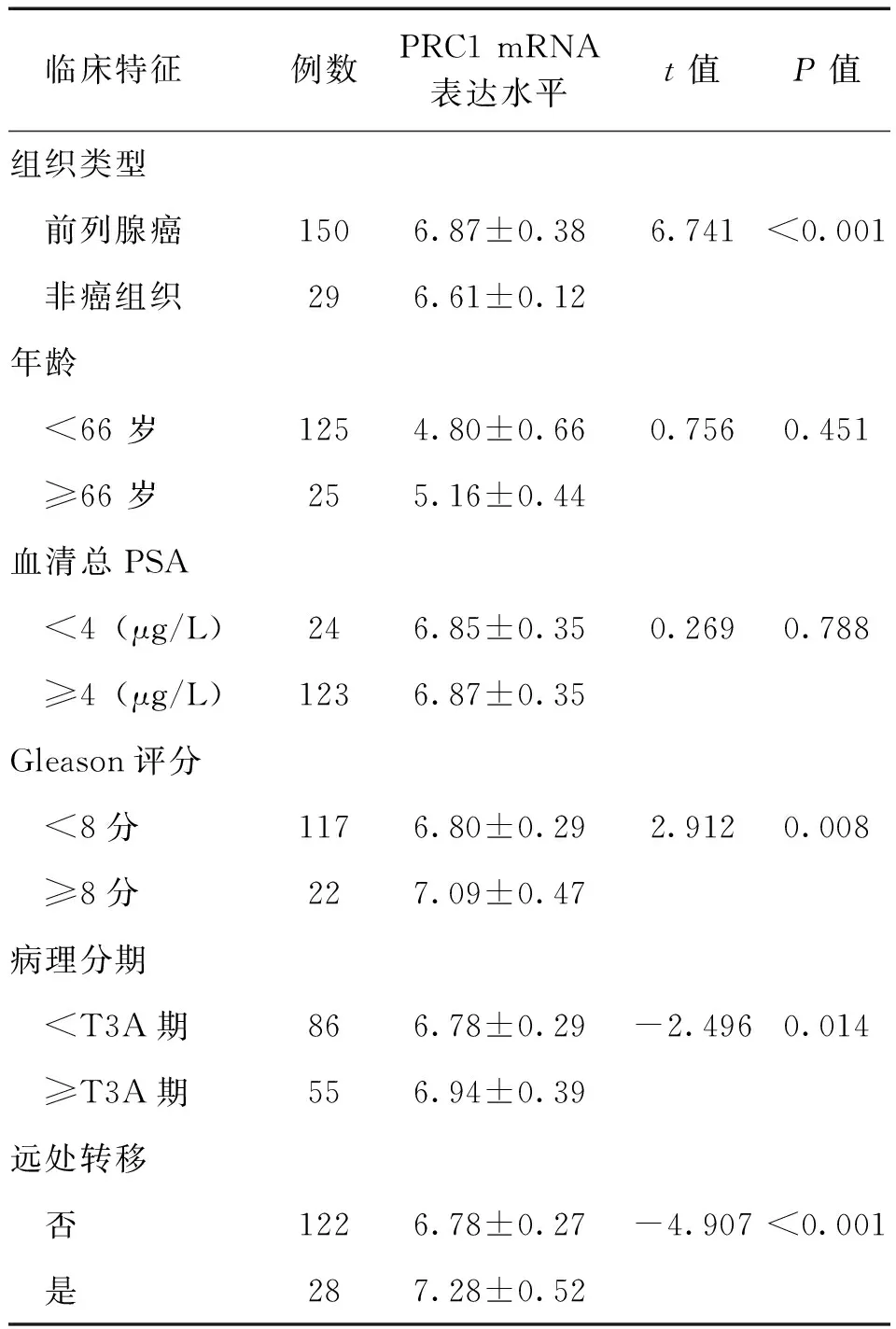
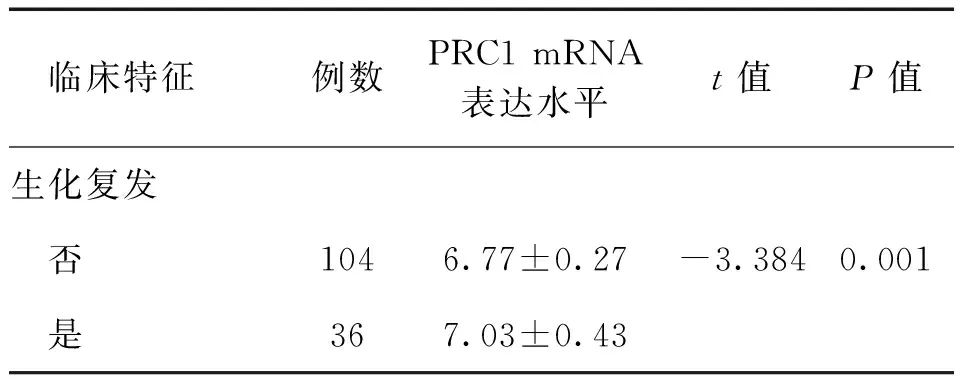
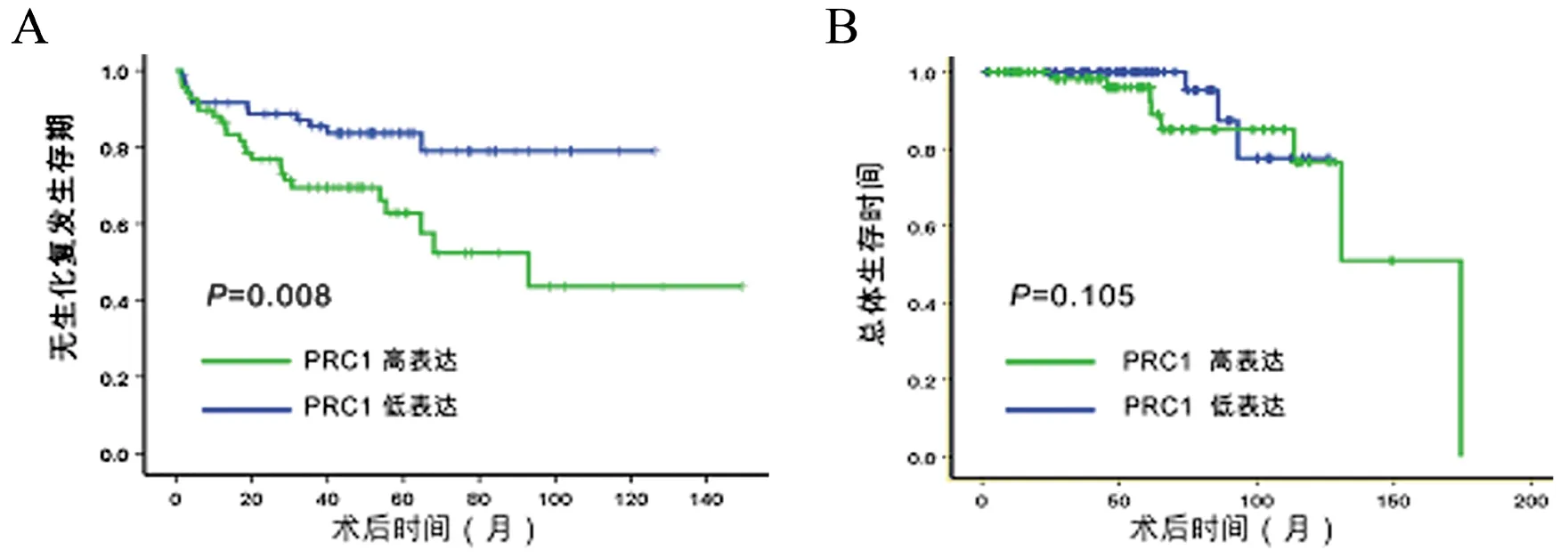
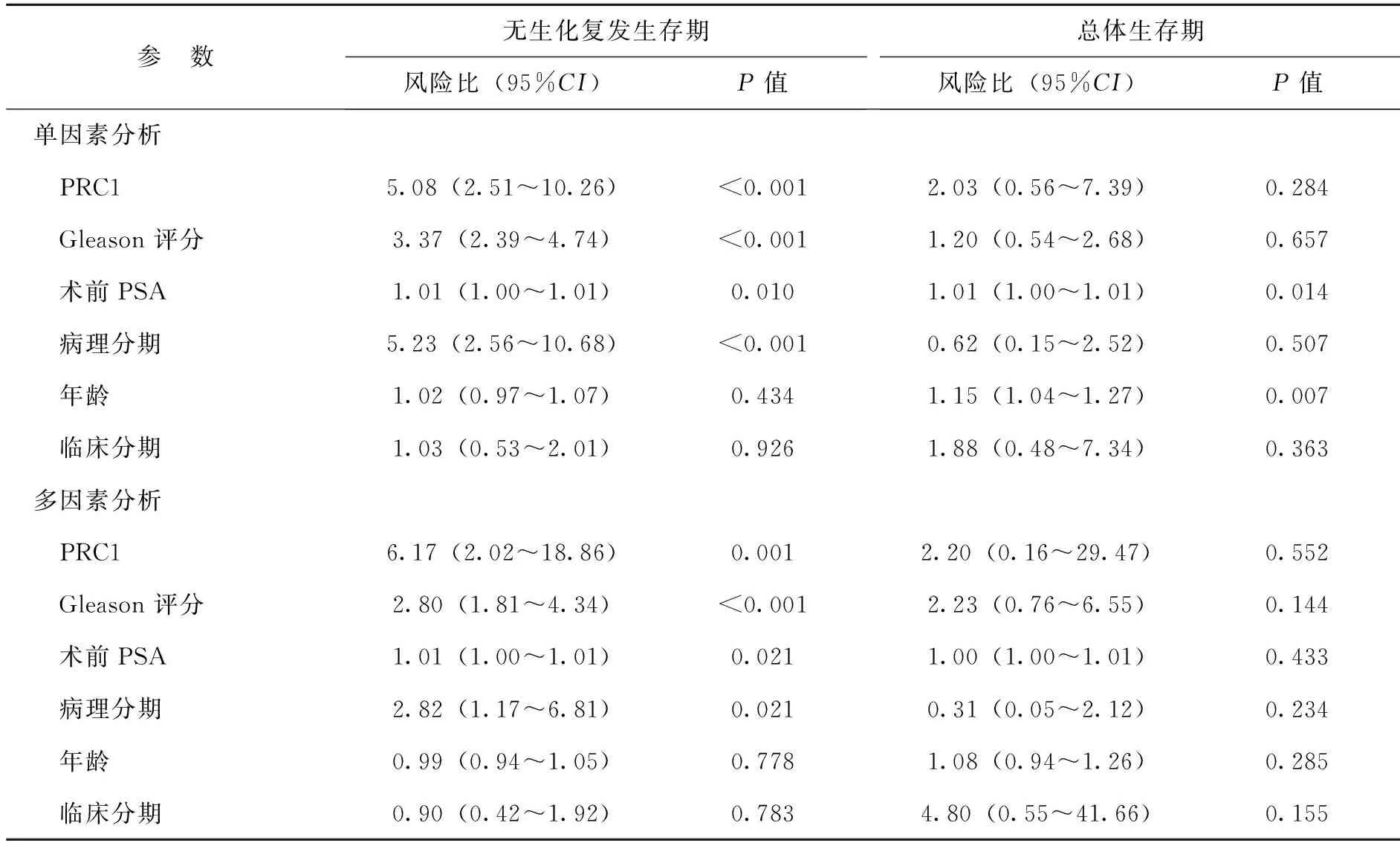
【摘要】目的研究细胞质分裂调控蛋白1(PRC1)在前列腺癌中的表达情况及其与生化复发的相关性。方法采用实时定量PCR及蛋白免疫印迹法检测PRC1在前列腺癌与癌旁前列腺组织的表达水平,并利用Taylor基因芯片数据库对PRC1基因mRNA水平进行验证。Kaplan-Meier法分析前列腺癌患者总体生存率及生化复发时间与PRC1 mRNA表达水平之间的关系。Cox回归分析临床病理特征与生化复发的相关性。结果12对前列腺癌及癌旁前列腺组织中,前列腺癌的PRC1 mRNA及蛋白表达均高于癌旁前列腺组织(P均<0.01)。Taylor基因芯片数据库分析显示,PRC1在前列腺癌组织中的表达水平高于非癌组织(P<0.001),且出现生化复发或转移、Gleason评分高、临床分期≥T3A期者的PRC1 mRNA表达水平高于无出现生化复化或转移、Gleason评分低、临床分期 【关键词】细胞质分裂调控蛋白1;前列腺癌;生化复发;预后 材料与方法 一、材料 12对前列腺癌及癌旁前列腺组织来源于广州市第一人民医院,所有病例均为首次确诊并行前列腺癌根治术,术前均未行放射治疗或化学治疗。前列腺癌患者年龄(65.7±3.5)岁,按TNM分期T1 3例,T2 9例;Gleason评分<7分10例,≥7分2例;术前PSA<4 μg/L 2例,PSA≥4 μg/L 10例。 二、主要试剂及仪器 RNApure 高纯总RNA快速抽提试剂盒(离心柱型)购自北京百泰克生物技术有限公司,Trizol总RNA抽提试剂为美国Invitrogene公司产品,RNA逆转录试剂为日本Takara宝生物产品;PRC1兔抗人单克隆抗体为美国Abcam公司产品,β-actin抗体为美国Santa Cruz公司产品,SuperSignal®系列Western化学发光底物系统为美国Thermo Scientific公司产品;RotorGene 2000 system实时荧光定量PCR分析系统为澳大利亚Corbett Research产品。 三、方法 1. PRC1 mRNA表达水平的检测 采用实时定量PCR(RT-PCR)检测。提取前列腺癌及癌旁前列腺组织总RNA,取2 μg总RNA进行逆转录。PCR总体系20 μl,根据仪器提供的实验方案配制SYBR Green PCR Master Mix,β-actin作为内参,按PCR仪附带的实验方案操作。引物序列:PRC1上游 5’-CCTGTGCCTACTTTGCCTGA-3’,下游5’-CGTGGCTAACACCAAGTCCA-3’,产物长度304 bp;β-actin上游 5’-AGCGAGCATCCCCCAAAGTT-3’,下游5’-GGGCACGAAGGCTC ATCATT-3’,产物长度285 bp。PCR反应步骤:94℃预热10 min, 94℃ 15 s、56℃退火15 s,循环37次,72℃延伸45 s。根据标准曲线设定阈值,使用Rotor-Gene 5.0软件分析数据。 2. PRC1蛋白表达水平的检测 出现高温灾害4年,极端高温达到37.2℃,影响冬小麦灌浆和干物质积累,千粒重下降,造成逼熟空秕子多,因而减产。 采用蛋白免疫印迹法检测。从前列腺癌及癌旁前列腺组织中提取蛋白,取40 μg蛋白在十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)并转移至杂交硝酸纤维素膜上,然后以脱脂奶粉溶于Tris-HCl缓冲盐溶液,调节浓度至5%,封闭1 h,随后洗净膜并孵育PRC1抗体(1∶2 000)及β-actin抗体(1∶2 000),使用SuperSignal West PICO化学发光检测系统观察结果,β-actin作为内参蛋白。 3. Taylor数据库分析 由于纳入本研究的样本量较少,所以利用Taylor基因芯片数据库资料进行验证,并分析PRC1表达水平与前列腺癌临床病理特征关系。Taylor数据库[美国国立生物技术信息中心(NCBI)高通量基因数据表达平台(GEO),档案编号 GSE21032]是一个公用的数据平台,其中mRNA表达谱芯片包含带有临床随访数据的150例原发性前列腺癌及29例非癌组织。 四、统计学处理 结果 一、PRC1在前列腺癌及癌旁前列腺组织的mRNA及蛋白表达情况 12例前列腺癌及癌旁前列腺组织中,PRC1 mRNA在前列腺癌组织表达水平为9.22±2.28,比癌旁前列腺组织(1.04±0.29)上调(t=10.781,P<0.001),见图1; PRC1蛋白在前列腺癌组织的表达水平为3.89±2.55,比癌旁前列腺组织(1.00±0.39)增加(t=4.653,P<0.001),见图2。 图1 PRC1 mRNA在前列腺癌及 **P<0.01 二、PRC1与前列腺癌临床病理特征的关系 为进一步验证PRC1在前列腺癌中的表达情况,通过Taylor数据库检索发现PRC1在前列腺癌组织中的表达(6.87±0.38)高于非癌组织(6.61±0.12)(P<0.001),且出现生化复发或转移、Gleason评分高、临床分期≥T3A期者的PRC1 mRNA表达水平高于无出现生化复化或转移、Gleason评分低、临床分期 三、 PRC1与前列腺癌生化复发的相关性 以PRC1表达水平量的中位数为分割点,分成高表达组和低表达组。通过Kaplan-Meier 曲线分析Taylor数据库中前列腺癌患者总体生存率及生化复发时间与PRC1表达量之间的联系,高表达组的无生化复发率低于低表达组(P=0.008),而2组的总体生存率比较差异无统计学意义(P=0.105),见图3。此外,在单因素分析中,高表达组与低表达组在生化复发时间上比较差异有统计学意义(HR=5.08, 95%CI2.51~10.26,P<0.001)。在多因素分析中,高表达PRC1(HR=6.17, 95%CI2.02~18.86,P=0.001)、高Gleason评分(HR=2.80, 95%CI1.81~4.34,P<0.001)、术前高PSA水平(HR=1.01, 95%CI1.00~1.01,P=0.021)及高病理分期(HR=2.82, 95%CI1.17~6.81,P=0.021)均为生化复发的危险因素,见表2。 图2 PRC1蛋白在前列腺癌及癌旁前列腺组织的表达情况 A:蛋白免疫印迹法结果;B:定量分析结果,**P<0.01 表1 PRC1表达与前列腺癌临床特征的关系 续表 临床特征例数PRC1mRNA表达水平t值P值生化复发 否1046.77±0.27-3.3840.001 是367.03±0.43 注:因为数据库中有部分原始数据缺失,所以某些统计项目的纳入病例数不相同 图3 前列腺癌中PRC1表达相关的Kaplan-Meier曲线 A:生化复发时间比较;B:总体生存体率比较 表2 Cox风险预测模型中PRC1表达量对生化复发的诊断价值 讨论 前列腺癌是严重影响男性健康的恶性肿瘤,我国前列腺癌的发病率呈上升的趋势。前列腺癌的发生、发展是一个多阶段的过程,而且有不同的机制参与肿瘤的进展及预后。生化复发是前列腺癌根治术后疾病复发的早期表现,约17%~64%根治术后患者出现生化复发,其中约1/3发展为转移性前列腺癌[5]。Punnen等[6]提出生化复发与前列腺癌的进展及转移密切相关。因此,对生化复发的早期预测有助于观察前列腺癌的病情变化及指导进一步的治疗。 PRC1蛋白由620个氨基酸组成,主要在G2/M期表达,是细胞周期蛋白依赖性激酶的基质,参与纺锤体平行微丝及缩复环的形成,与细胞的有丝分裂密切相关[7-8]。PRC1基因被证实直接受抑癌基因p53的负性调控,在p53缺失的肿瘤细胞中,PRC1表达量明显增加[9]。Kanehira 等[10]在膀胱癌细胞株内发现PRC1表达量升高,沉默后可导致膀胱癌细胞的死亡。Espinosa等[11]发现PRC1在宫颈癌中高表达。临床研究发现,PRC1不仅可以作为预测肿瘤发生的因子,也是评估肿瘤预后及疗效的参考指标之一。有研究分析448例非小细胞肺癌化学治疗后基因变化,发现化学治疗后PRC1表达下调,提示PRC1 mRNA表达水平可预测患者预后[12]。Mustacchi等[13]发现,PRC1与早期乳腺癌的发生及患者的预后相关,检测PRC1有助于治疗方案的设计。但PRC1在前列腺癌中的表达情况,笔者尚未见相关报道。 本研究发现,前列腺癌中的PRC1在mRNA及蛋白表达水平均较癌旁前列腺组织明显升高,出现生化复发或转移、Gleason评分高、临床分期≥T3A期者的PRC1 mRNA表达水平高于无出现生化复化或转移、Gleason评分低、临床分期 综上所述,PRC1的表达增高与前列腺癌的恶性程度及生化复发密切相关,与现有的临床指标联合应用能更有效预测前列腺癌的预后。虽然PRC1的作用机制仍有待进一步研究,但我们的结果仍然有望为前列腺癌治疗提供新的研究方向。 参考文献 [1]Arsov C, Jankowiak F, Hiester A, Rabenalt R, Quentin M, Schimmöller L, Blondin D, Antoch G, Albers P. Prognostic value of a cell-cycle progression score in men with prostate cancer managed with activesurveillance after MRI-guided prostate biopsy——a pilot study.Anticancer Res,2014,34(5):2459-2466. [2]Sommariva S, Tarricone R, Lazzeri M, Ricciardi W, Montorsi F.prognostic value of the cell cycle progression score in patients with prostate cancer: a systematic review and meta-analysis.Eur Urol,2016,69(1):107-115. [3]Planas J, Morote J. Biochemical recurrence criteria after radical prostatectomy. Natural history of the disease.Arch Esp Urol,2012,65(1):4-11. [4]张增强,叶永康,黄亚强,吴永定,李牧,何慧婵. 人肌球蛋白轻链9在前列腺癌的表达水平及其对生化复发的预测价值.新医学,2015,46(11):732-736. [5]鲁欣,任善成,孙颖浩.前列腺癌根治术后生化复发的诊断和治疗.中华泌尿外科杂志, 2007, 28(12): 861-863. [6]Punnen S, Cooperberg MR, D’Amico AV, Karakiewicz PI, Moul JW, Scher HI, Schlomm T, Freedland SJ. Management of biochemical recurrence after primary treatment of prostate cancer: a systematic review of the literature. Eur Urol,2013,64(6):905-915. [7]Freedland SJ, Gerber L, Reid J, Welbourn W, Tikishvili E, Park J, Younus A, Gutin A, Sangale Z, Lanchbury JS, Salama JK, Stone S. Prognostic utility of cell cycle progression score in men with prostate cancer after primary external beamradiation therapy.Int J Radiat Oncol Biol Phys, 2013,86(5):848-853. [8]Shrestha S, Wilmeth LJ, Eyer J, Shuster CB.PRC1 controls spindle polarization and recruitment of cytokinetic factors during monopolar cytokinesis. Mol Biol Cell,2012,23(7):1196-1207. [9]Li C, Lin M, Liu J. Identification of PRC1 as the p53 target gene uncovers a novel function of p53 in the regulation ofcytokinesis. Oncogene, 2004,23(58):9336-9347. [10]Kanehira M, Katagiri T, Shimo A, Takata R, Shuin T, Miki T, Fujioka T, Nakamura Y.Oncogenic role of MPHOSPH1, a cancer-testis antigen specific to human bladder cancer.Cancer Res,2007,67(7):3276-3285. [11]Espinosa AM, Alfaro A, Roman-Basaure E, Guardado-Estrada M, Palma, Serralde C, Medina I, Juárez E, Bermúdez M, Márquez E, Borges-Ibáez M, Muoz-Cortez S, Alcántara-Vázquez A, Alonso P, Curiel-Valdez J, Kofman S, Villegas N, Berumen J.Mitosis is a source of potential markers for screening and survival and therapeutic targets in cervicalcancer.PLoS One, 2013;8(2):e55975. [12]Tang H, Xiao G, Behrens C, Schiller J, Allen J, Chow CW, Suraokar M, Corvalan A, Mao J, White MA, Wistuba II, Minna JD, Xie Y.A 12-gene set predicts survival benefits from adjuvant chemotherapy in non-small cell lung cancerpatients.Clin Cancer Res,2013,19(6):1577-1586. [13]Mustacchi G, Sormani MP, Bruzzi P, Gennari A, Zanconati F, Bonifacio D, Monzoni A, Morandi L.Identification and validation of a new set of five genes for prediction of risk in early breast cancer.Int J Mol Sci,2013,14(5):9686-9702. (本文编辑:林燕薇) DOI:10.3969/j.issn.0253-9802.2016.07.005 基金项目:广东省自然科学基金(2014A030310066);广州市卫生局一般引导项目(20141A010013);广东省科技计划项目(2013B021800055);广州市科技计划项目(2014J4100072) 通讯作者,何慧婵, E-mail:xiaohejian@21cn.com (收稿日期:2016-02-25) Correlation analysis between overexpression of protein regulator of cytokinesis 1 and biochemical recurrence of prostate cancer HanZhaodong,LuoHongwei,LinZhuoyuan,LiangYingke,ChenGuo,WuYongding,HeHuichan. DepartmentofUrology,GuangzhouFirstPeople’sHospital,GuangzhouMedicalUniversity,Guangzhou510180,ChinaCorrespondingauthor,HeHuichan,E-mail:xiaohejian@21cn.com 【Abstract】ObjectiveTo investigate the correlation between the expression level of protein regulator of cytokinesis 1 (PRC1) and biochemical recurrence of prostate cancer. MethodsThe expression levels of PRC1 protein and mRNA between the prostate cancer and adjacent benign tissues were statistically compared using Western blot and RT-PCR. The expression of PRC1 mRNA was validated by microarray-based Taylor database. Kaplan-Meier plot was performed to evaluate the overall survival and analyze the correlation between PRC1 expression and biochemical recurrence of prostate cancer. Cox proportional hazards regression model was utilized to assess the correlation between clinicopathological characteristics and biochemical recurrence of prostate cancer. ResultsAmong 12 pairs of prostate cancer and adjacent benign tissues, the expression levels of PRC1 protein and mRNA in the prostate cancer tissues were significantly higher than those in the adjacent benign prostate tissues (both P<0.01). Microarray-based Taylor database revealed that the expression of PRC1 in the cancer tissues was significantly up-regulated compared with that in the non-cancerous tissues (P<0.001). In addition, the expression of PRC1 mRNA in patients with biochemical recurrence or metastasis of prostate cancer, high Gleason score and clinical staging ≥T3A was significantly up-regulated compared with their counterparts with no biochemical recurrence or metastasis of prostate cancer, low Gleason score and clinical staging 【Key words】Protein regulator of cytokinesis 1; Prostate cancer; Biochemical recurrence; Prognosis