2016年高考框图题的命题角度预测
2016-08-04卞小峰
卞小峰

框图推断题是高考经典题型,通过框图推断题往往将基本理论联系起来考查,在复习中,精编框图题,适度开发、拓展,充分发挥其价值。本文通过自编框图题将高考主干基本理论联系起来,提升综合思维能力。
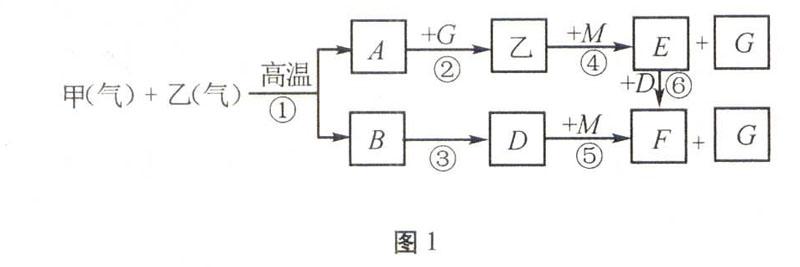
原创题图1为短周期元素组成的物质之间转化关系图,甲分子立体结构为正四面体形、乙分子为10电子分子,B与空气主要成分之一互为等电子体。回答相关问题:
图1 (1)在t℃(高于500℃)和相同压强下对反应B+乙A+D进行Ⅰ、Ⅱ、Ⅲ、Ⅳ四组实验,实验起始时放入容器内各组分的物质的量见表1。
①上述四种情况达到平衡后,n(D)的大小顺序是()。
A.Ⅱ=Ⅳ>Ⅲ=Ⅰ B.Ⅱ>Ⅳ>Ⅰ>Ⅲ
C.Ⅳ>Ⅱ>Ⅲ=Ⅰ D.Ⅳ>Ⅲ>Ⅱ>Ⅰ表1
B乙ADⅠa mola mol0 mol0 molⅡ2a mola mol0 mol0 molⅢ0 mol0 mola mola molⅣa mol0 mola mola mol②若实验Ⅰ在该条件下达到平衡时,平衡常数K=916,则B的转化率为 (可用分数表示)。图2
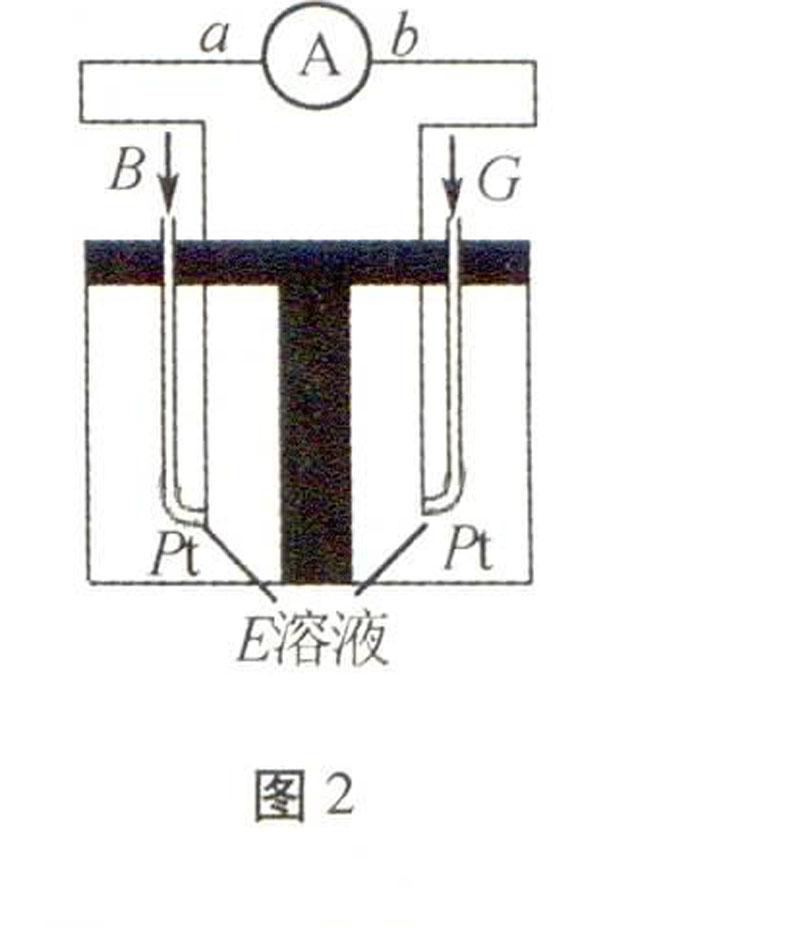
(2)在E溶液中将B、G构成电池如图2所示:
电子由 极经外电路流向 极(填:a或b);负极反应式为 。
(3)取等物质的量的E、F、M分别溶于水,都配制等体积溶液,这三种溶液中阴离子浓度由小到大的顺序是 。(用E、F、M表示)
(4)已知25℃、101 kPa条件下,A、B、甲的燃烧热分别为286 kJ/mol、283 kJ/mol、890 kJ/mol,若将a mol A、B、甲的混合气体完全燃烧,生成气态D和液态乙,且n(D)=n(乙),则放出的热量
(Q)取值范围为 。
(5)等质量的M分别发生反应④和⑤,转移电子数之比为 ;设计一个简单易行的小实验,证明反应⑤是放热反应。实验方法是 。
(6)如果A、B混合气体7.8 g(平均摩尔质量为10 g/mol),在与过量的G充分反应后,通过足量M粉末,可使M固体粉末增重 。
解析本题以框图为载体,将化学平衡、电化学、热化学、电解质溶液、氧化还原反应和化学计算等基本理论联系起来考查,思维跨度大,综合性强。空气主要成分是氮气和氧气,CO是氮气分子的等电子体。甲、乙在高温下反应,且甲为正四面体、乙为10电子分子,推知甲为CH4,乙为H2O,A为H2,B为CO,再由乙+ME+G,D+MF+G,联想水蒸汽、二氧化碳与过氧化钠反应,推知:M为Na2O2,E为NaOH,G为O2,F为Na2CO3。(1) 依题意,四组实验中,温度、压强相等,容器的容积不一定相等。采用“一边倒”法,将产物转化成起始反应物,列于表2。
(2)CO与O2在氢氧化钠溶液中构成原电池,CO在负极发生氧化反应,所以CO气体的一极为负极。(3)取1 mol Na2O2、1 mol NaOH、1 mol Na2CO3分别溶于水配制成等体积的溶液,碳酸钠只很小部分水解:CO2-3+H2OHCO-3+OH-,阴离子浓度:过氧化钠溶液的最大,氢氧化钠溶液的最小。
由产物水和二氧化碳的物质的量相等得出:n(H2)+2n(CH4)=n(CO)+n(CH4),n(H2)+n(CH4)=n(CO), n(CO)=0.5 a mol,n(H2)+n(CH4)=0.5a mol,用极端假设法计算:若混合气体由H2和CO组成,则Q=283 kJ/mol×0.5a mol+286 kJ/mol×0.5a mol=284.5a kJ;若混合气体由CH4和CO组成,则Q=283 kJ/mol×0.5a mol+890 kJ/mol×0.5a mol=586.5a kJ。根据平均值原理: 284.5a kJ (5) 2Na2O2+2CO22Na2CO3+O2↑,2Na2O2+2H2O4NaOH+O2↑等量的过氧化钠完全反应,两个反应转移电子数相等;利用棉花燃烧现象证明该反应是放热反应。 (6)从净反应看,过氧化钠净增质量相当于CO和H2总质量。 答案:(1)①A②3/7(2)a b CO-2e-+4OH-CO2-3+2H2O(3)E 知识储备(1)中学常考典型分子的立体结构 结构直线形V形三角锥形正四面体形(2)中学常见的等电子粒子 等电子10e-14e-18e-典型 粒子HF,H2O,NH3,CH4,F-,NH+4,H3O+,OH-,Al3+,Na+,Mg2+Si,CO,N2,C2-2,C2H2,CN-,HCNHCl,H2S,PH3,SiH4,HS-,S2-,O2-2,F2 H2O2,CH3CH3,CH3OH,CH3F,CH3NH2(3)等电子体原理:含原子数相等、电子数相等的粒子构型和化学键相似。如SO2与O3,N2O与CO2,CO与N2、C2-2、CN-互为等电子体,等电子体粒子具有相似的电子式。
