高分化PC12细胞电化学行为研究①
2016-08-03王思君屈天龙朱金玲李光植
刘 冰,焦 宇,王思君,屈天龙,邱 丹,朱金玲,李光植
(1.佳木斯大学药学院,黑龙江 佳木斯 154007; 2. 佳木斯大学基础医学院,黑龙江 佳木斯 154007)
高分化PC12细胞电化学行为研究①
刘冰1,焦宇1,王思君1,屈天龙1,邱丹1,朱金玲2,李光植1
(1.佳木斯大学药学院,黑龙江 佳木斯 154007; 2. 佳木斯大学基础医学院,黑龙江 佳木斯 154007)
摘要:目的: 研究高分化PC12细胞的电化学行为。方法:采用单线伏安法研究高分化PC12细胞电化学行为,并通过电化学、高效液相以及黄嘌呤氧化酶催化方法对电化学信号进行归属。结果:高分化PC12细胞的两个电化学信号分别来源于鸟嘌呤和黄嘌呤的混合以及次黄嘌呤和腺嘌呤的混合。结论:采用电化学方法可以检测到高分化PC12细胞来源于嘌呤的电化学信号,对以高分化PC12细胞为模型的生命科学及临床医学上的研究具有重要意义。
关键词:高分化PC12细胞;嘌呤;电化学
高分化PC12细胞为大鼠肾上腺髓质嗜铬细胞瘤克隆化的细胞株,经常作为一种神经细胞的模型[1]。具有较典型的神经细胞内分泌特征,近年来广泛用于信号的传导与细胞神经毒性和神经保护机制研究[2, 3]。本文采用电化学方法探索高分化PC12细胞,对其电化学行为进行研究[4~6],通过高效液相方法和酶催化方法佐证[7, 8],确定电化学信号的来源。为高分化PC12细胞的研究提供一个新的思路和手段。
1实验部分
1.1仪器与试剂
高分化PC12细胞购买于中国科学院上海生命科学研究院细胞资源中心;电化学工作站为上海辰华仪器有限公司;优级胎牛血清、DMEM培养基和双抗购于Gibco公司;黄嘌呤氧化酶购于Sigma公司;多壁碳纳米管(MWNTs)购于深圳纳米港有限公司;离子液体(bmim-PF6)购于百灵威科技有限公司。所用水均为三次蒸馏水,所有试剂均为分析纯。
1.2高分化PC12细胞的培养、收集以及处理
高分化PC12细胞加适量的DMEM培养液,放置于37℃、5% CO2、100%饱和湿度的培养箱中培养。将生长状态良好的贴壁高分化PC12细胞取出,除去培养基,用pH 7.4的PBS缓冲溶液冲洗3次,然后加入适量pH 7.4的PBS缓冲溶液,50℃水浴裂解30 min,获得细胞裂解液,将其用于电化学和高效液相检测。
1.3酶催化高分化PC12细胞裂解液处理过程
在一定量高分化PC12细胞裂解液中加入适量的黄嘌呤氧化酶, 37℃水浴10min,以保证黄嘌呤氧化酶对细胞裂解液中的黄嘌呤和次黄嘌呤的催化作用。
1.4电化学检测
电化学检测采用三电极体系:以多壁碳纳米管复合离子液体修饰玻碳电极为工作电极,饱和Ag/AgCl电极为参比电极,铂丝电极为对极,对上述裂解液进行电化学检测,检测条件:扫速为100mv·s-1,扫描电位为0~1.1V,富集时间为480s。
1.5高效液相检测
色谱条件:Ascenis RP-Amide 柱;DAD检测器;检测波长为254nm;流动相为磷酸二氢钾溶液;流速为1.0mL·min-1。
2结果与讨论
2.1高分化PC12细胞裂解液的伏安行为
高分化PC12细胞裂解液的伏安曲线如图1所示。四种嘌呤标准品混合物的伏安曲线在0.68、0.92和1.0V处出现3个不可逆的氧化峰(见图1Aa),可归属为鸟嘌呤与黄嘌呤的混合氧化峰,腺嘌呤以及次黄嘌呤的氧化峰(见图1B)。高分化PC12细胞裂解液的伏安曲线出现2个氧化峰(图1Ab),其峰电位与混合标准品的鸟嘌呤与黄嘌呤的混合氧化峰以及腺嘌呤和次黄嘌呤的氧化峰峰位接近。因此,高分化PC12细胞裂解液2个氧化峰可能分别来源于鸟嘌呤与黄嘌呤的混合,以及腺嘌呤与次黄嘌呤的混合。
2.2液相色谱法分析高分化PC12细胞裂解液
为证明高分化PC12细胞中含有四种嘌呤,对高分化PC12细胞裂解液进行高效液相检测,结果见图2。高分化PC12细胞裂解液出现五个色谱峰,保留时间分别为11.51、13.10、14.91、16.82和26.78min。在此细胞裂解液中加入尿酸、次黄嘌呤、鸟嘌呤、黄嘌呤和腺嘌呤标准品后,五个色谱峰均有增高,说明细胞裂解液中五个色谱峰分别为尿酸、次黄嘌呤、鸟嘌呤、黄嘌呤和腺嘌呤。
2.3黄嘌呤氧化酶对高分化PC12细胞的催化作用
黄嘌呤氧化酶具有将次黄嘌呤氧化为黄嘌呤,再将黄嘌呤氧化为尿酸的作用。为进一步证明高分化PC12细胞裂解液两个电化学信号峰的来源,对比了加黄嘌呤氧化酶催化前后高分化PC12细胞裂解液的电化学伏安曲线(见图3)。黄嘌呤氧化酶催化前,高分化PC12细胞裂解液0.68V处的峰I和1.0 V处的峰II(图3 a线),经黄嘌呤氧化酶催化后,峰I的峰面积大幅减小,说明峰I中的黄嘌呤已被氧化,剩下的峰为鸟嘌呤峰;峰II几乎消失不见,说明峰II中的次黄嘌呤已被氧化,而由于细胞中腺嘌呤含量低,几乎检测不到,因此,峰II主要来源于次黄嘌呤;在0.3V左右处出现新的尿酸峰,表明经酶催化后,黄嘌呤和次黄嘌呤均转化为尿酸。

图1(A)高分化PC12细胞裂解液伏安图:(a) 5×10-6mol·L-1黄嘌呤、鸟嘌呤、腺嘌呤和次黄嘌呤标准品混合液,(b) 高分化PC12细胞裂解液,细胞浓度: 2×106cells·mL-1;(B)嘌呤标准品伏安图:(a) 5×10-6mol·L-1黄嘌呤 (b) 5×10-6mol·L-1鸟嘌呤 (c) 5×10-6mol·L-1腺嘌呤 (d) 5×10-6mol·L-1次黄嘌呤

图2高分化 PC12 细胞裂解液(A线)与高分化 PC12 细胞裂解液和四种嘌呤、尿酸标准品混合物(B线)的高效液相色谱图
(a)尿酸(b)次黄嘌呤 (c)鸟嘌呤(d)黄嘌呤(e)腺嘌呤
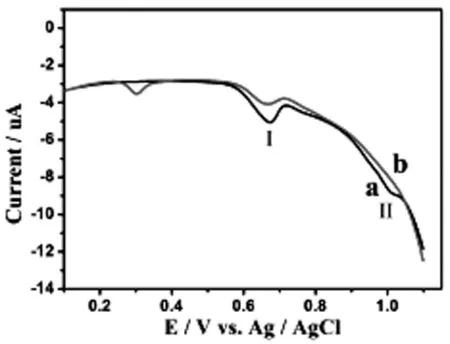
图3 黄嘌呤氧化酶催化前后高分化PC12细胞裂解液伏安图
(a) 高分化PC12细胞裂解液,(b) 黄嘌呤氧化酶催化后的高分化PC12细胞裂解液,细胞浓度:2×106cells·mL-1
3讨论
采用离子液体/多壁碳纳米管修饰的玻碳电极对高分化PC12细胞进行检测,通过高效液相佐证,黄嘌呤氧化酶的催化作用,确定了高分化PC12细胞电化学信号I来源于黄嘌呤和鸟嘌呤,而信号II来源于次黄嘌呤和腺嘌呤。高分化PC12细胞具有典型的神经细胞内分泌特征,对其代谢过程中嘌呤含量的变化的检测在生命科学及临床医学上均有重要意义。
参考文献:
[1]Ci Y X, Zhai Q, Wang S, et al. Voltammetric studies of the effect of Cisplatin-liposome on Hela cells[J]. Talanta, 2001, 55: 693-698
[2]张金波,王淑秋,朱金玲,等. 大鼠海马神经细胞原代培养技术的优化[J]. 黑龙江医药科学, 2009, 32(4): 20-21
[3]张金波,王淑秋,张春斌,等. 体外培养新生大鼠海马神经细胞方法的探究[J]. 黑龙江医药科学,2007,30(2):25
[4]孙海中,周成福,马晓茹,等.大鼠脊髓损伤早期Survivivn表达规律与细胞凋亡的关系[J].黑龙江医药科学,2009,32(4):29-31
[5]郑衍芳,吕文昌,孙田静,等.虫草素在Aβ1-42寡聚体诱导AD模型大鼠神经元损伤中的作用[J]. 黑龙江医药科学,2009,32(4):8-11
[6]胡金玲,孟凡荣,沈明格,等.红花注射液对脑复苏大鼠神经元凋亡相关基因的影响[J].黑龙江医药科学,2014,37(4):29-30
[7]Fukada K,Shoda T,Mima H,et al. Midazolam induces expression of cfos and EGR-1 by a non-GABA ergic mechanism[J].Anesth Analg,2002,95:373-378
[8]Shinomiya N, Shinomiya M. Dichlorodiphenyltrichoethane suppresses neurite outgrowth and induces apoptosis in PC pheochromocytoma cells[J].Toxicol lett,2003,137:175-183
[9]武冬梅,胡玲,刘继光,等.基于MCF-7细胞质伏安行为的电化学抗肿瘤药物敏感试验研究[J].药物分析杂志,2011,31(5):857-861
[10]Wu D M, Fu G L, Hu L, et al. Studies on the origin of the voltam-metric response of the PC-3 cell suspension[J].Talanta,2009,78(2):602-607
[11]Wang J T, Li X E, Zhang Y, et al. Voltammetric behavior of the MCF-7 cell cytoplasm and the effect of taxol on voltammetric response[J]. Analytical Biochemistry, 2009,394(2):229-236
[12]Parks D A, Granger D N. Xanthine oxidase: biochemistry, distribution and physiology[J]. Acta Physiol Scand Supple, 1986, 548:87-99
[13]展鹏, 刘涛, 刘新泳. 以黄嘌呤氧化酶为靶点的新型非嘌嘌呤类抗痛风及高尿酸血症药物研究进展[J]. 中国药物化学杂志, 2012, 22(5): 403-415
基金项目:①1.佳木斯大学研究生科技创新项目,编号:LM2014-056;2.黑龙江省自然科学基金项目,编号:H201369。
作者简介:刘冰(1989~)女,黑龙江佳木斯人,在读硕士研究生。 通讯作者:李光植(1965~)男,黑龙江佳木斯人,博士,副教授,硕士研究生导师。E-mail:liguangzhi2009@163.com。
中图分类号:R965.2
文献标识码:A
文章编号:1008-0104(2016)04-0103-02
(收稿日期:2016-02-20)
