NaC1胁迫对沼泽小叶桦光合特性的影响
2016-08-03赵文文李术梅
赵文文 李术梅 李 莉
(东北林业大学林木遗传育种国家重点实验室,黑龙江哈尔滨150040)
NaC1胁迫对沼泽小叶桦光合特性的影响
赵文文李术梅李莉
(东北林业大学林木遗传育种国家重点实验室,黑龙江哈尔滨150040)
为研究沼泽小叶桦的耐盐强度,以其新疆特有种0.5年生实生苗叶片为试材,测定不同质量浓度NaC1胁迫对其叶绿素荧光参数的影响。结果表明:盐胁迫后,沼泽小叶桦的PSⅡ最大光能转换效率(Fv/Fm)、光化学猝灭系数(qP)和非循环光合电子传递速率(ETR)总体上均随NaC1质量浓度的增大而逐渐减小,与NaC1质量浓度呈负相关;而非光化学猝灭(NPQ)随着NaC1质量浓度的增大而增大,且随着胁迫时间的延长呈显著变化。沼泽小叶桦具有较强的耐盐性。
沼泽小叶桦;盐胁迫;叶绿素荧光;光合特性
盐碱地是指土壤所含盐分影响作物正常生长。全世界盐碱地面积约为9.543 8亿hm2,而我国盐碱地面积约为3 460万hm2[1]。运用生态系统控制原理,对耐盐树种进行选育,通过种植耐盐碱植物来改良盐碱土地,并对盐碱土地资源加以利用是盐碱地生态修复的重要途径。另外,通过增加盐碱地植被覆盖率的方法使土壤表面蒸发率降低,也能够达到调节当地小气候,提高土壤内有机质含量的目的,最终使盐碱地土壤状况得到改良[2]。因此研究植物耐盐机理是筛选和推广耐盐树种改良盐碱地土壤和修复当地生态环境的基础和措施。近年来植物耐盐机理的研究取得了一定的成果[3-8]。耐盐植物的筛选和培育是一项非常重要的工作,对耐盐树种的生理指标进行研究,探索其耐盐机理,以及避盐耐盐方式,将对推广耐盐树种,使其适应盐碱地环境并最终改善土壤具有重要意义。
沼泽小叶桦 (Betula microphylla var.paludosa)属桦树科(Betu1a)植物,为国家二级重点保护物种,是新疆特有树种,具有非常强的耐旱、耐寒及耐盐碱的特性,是改良盐碱地土壤的优良候选树种[9],其生态学及经济学价值很高。沼泽小叶桦具有强耐盐性,但对其生理机制尚无系统性研究。近年来,在植物生态特性及植物抗逆性研究、高光效及抗逆品种筛选、转基因植物功能分析以及光抑制和光破坏防御机制探索等方面广泛应用光合特性指标[10-15],其中叶绿素荧光参数反映光能机构的运行耗散情况,成为植物逆境反应的重要指标[16-21]。为了探讨沼泽小叶桦的耐盐机理,本研究以沼泽小叶桦0.5年生实生苗叶片为试验材料,对其进行不同质量浓度NaC1胁迫处理,测定其叶绿素荧光参数的变化趋势,为探究沼泽小叶桦耐盐机理提供理论基础,为利用其抗盐机理来改善及利用盐碱地提供依据。
1 材料与方法
1.1试验材料
试验材料由新疆阿勒泰地区林业科学研究所崔东提供,选取沼泽小叶桦1年生实生苗枝条,枝条表面进行喷水处理后,放置在4℃环境下春化3~5 d,保存备用。
对10株采摘枝条进行水培处理,处理环境温度为27℃,换水频率为2 d,待嫩芽长度为3~5 cm时,即可用作初始外植体。嫩芽表面用浓度为9%的NaC1O消毒,组织培养4周后,选择生长状况一致的幼苗移栽到灭菌后的 V(草炭土)∶V(蛭石)∶V(珍珠岩)=5∶3∶2混合基质中,放置苗木培养室中,光周期采用光暗比为16 h∶8 h,光强为50~100 μmo1/(m2·s),培养室昼/夜温度分别为 (22.0±0.5)、(17.0±0.5)℃,湿度为60%±5%。6个月的沼泽小叶桦,株高70 cm左右,用于本试验测定分析。
1.2试验设计
试验在植物生长室中进行,光照时间为11 h,培养室昼夜温度分别为 (22.0±0.5)℃和 (17.0± 0.5)℃,湿度为60%±5%。2015年2月中旬,采用完全随机试验设计进行胁迫处理,每个浓度梯度胁迫处理10 d,NaC1处理的质量浓度分别为0 (CK)、0.6%、1.0%、1.5%、1.7%和2.2%,每个试验样本设生物学重复和技术重复各3次。胁迫期间每2 d补加不同质量浓度的NaC1溶液,于胁迫处理的不同时期进行各项生理指标的测定。
1.3叶绿素荧光参数的测定
利用便携式调制叶绿素荧光仪 (PAM-2500,WALZ,Germany),分别于盐胁迫后的 3、6、8、10 d进行叶绿素荧光参数的测定。测定植株叶片为自上往下第5~7片完全展开的成熟叶,以叶脉为轴的对称点测量叶绿素荧光参数光响应曲线。叶片暗适应1 h后,在无光照状态下测量植株的最大荧光(Fm)、最小初始荧光 (Fo)、光化学量子效率(Fv/Fm)、表观光合电子传递速率(ETR)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ)。初始荧光(Fo)是叶片充分暗适应之后产生,此时植物PSⅡ反应中心全部处于开放的状态。在Fo之后加1个强饱和脉冲光,原初电子受体QA将全部处于还原状态,测得最大荧光值(Fm)。Fv值为Fm与Fo之差,是暗适应时叶片的最大可变荧光。
1.4数据处理
所有测定重复3次,数据统计分析采用SPSS 17.0软件进行,应用Exce1 2010软件辅助数据分析和作图。
2 结果与分析
2.1盐胁迫对最大量子效率的影响
在植物叶绿素荧光参数中,最大量子效率参数(Fv/Fm)表征PSⅡ反应中心光能的转化效率,其数值的变化反映植物对逆境的响应[22]。有研究显示,在非胁迫的自然环境条件下,植物叶片叶绿素荧光参数Fv/Fm数值比较稳定,变化很小,但在胁迫条件下,该参数明显下降[23-27]。不同质量浓度盐胁迫处理下沼泽小叶桦叶片最大量子效率的变化趋势见图1。

图1 NaCl胁迫下沼泽小叶桦Fv/Fm的变化Fig.1 The Fv/Fmchanges of NaC1 stress on Betula microphylla
由图1可知:随着胁迫时间的延长和NaC1浓度的增加,沼泽小叶桦叶片的最大量子效率呈现出逐渐降低的趋势。在NaC1胁迫6 d,盐浓度达到1.5%时,Fv/Fm值于对照相比显著降低 (P<0.05);NaC1胁迫10 d,盐浓度为2.2%时,Fv/Fm值降到最低,为0.606,降低幅度为23.29%。
2.2盐胁迫对光化学猝灭系数的影响
光化学猝灭系数(qP)是一种量度,表示PSⅡ原初电子受体QA氧化态,反映了由于光化学电子传递而消耗的光能在PSⅡ天线色素捕获的总光能中所占的比例。qP可在一定程度上反映PSⅡ反应中心的开放程度,并反映出植物的光合效率和对光能的利用率,也可以从侧面反映出植物对盐胁迫的耐受力[28]。从图2可看出:随着胁迫时间的延长和NaC1浓度的增加,沼泽小叶桦叶片的光化学猝灭系数(qP)呈现出逐渐降低的趋势。在盐胁迫时间为8 d,盐浓度达到1.7%时,qP的变化与对照相比并不显著,但当盐浓度增加到2.2%时,qP明显降低。

图2 NaCl胁迫下沼泽小叶桦qP的变化Fig.2 The qP changes of NaC1 stress on Betula microphylla
2.3盐胁迫对非光化学猝灭的影响
非光化学猝灭(NPQ)反映的是PSⅡ天线色素吸收的另一部分光能的耗散,此部分光能并非用于电子传递,而是以热能形式耗散。随着植物NPQ值的增大,植物通过热耗散消耗的能量就越大,植物抵抗胁迫的能力就越强[29]。由图3可知,NaC1处理8 d内,盐浓度在1.5%以内,试验植株的NPQ略有升高,当盐浓度达到2.2%时,NPQ上升明显。NPQ的涨幅达到了259.34%,在NaC1胁迫10 d时,各浓度处理下的植株NPQ均有明显上升。盐浓度越高NPQ上升越明显,最大涨幅达到了615.67%。说明沼泽小叶桦可以通过启动热耗散机制使过剩的激发能消耗掉,进而达到保护光合机构免受伤害的目的[30-32]。

图3 NaCl胁迫下沼泽小叶桦NPQ的变化Fig.3 The NPQ changes of NaC1 stress on Betula microphylla
2.4盐胁迫对光合电子传递速率的影响
光合电子传递速率 (ETR)反映光照条件下的表观电子传递效率,与植物净光合速率呈显著正相关[33]。如图4所示,盐胁迫对沼泽小叶桦光合电子传递速率的影响较大,在胁迫处理的0~6 d可以看出ETR下降,当盐浓度是1.5%时,降幅仅有6.36%,随着盐浓度增高到1.7%、2.2%时,ETR下降显著 (P<0.05),降幅达到37.94%,在胁迫处理10 d时,最大降幅达到49.84%。
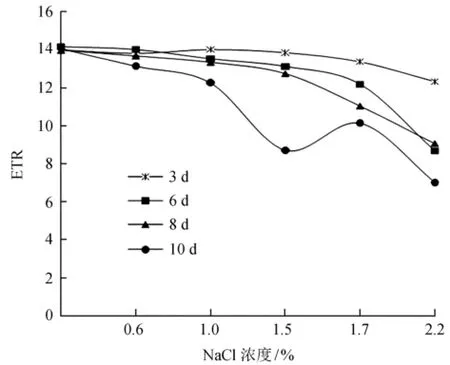
图4 NaCl胁迫下沼泽小叶桦ETR的变化Fig.4 The ETR changes of NaC1 stress on Betula microphylla
2.5盐胁迫对沼泽小叶桦生长的影响
盐胁迫对沼泽小叶桦的影响最终体现在植株生长上,绿叶面积和相对生长速率是其植株生长的重要指标。盐胁迫时沼泽小叶桦生长速率降低,并且盐胁迫浓度越高生长速率降低越明显。盐胁迫对植物生长的影响最主要体现在叶片上,盐胁迫处理过程中沼泽小叶桦叶片颜色变化较为明显。通过与对照植株比较结果显示:当 NaC1浓度为0.6%和1.0%时,植株成熟的功能叶片颜色变化不显著,与对照植株基本无差别;当NaC1浓度达到1.5%时,叶片出现枯黄,由植株根部至顶端,叶片枯黄程度递减;当NaC1浓度达到1.7%~2.2%时,胁迫初期植株变化不明显,随着胁迫时间的延长,沼泽小叶桦中下部叶片明显变黄,胁迫后期甚至有部分叶片开始脱落。整个盐胁迫过程前后,对照植株和不同浓度NaC1胁迫的植株株高差异不明显。对所有盐胁迫植株进行复水处理,1个月后发现经浓度为2.2%NaC1胁迫的植株死亡,其他植株均有不同程度的生长,NaC1浓度为1.5%和1.7%处理过的植株由于受盐胁迫影响较大所以生长缓慢。复水1个月后处理过的植株与对照植株相比,株高最大差异值可达8 cm。
3 结论与讨论
叶绿素荧光参数是描述植物光合生理状况及光合作用机理的变量或常数值,是植物“内在性”特点的反应,可作为内窥镜应用于植物光合作用与环境关系的研究。叶绿素吸收的光能主要靠3个途径来消耗,分别是叶绿素荧光、光合作用和热耗散,三者之间联系紧密且此消彼长,且前两者更是紧密相联。光合作用的部分信息包含在叶绿素荧光中,由于逆境而使光合作用进程中的某一部分产生的异变或者影响都可以由植物体内叶绿素荧光的变化来反映[10]。已有大量的研究表明,NaC1胁迫会使植物的光合作用出现抑制现象,而且被抑制的程度和NaC1胁迫的浓度呈现正相关,即NaC1浓度越高,抑制现象越明显[34]。叶绿素荧光参数作为盐胁迫的指标,广泛的应用于许多植物物种中,如紫竹 (Phyllostachys nigra)[35]、含笑(Michelia figo)[36]、棉花 (Gossypium sPP.)[37],水稻 (Oryza sativa)[38]和香椿 (Toona sinensis)、楸树(Catalpa bungei)、北美红栎(Quercus rubra)等[39]。
叶绿素荧光参数可以准确监测植物在逆境胁迫下的健康状况及生理反应[39]。通过叶绿素荧光的变化可以了解光合作用过程中光系统对光能的接收、分配和消耗等一系列生理反应,能反映出植物受胁迫的情况[40]。盐胁迫可以通过损害 PSⅡ而导致光合作用下降[41-42]。研究结果显示,盐胁迫下Fv/Fm、qP和ETR均有不同幅度的下降,说明盐胁迫影响了沼泽小叶桦叶片的电子传递速率和光化学量子效率,PSⅡ复合体受到破坏[41,43],进而导致光能转换率降低,这与大多数研究结果[20,44]基本一致。而 Fv/Fm、qP的下降幅度并不大,可以说明试验植株对于盐胁迫具有较强的抵御能力。qP是光化学猝灭系数,NPQ为非光化学猝灭系数,反映植物热耗散能力的变化。在本试验中,盐胁迫下Fv/Fm和qP下降,而NPQ升高,说明盐胁迫下叶片PSⅡ的激发能分配方式发生变化,叶片通过非光化学猝灭提高热耗散,使过多的激发能消耗掉来适应盐胁迫环境,避免了PSⅡ反应中心因过多吸收光能而引起光氧化和光抑制伤害,这大大提高了植物对胁迫环境的抵抗及适应能力[27]。由以上结论进一步推断盐胁迫通过破坏叶片PSⅡ机构来影响碳同化速率[45],使光反应速率降低,进而导致光合速率的下降。逆境条件下植物的NPQ值增大,提高了非辐射性热耗散能力。本试验研究结果揭示沼泽小叶桦在不同浓度的NaC1胁迫条件下,随着胁迫时间的延长,Fv/Fm、qP下降幅度并不明显,NPQ逐渐增加。说明沼泽小叶桦能通过非光化学猝灭增加热耗散使过多的激发能消耗掉,提高其对盐胁迫环境的适应性,这可能是沼泽小叶桦适应盐胁迫环境的一种保护机制。本研究通过对沼泽小叶桦响应盐胁迫的研究,初步证明了其具有较强的耐盐性,为沼泽小叶桦这个耐盐树种的异地引种提供参考。
[1]李彬,王志春.中国盐碱地资源与可持续利用研究[J].干旱地区农业研究,2005,23(2):154-158.
[2]张建锋.盐碱地的生态修复研究 [J].水土保持研究,2008,15(4):74-78.
[3]Ashraf M.Biotechno1ogica1 aPProach of imProving P1ant sa1t to1erance using antioxidants as markers[J].Biotechno1ogy Advances,2009,27(1):84-93.
[4]Praxedes S C.Sa1t to1erance is associated with differences in ion accumu1ation,biomass a11ocation and Photosynthesis in cowPea cu1tivars[J].Journa1 of Agronomy andCroP Science,2010,196(3):193-204.
[5]Teak1e N.Mechanisms of C1-transPort contributing to sa1t to1erance[J].P1ant,Ce11&Environment,2010,33(4):566-589.
[6]Seckin B.The ro1e of antioxidant defense systems at different sa1t to1erance of Hordeum marinum Huds.(sea bar1eygrass)and Hordeum vulgare L.(cu1tivated bar1ey)[J].Environmenta1 and ExPerimenta1 Botany,2010,69 (1):76-85.
[7]田雪梅,魏珉.不同抗性砧木嫁接黄瓜幼苗对NaC1胁迫的生理响应 [J].应用生态学报,2012,23(1):147-153.
[8]邱凤英,廖宝文.半红树植物杨叶肖槿幼苗耐盐性研究 [J].林业科学研究,2011,24(1):51-55.
[9]杨昌友,王健,李文华.新疆桦木属 (Betula L.)新分类群 [J].植物研究,2006,26(6):648-655.
[10]孙宪芝,郑成淑,王秀峰.高温胁迫对切花菊 ‘神马,光合作用与叶绿素荧光的影响 [J].应用生态学报,2008,19(10):2149-2154.
[11]李钦夫,李征明,纪建伟,等.叶绿素荧光动力学及在植物抗逆生理研究中的应用 [J].湖北农业科学,2013(22):5399-5402.
[12]武传兰,隆小华,金善钊,等.盐胁迫对不同品系杨树幼苗生长和叶绿素荧光的效应 [J].生态学杂志,2012,31(6):1347-1352.
[13]吴永波,薛建辉.盐胁迫对3种白蜡树幼苗生长与光合作用的影响 [J].南京林业大学学报(自然科学版),2002,26(3):19-22.
[14]柯裕州,周金星,卢楠,等.盐胁迫对桑树幼苗光合生理及叶绿素荧光特性的影响 [J].林业科学研究,2009,22(2):200-206.
[15]张川红,沈应柏,尹伟伦,等.盐胁迫对几种苗木生长及光合作用的影响 [J].林业科学,2002,38 (2):27-31.
[16]葛江丽,石雷,谷卫彬,等.盐胁迫条件下甜高粱幼苗的光合特性及光系统Ⅱ功能调节 [J].作物学报,2007,33(8):1272-1278.
[17]李青云,葛会波,胡淑明,等.外源钙对盐胁迫下草莓叶绿素荧光参数的影响 [J].沈阳农业大学学报,2006,37(3):482-484.
[18]王良桂,张春霞,彭方仁,等.干旱胁迫对几种楸树苗木叶片荧光特性的影响 [J].南京林业大学学报(自然科学版),2008,32(6):119-122.
[19]杨卫丽,黄福灯,曹珍珍,等.高温胁迫对水稻光合PSII系统伤害及其与叶绿体D1蛋白间关系[J].作物学报,2013,39(6):1060-1068.
[20]王国莉,郭振飞.低温对水稻不同耐冷品种幼苗光合速率和叶绿素荧光参数的影响 [J].中国水稻科学,2005,19(4):381-383.
[21]柯裕州,周金星,卢楠,等.盐胁迫对桑树幼苗光合生理及叶绿素荧光特性的影响 [J].林业科学研究,2009,22(2):200-206.
[22]李晓征,彭峰,徐迎春,等.不同遮荫下多脉青冈和金叶含笑幼苗叶片的气体交换日变化 [J].浙江林学院学报,2005,22(4):380-384.
[23]郝日明,李晓征,毛志滨,等.醉香含笑和金叶含笑幼苗期的动态生命表 [J].植物资源与环境学报,2004,13(2):40-43.
[24]向成华,朱秀志,张华,等.濒危植物峨眉含笑的遗传多样性研究 [J].西北林学院学报,2009,24 (5):66-69.
[25]田如男,薛建辉,李晓储,等.深山含笑和乐昌含笑的抗寒性测定 [J].南京林业大学学报(自然科学版),2004,28(6):55-57.
[26]刘兴剑,刘小巍,孙起梦.阔瓣含笑种内类型划分及苗期试验 [J].江苏林业科技,2005,32(4):15-17.
[27]李园园,杨光,韦睿,等.转TabZIP基因白桦的获得及耐盐性分析 [J].南京林业大学学报(自然科学版),2013,37(5):6-12.
[28]汪月霞,孙国荣,王建波,等.NaC1胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系 [J].生态学报,2006,26(1):122-129.
[29]周蕴薇,刘艳萍,戴思兰.用叶绿素荧光分析技术鉴定植物抗寒性的剖析 [J].植物生理学通讯,2006,42(5):945-950.
[30]李峤,孙骏威,李海霞.缺钾对水稻叶片叶绿素荧光参数的影响 [J].中国计量学院学报,2006,17 (1):79-83.
[31]孙骏威,李素芳,付贤树,等.低钾对水稻不同叶位叶片光合特性及抗氧化系统的影响 [J].核农学报,2007,21(4):404-408,356.
[32]彭海欢,翁晓燕,徐红霞,等.缺钾胁迫对水稻光合特性及光合防御机制的影响 [J].中国水稻科学,2006,20(6):621-625.
[33]Iacon K J,Sommer K J.The measurement of ch1oroPhy11 f1uorescence as a too1toeva1uate the Photosynthetic Performance of graPevine 1eaves[J].Acta Hortic,1999 (493):31-44.
[34]许详明,叶和春,李国凤.植物抗盐机理的研究进展 [J].应用与环境生物学报,2000,6(4):379-387.
[35]时燕,黄耀华,郭小勤,等.4个紫竹栽培类型叶绿素荧光特性的比较 [J].江西农业大学学报,2009,31(3):397-401.
[36]陈辰,何小定,秦金舟,等.4种含笑叶片叶绿素荧光参数Fv/Fm特性的比较 [J].安徽农业大学学报,2013,40(1):32-37.
[37]汪保华,王亚峰,谢晓玲,等.盐胁迫下棉花叶绿素荧光参数的变化 [J].湖北农业科学,2014,53 (7):1509-1512.
[38]刘晓龙,徐晨,徐克章,等.盐胁迫对水稻叶片光合作用和叶绿素荧光特性的影响 [J].作物杂志,2014(2):88-92.
[39]彭方仁,朱振贤,谭鹏鹏,等.NaC1胁迫对5个树种幼苗叶片叶绿素荧光参数的影响 [J].植物资源与环境学报,2010,19(3):42-47.
[40]Annick M,E1isabeth P,Gerard T.Osmotic adjustment,gas exchanges and ch1oroPhy11 f1uorescence of abexaP1oid tritica1e and its Parenta1 sPecies under sa1t stress[J]. P1ant Physio1ogy,2004,161(1):25-33.
[41]Lu C M,Zhang J H.Effects of water stress on Photosystem II Photochemistry and its thermostabi1ity in wheat P1ants[J].Journa1 of ExPerimenta1 Botany,1999,50(336):1199-1206.
[42]Sharma P K,Ha11 D O.Interaction of sa1t stress and Photoinhibition on Photosynthesis in bar1ey and sorghum[J].P1ant Physio1ogy,1991,138(5):614-619.
[43]彭海欢,翁晓燕,徐红霞,等.缺钾胁迫对水稻光合特性及光合防御机制的影响 [J].中国水稻科学,2006,20(6):621-625.
[44]Mishra S K,Subrahmanyam D,Singha1 G S.InteractionshiP between sa1t and 1ight stress on the Primary Process of Photosynthesis[J].P1ant Physio1ogy,1991,138(7):92-96.
[45]杨淑萍,危常州,梁永超.盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响 [J].中国农业科学,2010,42(8):1585-1593.
(责任编辑张坤)
Effects of NaC1 Stress on Ch1oroPhy11 F1uorescence Parameter in Leaf of Betula microphylla var.paludosa Seed1ings
Zhao Wenwen,Li Shumei,Li Li
(The State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Hei1ongjiang Harbin 150040,China)
In order to exP1ore sa1t to1erance abi1ity of B.microphylla,took ha1f a year o1d seed1ings of endemic sPecies in Xinjiang region as the exPerimenta1 materia1s,and measured the ch1oroPhy11 f1uorescence Parameters index under different simu1ated NaC1 concentrations.The resu1ts showed that a negative re1ation was founded,which maxima1 Photochemica1 efficiency of PSⅡin dark(Fv/Fm),Photochemica1 quenching coefficient(qP)and intrinsic PSⅡefficiency(ETR)decreased gradua11y with rising of NaC1 concentration;non-Photochemica1 quenching Parameter increased under the same conditions,and there were high1y significant differences a1ong with the Pro1onging of stress time.The resu1ts indicated that Betula microphylla var.paludosa has stronger sa1inity to1erant.
Betula microphylla,sa1t stress,ch1oroPhy11 f1uorescence Parameters,Photosynthetic characteristics
S718.43
A
2095-1914(2016)04-0042-06
10.11929/j.issn.2095-1914.2016.04.007
2015-09-25
东北林业大学林木遗传育种国家重点实验室创新项目(2013B07)资助;科技部“863”课题(2013AA102704-0104)资助。
第1作者:赵文文(1987—),女,硕士生。研究方向:林木遗传育种。Emai1:837512283@qq.com。
李莉(1963—),女,教授。研究方向:林木遗传育种。Emai1:1i1i@nefu.edu.cn。
