烤烟青枯病田间发生动态及其与气象因素的相关性
2016-08-03陈志厚孔凡玉白万明
林 勇,徐 茜,陈志厚,孔凡玉,白万明*
(1.福建省烟草公司南平市公司,福建 南平 353000;2.中国农业科学院烟草研究所,烟草行业烟草病虫害监测与综合治理重点实验室,青岛 266101)
烤烟青枯病田间发生动态及其与气象因素的相关性
林勇1,2,徐茜1,陈志厚1,孔凡玉2,白万明1*
(1.福建省烟草公司南平市公司,福建 南平 353000;2.中国农业科学院烟草研究所,烟草行业烟草病虫害监测与综合治理重点实验室,青岛 266101)
2013—2014年对南平建阳烟田土壤青枯病菌数量和发病情况进行了系统调查,分析了病害与主要气象因子的相关性。结果表明,SMSA半选择性培养分离法和荧光定量PCR法均能有效检测土壤中青枯病菌,前者检测的青枯病菌数量与病情指数相关性(R2=0.8191)高于后者(R2=0.7464)。空气温度、湿度、降水和日照时数等气象因子中,温度是影响南平烟田青枯病菌数量和发病程度的关键气象因子。5月下旬至6月初,周平均温度高于22℃时,病害进入始发期,此时根际土壤中病菌数量高于5.0×105cfu/mL。6月上旬至中旬,周平均温度在22~25℃,病害处于平稳发展期,青枯病菌数量在1.0×105~2.2×106cfu/g。6月中下旬,周平均气温高于25℃,病害进入爆发期,青枯病菌数量在2.2×106cfu/g以上。温度对于指导青枯病的预测预报和防治具有重要价值。
烟草;青枯病;气象因子;相关性;南平
烟草青枯病是由茄科雷尔氏菌(Ralstonia solanacearum)引起[1]的一种毁灭性病害,在南平烟区烟叶成熟期为害严重,具有发病急、传播快、难控制等特点。烟草青枯病菌寄主范围广[2],具有丰富的生物多样性[3-5],能够以腐生或寄生的方式在土壤中存活多年。当条件适宜时病原物通过根部伤口或次生根萌发点侵染植株[6-7]。正是由于该病菌的上述特点,烟草青枯病得以大面积流行。为了有效控制该病害,摸清南平烟区青枯病田间发生和流行规律,本研究通过定点系统调查,研究了南平烟区青枯病菌和病害消长动态及其与气象因子的相关性,以期为南平烟区青枯病的防治提供依据。
1 材料与方法
1.1病害系统调查
2013—2014年系统调查地点设在福建省南平市建阳莒口烟田,调查田块常年发病。试验地土壤类型为红壤,土壤肥力中等,前茬作物均为水稻,调查品种为当地主栽品种K326,调査地块烟草的整个生育期未喷施化学药剂。移栽后至采烤基本结束每周调查一次病情指数,记录田间首次发现病株时间。病害调查时,将调查田块分成3个小区,每个小区采用五点取样法定时定株调查,每个调查点调查10株,病情指数计算参照文献[8]的方法。调查田块2013年和2014年烟草移栽时间分别为3月8日和3月14日,为便于分析,对两年度3月20日至6月22日调查和取样数据进行统计。
1.2土壤样品采集方法
烟草根际土的采集参照文献[9]方法进行。移栽后1周开始取样,每个小区利用五点取样法取5株烟根际混合土样100 g。取样后-20℃保存,尽快带回实验室处理。
1.3青枯病菌分离
采用SMSA半选择性培养基[10]分离根际土壤中的茄科雷尔氏菌(Ralstonia solanacearum)。土壤样品用无菌水进行梯度稀释,涂布SMSA平板计数,28℃培养2 d后,统计具有青枯菌特点的菌落(流动,平滑,带有乳白色晕圈的粉红色菌落,底部呈马蹄形)。
1.4青枯病菌RT-PCR检测
按照操作说明,用试剂盒(Ultra Clean DNA Isolation kit,MOBIO)提取和纯化土壤DNA。参照陈巧玲方法[11]进行青枯病菌RT-PCR检测。将纯化的土壤样品DNA为模板,扩增反应体系:10×Buffer 2.5 μL,dNTP(2.5mmol/l)2 μL、引物(10 mmol/L)1 μL、MgCl2(25 mmol/L)2 μL,rTaq DNA 酶0.3 μL,DNA模板1μL,ddH2O补足至25μL。根据已报道的青枯菌fliC基因设计并合成引物f:-GAACGCCAACGGTGCGAACT,r:5?-GTGGGG TTCGCCTGATTTT-3?。反应参数:95℃ 5 min,95℃ 30 s,60℃ 30 s,72℃ 40 s,共30次循环;72℃ 10 min。获得扩增曲线、标准曲线和熔解曲线,计算样品初始基因拷贝数,换算每克样品的基因拷贝数。
1.5气象资料获取
温度、降雨、日照时数和相对湿度等气象资料均采用建阳市气象站数据。
2 结果
2.1烟草根际青枯病菌群消长动态
如图1所示,SMSA半选择培养基法和RT-PCR法均能有效检出烟草根际土壤中青枯菌。RT-PCR法检测限低,在土壤中青枯菌含量1000 cfu/g时即可检出,因此检出时间较SMSA培养法早7~14 d。SMSA半选择性培养分离法检测青枯病菌数量与病情指数相关性(R2=0.8191)高于荧光定量PCR法(R2=0.7464)。两种方法均具有较好的相关性(2013年和2014年R2值分别为0.9958和0.9742),说明检测结果较为可靠。在莒口烟田烟草根际土壤青枯病菌的生物量测定中,SMSA平板检测和RT-PCR检测青枯病原菌数量发生趋势基本一致。移栽后1个月(4月上旬),青枯菌开始少量检出。虽然2013年移栽较2014年早7 d,但2014年青枯菌的初次检出时间比2013年早7~14 d。4月中旬至5月中旬为病原菌积累期,青枯菌数量缓慢增长。5月下旬至6月下旬属于病原菌爆发期,烟草根际土壤青枯菌数量急剧增加。

图1 烟草根际土壤青枯菌群密度Fig.1 Population density of R.solanacearum in tobacco rhizospheric soil
2.2烟草青枯病田间消长动态
从连续2年的调查结果来看(图2),南平烟草青枯病发生发展具有发病急、流行快的特点。2013年和2014年田间病株初次发现时间分别为6月3日和5月28日,说明5月底至6月初为病害的始发期。6月上旬至中旬为病害快速发展期,病情指数在10以下。6月中旬至下旬为病害爆发流行期,病情指数快速上升至30以上,田间危害严重。从年度间发病情况来看,青枯病2014年较2013年发病早、危害重。
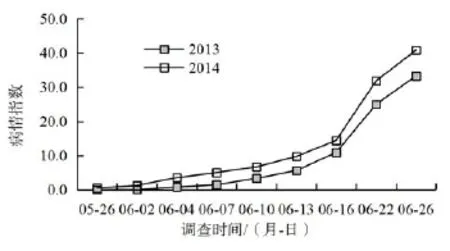
图2 烟草青枯病病情指数动态变化Fig.2 Disease index of tobacco infected by R.solanacearum
2.3青枯病发生与青枯菌数量的关系
烟草青枯病发生与根际土壤青枯菌数量呈正相关。利用SMSA培养基和RT-PCR检测方法,青枯菌数量与病情指数的R2值分别为0.8191(图3)和0.7464(图4)。烟草青枯病田间初次发病时,烟株根际土壤病菌检出数量2013年为2.5~5.0×105cfu/mL,2014年为2.7~5.2×105cfu/mL。
2.4青枯菌数量与气象因素的关系
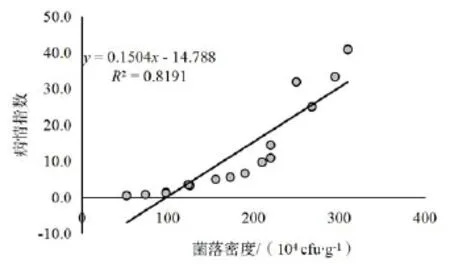
图3 SMSA培养基检测青枯菌数量与病指相关性Fig.3 Correlation between population of R.solanacearum detected by SMSA and disease index

图4 RT-PCR检测青枯菌数量与病指相关性Fig.4 Correlation between population of R.solanacearum detected by RT-PCR and disease index

表1 南平建阳市2013和2014年主要气象因子数据Table 1 Meteorological data in Jianyang of Nanping between 2013 and 2014
烟草青枯病试验取样与调查期间建阳市气象数据如表1所示。以SMSA培养基检测青枯病菌数量为因变量(Y),周平均日照时数(X1)、周平均气温(X2)、周平均相对湿度(X3)和周平均降水量(X4)为自变量,通过逐步回归分析方法建立方程Y=-753.748699+0.27723384829X1+25.024981268X2+3.555471505X3-0.14285654450X4, 相 关 系 数r=0.7840。如表2所示,烟草根际青枯病菌数量与周平均日照时数、周平均气温、周平均相对湿度和周平均降水量呈正相关。偏相关分析结果表明,周平均温度偏相关系数最大(0.7465),说明温度可能是青枯病菌数量的关键影响因子。通径分析的决定系数R2=0.6143,剩余通径系数为0.6208,说明上述4个气象因子对烟草青枯病菌数量影响的比重达62.08%。
2.5青枯病病情指数与气象因素的关系
以烟草青枯病病情指数为因变量(Y),周平均日照时数(X1)、周平均气温(X2)、周平均相对湿度(X3)和周平均降水量(X4)为自变量,通过逐步回归分 析 方法建立方程 Y=-331.134402-0.3915367684X1+10.935617168X2+0.9093703211X3+ 0.05259075419X4,相关系数r=0.906481。烟草根际青枯病菌数量与周平均气温和周平均降水量呈正相关。周平均温度偏相关系数最大(0.7465),其次为周平均降水量(0.5234),说明温度和降水是病害发生的关键影响因子。通径分析的决定系数R2=0.8217,剩余通径系数为0.4223,说明上述4个气象因子对烟草青枯病菌数量影响的比重达82.17%。

表2 青枯病菌与主要气象因素相关性分析Table 2 Correlation between R.solanacearum and meteorological factors
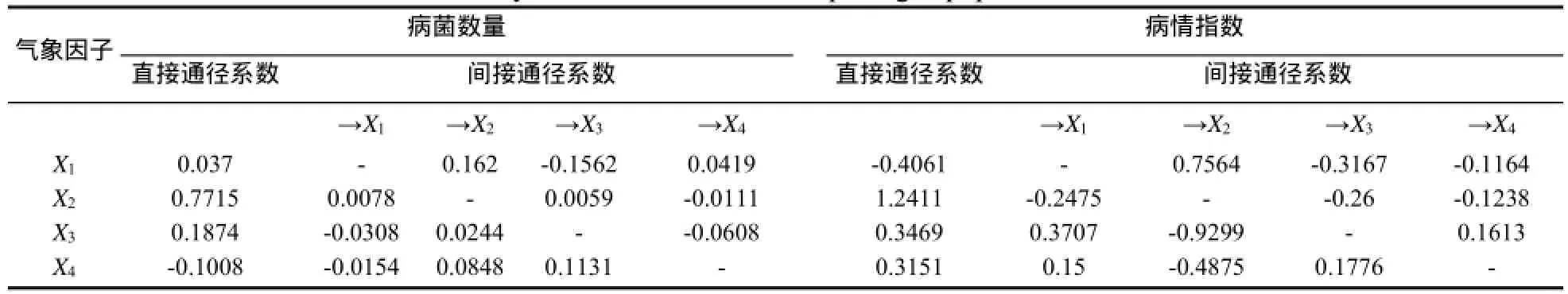
表3 影响烟草青枯病菌数量和病情指数的主要气象因子通径分析Table 3 Path analysis of climatic factors on pathogen population and disease index
3 讨论
青枯菌为土壤习居菌,在植物发病以前已经在土壤中开始大量积累。平板划线分离法是目前检测土壤中青枯菌数量最常用的方法,培养基主要为红四氮唑非选择培养基(TZC)[12]和改良SMSA半选择培养基[13]。近年来快速发展的荧光定量PCR技术开始广泛用于植物青枯菌检测[14-16]。本研究分别采用改良SMSA半选择培养基分离法和荧光定量PCR法对南平烟区烟草根际青枯病菌进行了动态监测。结果表明,这两种方法均能有效检测土壤中的青枯病菌,其中荧光光定量PCR法检测限更低。2013—2014年连续2年的监测结果表明,烟草移栽后7~10 d即可在烟草根际检测到青枯病菌,并在整个生长季节不断积累。
综合2年调查结果来看,5月底至6月初为南平烟区烟草青枯病的始发期,6月上旬至中旬为病害发展期,6月中下旬为病害爆发流行期。与前人研究结果基本一致[17],烟草根际土壤青枯病菌数量与病情指数呈正相关,SMSA半选择培养基分离法则在病原菌数量与病情指数相关性方面略高于荧光定量PCR法。在田间首次发现病株时,利用SMSA半选择培养基分离法检测到烟草根际土壤青枯菌含量为5.0×105至5.2×105cfu/mL,而在病害爆发期,烟草根际土壤青枯菌数量则高达2.2×106cfu/mL以上。
气象条件是影响烟草青枯病发生流行的重要因素,其中温度被认为是影响青枯病发生和流行的关键气象因子。郑向华等[18]研究表明,烟草青枯病菌最适宜生长的温度范围为28~34℃。徐世典[19]发现青枯病在低于20℃的土壤温度条件下不能发生。陈顺辉等[20]研究发现,当土温稳定在20℃持续5~10 d,烟草感病品种就开始出现发病症状。与上述研究结果一致,本研究发现,周日照时数、周平均气温、周相对湿度和周降水量等4个气象因子中,温度是影响烟草青枯病菌数量和田间发病程度的关键因子。进入5月下旬,周平均气温高于22℃时,田间开始出现发病植株。6月上旬至中旬,周平均气温稳定在22~25℃,病害处于平稳发展期。6月中下旬,周平均气温高于25℃,此时伴随着降雨,病害进入爆发流行期。
综上所述,南平烟草青枯病具有发病急、流行快等特点,尤其是在采烤期,病害正处于流行阶段,常会造成大面积灾害。温度是烟草青枯病菌繁殖及病害发生的关键影响因子,对于指导青枯病的预测预报和防治具有重要的实际意义。生产上建议烟苗要早移栽,尽量使烟草采收期避开发病高峰,最大限度减轻病害损失。此外,监测土壤病原菌数量动态变化也对病害的预测预报及防治具有一定的指导作用。
[1]Yabuuchi E,Kosako Y,Yano I,et al.Transfer of two Burkholderia and an Alcaligenes species to Ralstonia Gen.Nov[J].Microbiol Immunol,1995,39(11):897-904.
[2]Genin S,Boucher C.Ralstonia solanacearum:secrets of a major pathogen unveiled by analysis of its genome[J]. Mol Plant Pathol,2002,3:111-118.
[3]Kulkarni J,Patil R.Production and utilization of extracellular slime by Pseudomonas solanacearum and its role on survival at different relative humidities[J]. Acta Microbiol Pol,1982,31:159-165.
[4]方树民,顾钢,陈玉森,等.烟草青枯菌在杂草根部的定殖和传病作用[J].中国烟草学报,2013,19(5):72-81,88.
[5]郑向华,邓海滨,刘琼光,等.广东省烟草青枯菌的菌系和遗传多样性[J].华中农业大学学报,2007,26(4):463-468.
[6]王国平,罗宽,廖晓兰,等.湖南烟草青枯病菌的致病性及生物型研究[J].湖南农业大学学报,1996,22(4):59-62.
[7]蔡刘体,汪汉成,刘艳霞,等.青枯菌种内分型研究进展[J].生物技术通报,2013(7):20-23.
[8]国家烟草专卖局.GBT23222—2008烟草病虫害分级及调查方法[S].北京:中国标准出版社,2009.
[9]Zhang C S,Kong F Y.Isolation and identification of potassium-solubilizingbacteriafromtobacco rhizospheric soil and their effect on tobacco plants[J]. Appl Soil Eco,2014,82:18-25.
[10]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998.
[11]陈巧玲.荧光定量PCR方法在土传烟草青枯病生防研究中的应用[D].南京:南京农业大学,2011.
[12]Norman D J,Alvarez A M.A rapid method for presumptive identification of Xanthomonas campestris pv. dieffenbachiae and other Xanthomonads[J].Plant Dis, 1989,73:654-658.
[13]Engelbrecht M C.Modification of a semi-selective mediumfortheisolationandquantificationof Pseudomonas solanacearum Bact[J].Wilt Newsl,1994, 10:3-5.
[14]黄家权,晏立英,叶小文,等.青枯菌定量检测方法的建立及其在花生中的应用[J].中国农业科学,2011,44(1):58-66.
[15]于小龙.土壤青枯菌群体的动态消涨规律与分子检测方法研究[D].天津:天津农学院,2015.
[16]吴金钟.土壤中烟草青枯病菌分子检测方法研究[D].重庆:重庆大学,2008.
[17]彭怀俊,顾钢,纪成灿,等.烤烟根系土壤中青枯病菌动态与田间病害发生发展的关系[J].湖南农业大学学报:自然科学版,2005,31(4):384-387.
[18]郑向华,邓海滨,刘琼光,等.广东省烟草青枯细菌菌系和遗传多样性[J]. 华中农业大学学报,2007,26 (4):463-468.
[19]徐世典.台湾植物青枯病菌生态与防治[J].植物保护学会会刊,1991,33(1):72-79.
[20]陈顺辉,顾钢,纪成灿,等.烟草青枯病流行动态监测[J].中国烟草科学,2003,24(3):32-33.
The Epidemic Dynamics of Tobacco Bacterial Wilt and Analysis of Related Climate Factors
LIN Yong1,2,XU Qian1,CHEN Zhihou1,KONG Fanyu2,BAI Wanming1*
(1.Nanping Branch of Fujian Tobacco Company,Nanping,Fujian 353000,China;2.Pest Integrated Management Key Laboratory of China Tobacco,Tobacco Research Institute of ChineseAcademy ofAgricultural Sciences,Qingdao 266101,China)
The population of Ralstonia solanacearum and disease index of tobacco bacterial wilt in Nanping were investigated with systematic survey method.The correlations between tobacco bacterial wilt and climate factors were also analyzed.The results showed that semi selective cultures and fluorescent quantitative PCR were both effective in detecting R.solanacearum in soil. However the correlation between the pathogen population and disease index by the method of semi selective cultures(R2=0.8191) was higher than that by fluorescent quantitative PCR(R2=0.7464).The temperature was the key factor among precipitation, temperature sunlight and humidity which contribute to pathogen population and disease index.In late May to early June when the 7 d average of temperature was higher than 22℃,tobacco bacterial wilt entered initial stage with the amount of pathogen population higher than 5.0×105cfu/mL.Then disease entered a stable period of development from the first ten days to the second ten days of June,At this stage,the average temperature of 7 d ranged from 22 to 25℃,the pathogen population varied between 1.0×105and 2.2×106cfu/g.The epidemic outbreak of tobacco bacterial wilt was in the middle and the last ten-day period of June when the average of temperature was higher than 25℃.At this stage,the pathogen population was higher than 2.2×106cfu/g.Therefore,the temperature is important in forecasting and prevention of tobacco bacterial wilt in Nanping.
tobacco;bacterial wilt;climate factor;correlation;Nanping
S435.72
1007-5119(2016)03-0057-05
10.13496/j.issn.1007-5119.2016.03.010
中国烟草总公司重点项目(110200902065);福建省烟草公司南平市公司科技计划项目(NY201203)
林勇(1984-),男,硕士,助理农艺师,主要从事烟叶生产技术研究。E-mail:linyongnp@126.com。*通信作者,E-mail:baiwmnp@163.com
2016-01-27
2016-05-06
