金花茶花朵总皂苷体外抗氧化实验研究
2016-08-03程金生韦卓恒陈信炎郑启祥欧阳小月
程金生 韦卓恒 陈信炎 郑启祥 梁 香 欧阳小月
1.嘉应学院医学院客家养生保健研究所,广东 梅州 514031;2.广东韶关学院生物医药实验室,广东 韶关 512005
金花茶花朵总皂苷体外抗氧化实验研究
程金生1,2韦卓恒1陈信炎1郑启祥1梁香1欧阳小月2
1.嘉应学院医学院客家养生保健研究所,广东梅州514031;2.广东韶关学院生物医药实验室,广东韶关512005
【摘要】目的:研究金花茶花朵总皂苷活性成分的抗氧化活性。方法:以金花茶花朵为原料,以乙醇为提取介质,通过Amberlite XAD-4 非离子型大孔树脂分离纯化金花茶花朵中总皂苷,以维生素C(VitC)为对照品对金花茶花朵总皂苷进行抗氧化及还原能力实验。结果:金花茶花朵总皂苷回收率为90.2%;羟基自由基清除能力、有机自由基清除能力、氧阴离子清除能力、亚硝酸根离子清除能力等实验自由基清除率的半数抑制浓度(IC50)分别为0.75 mg/ml、0.05 mg/ml、0.26mg/ml; 还原能力试验自由基清除率的半数抑制浓度(IC50)为0.83 mg/m。结论:金花茶花朵具有较好的抗氧化能力,是一种较好的天然自由基清除原料。
【关键词】皂苷;金花茶;花朵;抗氧化活性
金花茶(CamellianitidissimaChi)在《中国植物志》[1]系统地定位为山茶科、山茶族、山茶属。1933年中国山茶科植物研究专家、中山大学张宏达教授在景烈采到第一株金黄色山茶花标本。1960年,广西药物研究所学者在广西十万大山采集标本时发现大面积金黄色茶花,并正式命名为金花茶[2]。金花茶是我国一级重点珍稀保护植物,有着“植物界大熊猫”之美称。其叶和花等部位除富含茶多酚、β-谷甾醇、总黄酮、多种氨基酸、齐墩果酸、可溶性糖、天然维生素E等天然活性成分外,皂苷也是其主要活性成分之一[3-4]。一些研究者开展了金花茶皂苷类活性成分的提取分离及相关活性研究。如苏琳等利用超声提取、大孔树脂富集以及制备色谱等技术对金花茶叶水溶性部分进行分离纯化,得到3个单体化合物,运用核磁共振、质谱、红外等表征手段进行结构鉴定,确定分别为人参皂苷Rg1、人参皂苷F1和人参皂苷F5等[5]。黄艳等由金花茶分离得到了一种达玛烷皂苷类新化合物,新化合物被命名为(3β,6α,12β)-3,6,12-三羟基达玛烷-24-烯-20-甲基-2-O-β-D-吡喃葡萄糖-(2→1)-O-β-D-吡喃葡萄糖-(2→1)-O-α-L-吡喃鼠李糖苷。作者采用CCk-8法对该化合物进行了抗肿瘤活性实验,结果显示该化合物可以有效抑制人肺癌BeL-7402细胞和人肝癌SMMC-7721细胞的生长[6]。
随着长寿及养生产业的快速发展,人们对天然、无毒的抗氧化剂需求日益增大。金花茶作为卫生部批准的新资源食品之一,皂苷活性成分丰富,并开展了金花茶叶中皂苷抗氧化的相关研究[7]。研究以金花茶花朵为原料,通过乙醇提取及Amberlite XAD-4 非离子型大孔树脂纯化,得到纯化后的金花茶花朵总皂苷,并开展金花茶总皂苷抗基自由基(·OH)、抗二苯基苦基苯肼自由基(DPPH·)、抗超氧阴离子(O2-·)自由基、抗亚硝酸盐(NO2-)等抗氧化实验及还原能力实验研究。
1仪器、材料与方法
1.1仪器FA-A/JA-N 电子天平(海民桥精密科学仪器有限公司);恒温水浴锅(江苏金坛市金城国盛实验仪器厂);旋转蒸发仪(上海亚荣生化仪器厂);TU-1901双光束可见分光光度计(上海光谱仪器有限公司);KQ3200E型超声波清洗器(昆明市超声仪器有限公司);GL-25M离心机(上海赵迪生物科技有限公司);电子天平(上海实干实业有限公司);Wi94186恒温水浴箱(北京东西仪科技有限公司)。
1.2材料金花茶花朵等原料由广东盛世通生物有限公司提供。Amberlite XAD-4非离子型大孔树脂(阿拉丁试剂(上海)有限公司),人参皂苷Rb1(上海生工)。所用试剂均为分析纯,购于广州化学试剂有限公司。金花茶花朵总皂苷提取液为自制。
1.3提取或检测方法
1.3.1金花茶花朵优选及花朵中总皂苷分离纯化采摘秋季新鲜的金花茶花朵,采用电子秤称重;对采摘的新鲜金花茶花朵按照《中华人民共和国药典》(2010年版)要求进行优选,除去质量较差花朵,优选出的金花茶花朵原料必须符合无霉变、无异味、无杂质等药典要求;将优选出金花茶花朵洗净后,真空干燥得金花茶花朵干品。
取上述干品300 g,用多功能粉碎机粉碎,过30目筛,随后加入1.5 L 95%乙醇,置于超声清洗仪(90 kHz)超声提取30min,合并3次提取液,采用旋转蒸发仪除去乙醇,加水至200ml,加石油醚250ml萃取,重复两次,留水层;再用等体积正丁醇萃取,合并正丁醇萃取液,旋转蒸发仪回收正丁醇,得金花茶花朵总皂苷浸膏。该浸膏用甲醇定容在100ml容量瓶中,即得待测样品溶液,备用。精密吸取待测溶液0.1ml于试管中,水浴挥干甲醇,依次加入新配置的5%香草醛-冰醋酸溶液0.2ml和高氯酸0.8ml,于60℃水浴加热15min,随后冰浴冷却5min,加冰醋酸5ml摇匀,以试剂为空白对照,产物在560nm处测定吸收值,计算样品溶液中金花茶皂苷含量:金花茶皂苷含量=样品溶液中皂苷含量(mg)/样品质量(g)。
参考并改进文献方法[8],采用Amberlite XAD-4非离子型大孔树脂(洗脱剂:10%、20%、30%异丙醇),原液上样(质量浓度24.42mg/ml,pH 4.8),上样流速为1.20 BV/h,洗脱过程首先用1.25 BV,蒸馏水除杂,再依次用1.75 BV和2 BV对金花茶花朵总皂苷提取液进行分离除杂,得到较纯金花茶花朵总皂苷,供后续抗氧化实验使用。
1.3.2检测方法
1.3.2.1金花茶花朵中总皂苷含量测定采用香草醛-硫酸法测定,以人参皂苷Rb1为标准物质,作标准曲线,并计算样品中皂苷的含量。人参皂苷Rb1对照品经香草醛-高氯酸显色后于TU-1901双光束可见分光光度计上作最佳吸收波长扫描,并绘制扫描曲线,显色后,反应物在560nm处有最大吸收且2 h内吸光度保持稳定。
1.3.2.2标准曲线的绘制精密吸取人参皂苷Rb1标准品溶液1ml(浓度分别为:0.1、0.08、0.05、0.02、0.01mg/ml)于试管中,水浴挥干甲醇,加5%香草醛-冰醋酸溶液0.2ml,高氯酸0.8ml,于60℃水浴加热15min,随后水中低温冷却5min,加冰醋酸5ml摇匀,以实际空白对照,反应产物在560nm处测定吸收值,以人参皂苷Rb1为对照品绘制测定标准曲线[9]。
1.4体外抗氧化实验
1.4.1金花茶花朵总皂苷对羟基自由基(·OH)清除能力的测定
1.4.1.1实验原理羟基自由基(·OH)是体内最活泼的活性氧,具有极强的氧化能力。该实验方法采用芬顿体系,在各自的吸收范围内测定吸光度值的变化,可得到受试抗氧化剂清除·OH的情况。
1.4.1.2实验方法在试管中加入4.5ml pH=7.4的磷酸缓冲溶液,1.5ml 1.5 mmol/l的邻二氮菲溶液,充分混匀,加入1ml 1.5 mmol/l FeSO4溶液,立即混匀,加入1ml维生素C标准液标准液(0.25mg/ml),金花茶待测液的浓度依次为0.5、0.75、1、1.5mg/ml。分别混匀,再加入1ml 0.02%H2O2,同时做样品空白试验。另做损伤管和未损伤管,其中损伤管中加入1ml 0.02%H2O2与1ml的蒸馏水,未损伤管不加H2O2,直接加入2ml蒸馏水(损伤管与未损伤管用磷酸缓冲液调零)。于37℃保温60min,510nm处测A值,重复2次,羟基自由基的清除率按照下式计算:

1.4.2金花茶花朵总皂苷对有机自由基DPPH·清除能力的测定
1.4.2.1实验原理DPPH·(1,1-二苯基苦基苯肼)是一种人工合成的自由基。该物质在517nm有强烈的吸收峰,其乙醇水溶液呈深紫色,加入受试物后,测定在同一时间内不同浓度抗氧化剂对DPPH·吸光度的影响,反映其抗氧化能力的强弱。
1.4.2.2实验方法取不同浓度的各试样液4ml于试管中(其中维生素C标准液和金花茶待测液的浓度依次为0.01、0.05、0.25、0.5、1.0mg/ml),再加入4ml DPPH·的乙醇溶液(浓度为200 μmol/l),混合均匀,避光保存0.5 h后用分光光度计在517nm处测定其吸光度A1:同时测4ml DPPH·溶液+4ml 乙醇混合后的吸光度A,对照和4ml提取液加4ml乙醇混合后的吸光度A样品空白,重复2次,按下式计算各试样对DPPH·的清除率:
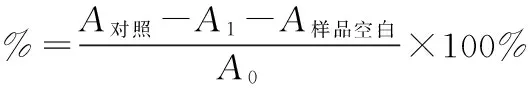
1.4.3金花茶花朵总皂苷对超氧阴离子(O2-·)清除能力的测定
1.4.3.1实验原理实验通过用过氧化物酶(如辣根过氧化物酶)催化东莨菪原被H2O2氧化生成非荧光产物。将受试物加入该反应体系,检测非荧光物质的生成情况,以了解受试物同H2O2反应的情况。
1.4.3.2实验方法取6支具塞试管,分别加入4.5ml pH=8.2 Tris-HCl缓冲溶液和1ml不同浓度的各试样液(其中维生素C标准液和金花茶待测液的浓度依次为0.01、0.03、0.05、0.1、0.3mg/ml)。置于25℃水浴中保温25min,随后加入25℃下预热的0.3ml邻苯三酚(3 mmol/l)启动反应,在30s 内加入5ml蒸馏水,最后在25℃水浴下继续反应4min,立即滴加0.5ml 浓度为8 mol/l 的HCl终止反应。在325nm波长处测定吸光度。同时设置对照管,对照管以缓冲溶液调零。加药管则分别以相同浓度样品液调零实,重复2次,按下式计算超氧阴离子的清除率:
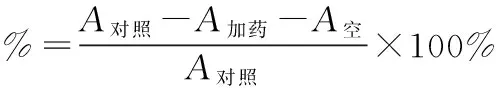
1.4.4金花茶花朵总皂苷对亚硝酸根离子(NO2-)清除能力的测定1.4.4.1实验原理在弱酸条件下,亚硝酸盐与对氨基苯磺酸重氮化,再与盐酸萘7-胺偶合形成紫红色染料,其最大吸收波长在538nm,能够清除亚硝酸盐(NO2-)的物质可使紫红色染料538nm的吸光度值减弱,因此可通过测定在538nm的吸光度值间接反应受试物清除亚硝酸盐(NO2-)的能力。
1.4.4.2实验方法NaNO2标准曲线的绘制 配制10、7.5、l、2.5、1μg/ml的NaNO2溶液,在538nm波长处测定吸光度,绘制曲线。用移液管精确吸取亚硝酸钠标准液0.0、0.2、0.4、0.6、0.8、1.0、1.5、2.0、2.5ml于一组50ml容量瓶中,各加水至25ml,分别加入2ml 0.4%对氨基苯磺酸溶液,摇匀。静置3到5min后加入1ml 0.2%盐酸萘乙二胺溶液,并用重蒸水定容到50ml,摇匀,静置15min后,用分光光度计在540nm波长下测定吸光度,以蒸馏水为空白。以测得的各比色液的吸光度对应的亚硝酸浓度作曲线。比色液中亚硝酸钠浓度为0~0.3μg/ml时,两者呈直线关系。
对亚硝酸根离子(NO2-)清除能力的测定:取1ml不同浓度的各试样液于10ml比色管中(其中维生素C标准液与金花茶待测液的浓度依次为0.1、0.5、1 、3、5mg/ml)。加入5μg/ml的NaNO2标准溶液0.5ml,在37℃恒温水浴中反应30min 。取出后立即加入1ml 0.4%的对氨基苯磺酸溶液,混匀,静置5min后加入0.5ml 0.2%的盐酸荼乙二胺溶液,加水至l0ml刻度,混匀,静置15min,以不加NaN02和样品溶液的试剂为空白,于538nm处测定吸光值。通过NaNO2标准曲线得到相应的NaNO2含量。重复两次,按下式计算其平均值。
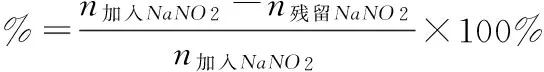
1.4.5金花茶花朵总皂苷还原能力的测定
1.4.5.1实验原理还原能力的测定是以待测样是否为一良好的电子供应者为评价。若是其供应的电子除可以使Fe3+还原成Fe2+外,还可与自由基结合成惰性的物质,中断自氧化链锁反应,可认为是良好的电子供应者。
1.4.5.2实验方法在2.5ml pH=6.6的磷酸盐缓冲液中加入不同浓度的各试样液2.5ml(其中维生素C标准液与金花茶待测液的浓度依次为0.01、0.03、0.05、0.1、0.3mg/ml)和1%的铁氰化钾溶液2.5ml,混合物在50℃下恒温20min后,再加入2.5ml 10%的三氯乙酸溶液,然后以3000 r/min离心分离10min,取上层清液5ml,加蒸馏水5ml和0.1%FeCl3溶液1ml,在700nm处测定吸光度,吸光度越高,还原能力越强。
2结果与分析
2.1金花茶花朵中总皂苷分离纯化及含量测定采用香草醛-硫酸法测定,以人参皂苷Rb1为标准物质,以实际空白对照,溶液经香草醛-高氯酸显色后于双光束可见分光光度计上作最佳吸收波长扫描,作标准曲线,并计算样品中皂苷的含量,结果见表1。人参皂苷Rb1对照品浓度范围为0.001~0.01mg/ml。
上样前金花茶花朵粗皂苷浓度为69.9mg/ml,经过Amberlite XAD-4 非离子型大孔树脂吸附,梯度浓度的异丙醇洗脱后,得到洗出液。当继续浓缩到与上样液等体积时,粗皂苷溶液浓度为63.1mg/ml,皂苷回收率为90.2%。上述实验结果证明XAD-4非离子型大孔树脂有较好的分离纯化金花茶花朵中总皂苷的能力。这主要源于皂苷为中等极性物质,根据相似相溶原理,较易溶于极性较大的溶剂。实验显示,金花茶花朵总皂苷在95%乙醇中的溶解度比在水或无水甲醇中的溶解度更大(见表2)。基于此,下述实验均采用95%乙醇为提取介质分离纯化金花茶花朵中总皂苷供后续抗氧化实验使用。

表1 不同浓度人参皂苷Rb1的吸光度
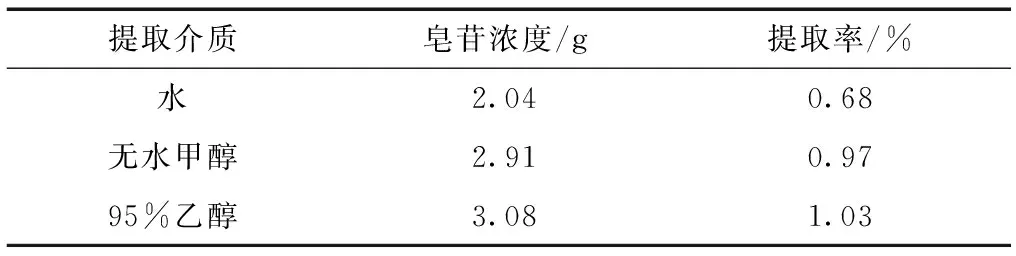
表2 不同方法金花茶花朵中总皂苷的提取率
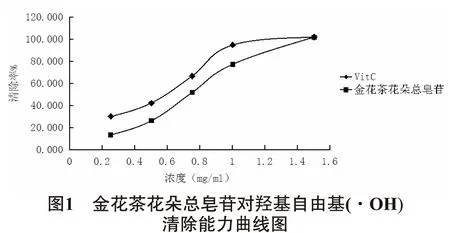
2.2总皂苷对羟基自由基(·OH)清除能力的测定由图1可知,金花茶花朵中总皂苷和维生素C对对羟基自由的清除率与浓度呈正相关关系,二者有剂量依赖性,且清除率随浓度的增大而提升。金花茶花朵总皂苷浓度介于0.25mg/ml~1.52mg/ml之间时,其清除率均稍低于维生素C标准品的清除率。当金花茶花朵总皂苷浓度达到1.52mg/ml时,两者清除率均达到了峰值,且二者的清除率基本相等。表明金花茶花朵总皂苷对对羟基自由基有较好的清除能力,且浓度在1.52mg/ml时清除率达到峰值,高达100%。此外,当金花茶花朵总皂苷浓度范围在0.5~1.0mg/ml时,其对羟基自由基的清除率率线性良好,IC50为0.75mg/ml。
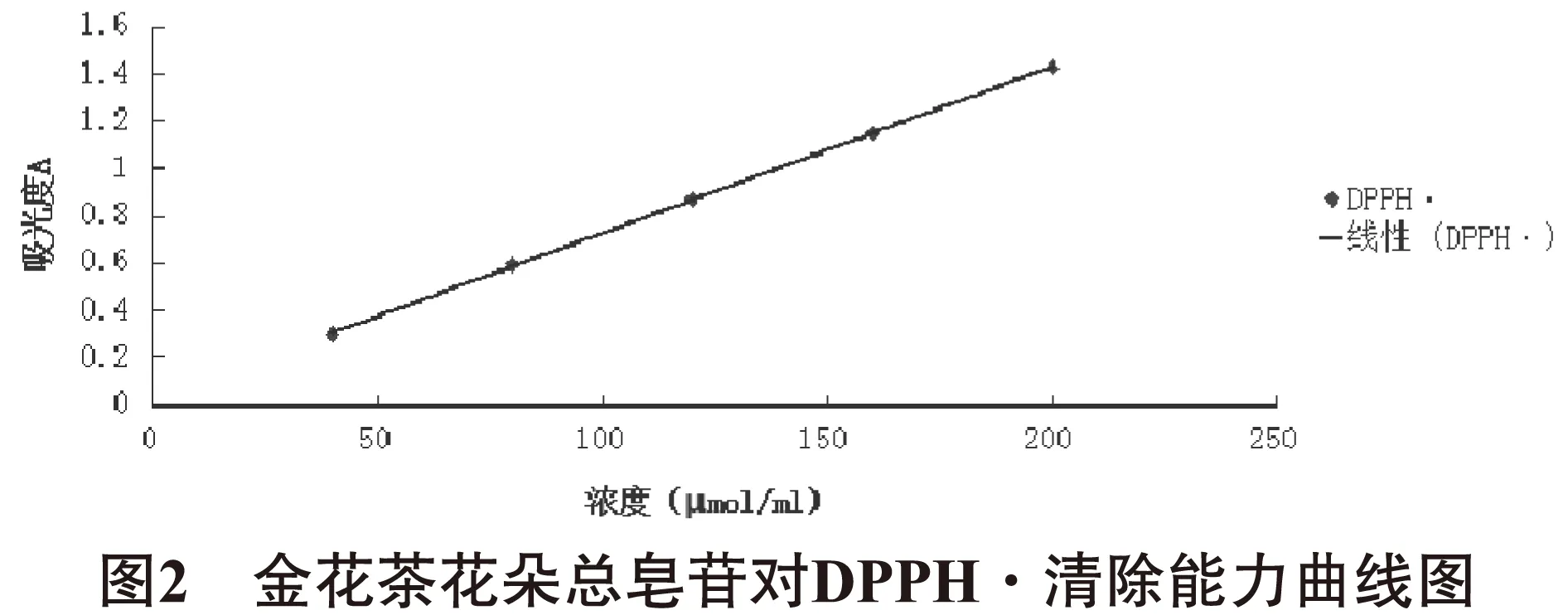
2.3总皂苷对有机自由基DPPH·清除能力的测定以吸光度A值为纵坐标,以自由基DPPH·浓度(μmol/ml)为横坐标,作标准曲线。得回归方程:Y=0.0070X+0.0256,R2=0.9998(Y:吸光度;X:DPPH·浓度),其线性范围为40~200 μmol/ml。见图2。
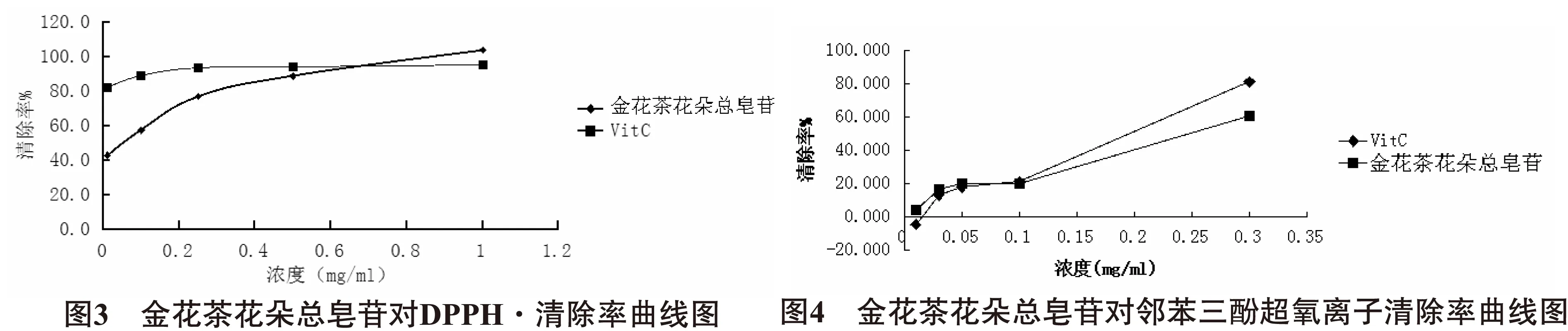
由图3可知,VitC标准品与金花茶花朵总皂苷对DPPH·的清除率均随浓度的增加而增加,金花茶花朵总皂苷对DPPH·的清除率与浓度基本呈线性关系。在较低浓度下,金花茶花朵总皂苷对DPPH·已有较强的清除能力。在0.01~0.25mg/ml浓度范围时,金花茶花朵总皂苷清除率亦有较好的线性关系,IC50为0.05mg/ml。当金花茶花朵总皂苷在0.07mg/ml时,其对DPPH·自由基的清除率为85.2%,与VitC标准品对DPPH·自由基的清除率数据实现交叉。当金花茶花朵总皂苷大于0.07mg/ml时,其对DPPH·自由基的清除率均高于VitC标准品对应的清除率,充分展现了金花茶花朵总皂苷在清除有机自由基DPPH·方面的优势。
2.4总皂苷对超氧阴离子(O2-·)清除能力的测定由图4可知,金花茶花朵总皂苷、VitC对超氧阴离子(O2-·)有一定的清除能力,并且清除能力随着浓度的增大而提升。当浓度低于0.1mg/ml时,金花茶花朵总皂苷的清除能力比等同浓度下VitC清除能力强。当金花茶花朵总皂苷浓度大于0.1mg/ml,其对超氧阴离子(O2-·)的清除率反而低于同浓度下VitC对超氧阴离子(O2-·)的清除率。当二者浓度均为0.3mg/ml时,金花茶花朵总皂苷清除率为60.9%,低于VitC清除率(81.2%)。表明在低浓度下金花茶花朵总皂苷才具有优于VitC标准品的超氧阴离子(O2-·)清除效率,金花茶花朵总皂苷IC50为0.26mg/ml。
2.5总皂苷对亚硝酸根离子(NO2-)清除能力的测定为衡量金花茶花朵总皂苷对亚硝酸根离子(NO2-)清除能力,以吸光度A值为纵坐标,亚硝酸钠浓度(μg/ml)为横坐标,得回归方程式为:Y=0.5041X+0.0012,R2=0.9914(Y:吸光度;X:亚硝酸钠浓度),其线性范围为0.06 μg/ml~0.63 μg/ml。见图5。
由图6可知,VitC与金花茶花朵总皂苷对亚硝酸根的清除率均随浓度的增大而升高。当金花茶花朵总皂苷浓度小于1mg/ml时,其清除效果略微强于VitC。当金花茶花朵总皂苷浓度达到1mg/ml时,其清除率达到了53.6%以上,与VitC清除率相等。在1.0mg/ml~5.0mg/ml范围内,金花茶花朵总皂苷对亚硝酸根清除率仅有微幅提示,提升幅度显著弱于等浓度下VitC标准品。表明金花茶花朵总皂苷对亚硝酸钠的清除能力仅在低浓度下具有相对VitC标准品略优的清除率,其IC50为0.83mg/ml。

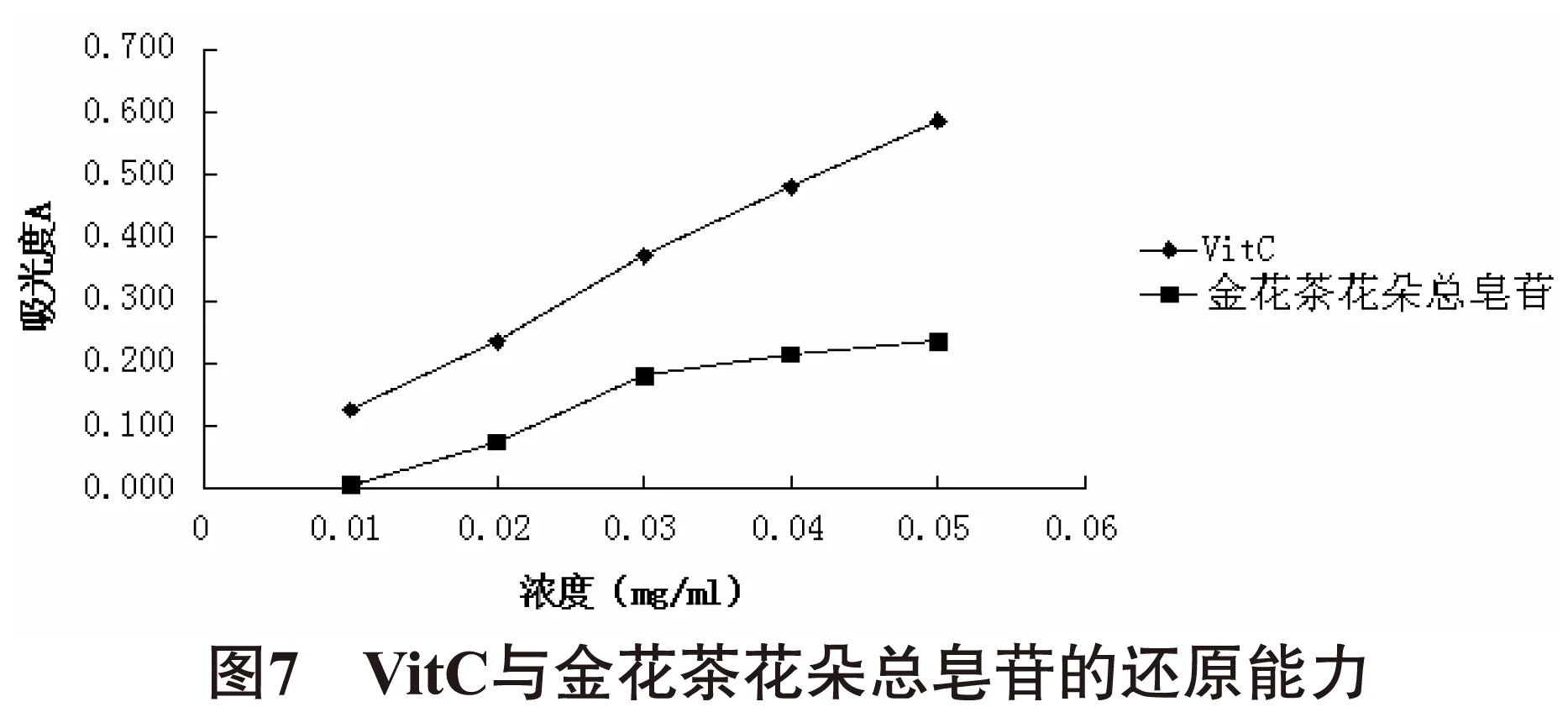
2.6金花茶总皂苷还原能力的测定[10-11]维生素C与金花茶花朵总皂苷具有良好的还原能力,是良好的电子供应者,其供应的电子除可以使Fe3+还原成Fe2+外,还可以与自由基成为较惰性的物质,从而中断自氧化连锁反应。由图7可知,在700nm处测定吸光度,吸光度越高,则还原能力越强。但低浓度下,金花茶花朵总皂苷还原能力有限,如当其浓度在0.01mg/ml时,其吸光度值接近0。而当金花茶花朵总皂苷浓度为0.03mg/ml时,其吸光度值大幅升高到37.1%。当金花茶花朵总皂苷浓度范围在0.03mg/ml-0.05mg/ml范围时,其还原能力(A值)仅有小幅提升。在所有浓度范围内,金花茶花朵总皂苷还原能力均显著低于维生素C。表明在还原能力方面,金花茶花朵总皂苷并不具优势。
3结论
研究采用乙醇为提取介质对金花茶花朵中总皂苷进行提取,通过Amberlite XAD-4 非离子型大孔树脂分离纯化金花茶皂苷,回收率为90.2%。以维生素C为对照品对金花茶花朵中总皂苷进行了羟基自由基清除能力、有机自由基清除能力、氧阴离子清除能力、亚硝酸根离子清除能力等四种抗氧化实验及还原能力实验,不同自由基的四种抗氧化实验均有一定的抗氧化能力,四种抗氧化实验自由基清除率半数抑制浓度(IC50)分别为0.75、0.05、0.26、0.83mg/ml。在还原能力方面,金花茶花朵中总皂苷弱于同浓度下维生素C。表明金花茶是一种较好的天然自由基清除原料,有望作为食品工业、日用化学品工业的天然抗氧化剂,具有深一步的研究与开发意义。
参考文献
[1]中科院“中国植物志”编辑委员会.中国植物志[M].北京:科学出版社,2013:101-116.
[2]秦小明,宁恩床,李建强.金花茶食品新资源的开发利用[J].广西热带农业,2005,(2):20-22.
[3]程金生.石墨烯-顶空搅拌棒联用技术检测金花茶中挥发油类成分[J].现代化工,2015,(7):173-177
[4]宁恩创,秦小明,杨宏.金花茶叶水提物的降脂功能试验研究[J].广西大学学报(自然科学版),2004,29(4):350-352.
[5]苏琳,莫建光,韦英亮,等.金花茶叶皂苷类成分研究[J].中草药,2012,43(5):877-879.
[6]黄艳,莫建光,韦英亮,等.金花茶皂苷A及其制备方法和抗肿瘤用途[P].专利公开号:CN104262445A.
[7]宁恩创,熊燕,韦璐,等.金花茶皂甙的抗氧化活性研究[J].食品科技,2009,(11):197-199.
[8]曾秋文,林华娟,秦小明.金花茶皂甙的分离纯化研究[J].食品科技,2010,(10):233.
[9]傅春燕.三七叶总皂苷的提取纯化及其抗抑郁活性研究[J].河北医药,2013,35(17):2578-2580.
[10]李丽,刘春明.中药抗氧化成分的现代分离和分析技术[M].北京:科学出版社,2011.
[11]梁霄,莫建光,刘布鸣,等.三种金花茶叶的薄层色谱鉴别研究[J].中国民族民间医药杂志,2014,23(21):8-9.
基金项目:广东生扬帆计划引进紧缺拔尖人才项目(粤人才[2015]9号)、广东公益研究与能力建设项目(2015A010105034)、广东省医学科学基金(A2015518)。
作者简介:程金生(1976-),男,江西鄱阳人,博士,副教授,主要从事食品分析、药物分析研究。E-mail:chengjins@gmail.com
【中图分类号】R285.5
【文献标志码】A
【文章编号】1007-8517(2016)10-0027-04
(收稿日期:2016.03.23)
In vitro Antioxidant Experiment Research of Total Saponins in the Flower of Camellia nitidissima Chi
CHENG Jinsheng1,2WEI Zuoheng1CHEN Xinyan1ZHENG Qixiang1LIANG Xiang1OUYANG Xiaoyue2
1.Institute of Hakka Health Care, School of Medicine, Jiaying University,Meizhou 514021, China;2. Biomedical Laboratory, Shaoguan University,Shaoguan 512005,China
Abstract:Objective to study the antioxdidant activity of the total saponins in the flower of Camellia nitidissima Chi. Method By starting from dry flowers of Camellia nitidissima Chi, the ingredients of saponins were extracted by 95% of ethanol. Successively, the saponins extraction was purified by macroporous resin of Amberlite XAD-4. Meanwhile, five series antioxidant experiments VS VitC had been conducted on the saponins extraction of Camellia nitidissima Chi. Results the recovery rate of the extraction and purification experments was 90.2%. Antioxidant experiments and reduction ability experiment were conducted in this work: 1) The hydroxyl radical scavenging capacity; 2) organic radical scavenging capacity; 3) oxygenanion removal ability; 4) the nitrite ion removal ability; 5) reducing abilities experiment. Investigations showed that half of the inhibition of IC50 of the first four clearance rate tests are 0.75 mg/ml, 0.05mg/ml, 0.26mg/ml and 0.83 mg/ml, respectively.Conclusion Camellia nitidissima Chi flower is excellent natural antioxidants with superior antioxidant performance.
Key words:Saponins; Camellia nitidissima Chi, Flower; Antioxidant activitity
