Syndecan-1基因沉默抑制胶质瘤A172细胞增殖和侵袭☆
2016-08-03石爽钟东王兵王文涛张福安黄浩洋
石爽钟东王兵王文涛张福安黄浩洋
Syndecan-1基因沉默抑制胶质瘤A172细胞增殖和侵袭☆
石爽*钟东*王兵*王文涛*张福安*黄浩洋*
目的探讨多配体蛋白多糖-1(Syndecan-1,SDC1)在不同胶质瘤细胞株中的表达水平及其沉默对A172细胞的增殖和侵袭的影响。 方法 通过实时荧光定量PCR(qRT-PCR)和Western Blotting分析SDC1在不同胶质瘤细胞株中的表达水平;将携带SDC1 shRNA的慢病毒载体感染A172细胞,稳定沉默的细胞株为干扰组,未转染为阴性对照组,转染scramble序列为空白对照组;采用MTT法、台盼蓝拒然法和流式细胞术检测细胞增殖能力,Transwell小室实验检测细胞的迁移和侵袭力;qRT-PCR和Western Blotting检测相关蛋白变化。结果 SDC1在不同的胶质瘤细胞株中表达强度不同,差异具有统计学意义(P<0.05)。成功构建稳定沉默SDC1 的A172细胞株;与阴性对照组和空白对照组相比,干扰组细胞增殖受到抑制(P<0.05),迁移力(58.40±5.24 vs. 255.8±16.09、226.5±22.84,F=126.4,P<0.05)和侵袭力(61.67±16.26 vs.233.70±17.24、244.30±28.15,F=69.87,P<0.05)明显抑制;SDC1、PCNA和MMP-9 mRNA和蛋白表达水平明显降低(P<0.05)。结论 沉默SDC1基因的表达可抑制胶质瘤A172细胞的增殖、迁移和侵袭,提示SDC1可能成为胶质瘤生物治疗的新靶点。
胶质瘤 Syndecan-1增殖和侵袭
【Abstract】Objective To investigate the expression of syndecan-1(SDC1)in glioma cells and the effects of syndecan-1 knockdown on the proliferation and invasion of A172 cells.Methods The expression of syndecan-1 in glioma cells was analyzed using quantitative Real-time PCR and Western blotting.A172 cells were transfected with lentiviral vector carrying SDC1 shRNA to establish a stable SDC1-silencing cell line.The cell proliferation was analyzed by MTT assay.Trypan blue exclusion assay and flow cytometry,and Transwell assays were performed to measure the migration and invasion abilities,respectively.The mRNA and protein and expression levels of SDC1,Proliferation Cell Nuclear Antigen(PCNA)and Matrix Metalloproteinase 9(MMP-9)were detected by using qRT-PCR and Western blotting.Results The expression levels of SDC1 were significantly different in different glioma cell lines.The stable SDC1-silencing cell line was successfully established,in which the mRNA and protein expression levels of SDC1 were significantly decreased (P<0.05).SDC1 knockdown significantly reduced the cell proliferation,migration(58.40±5.24 vs.255.8±16.09、226.5± 22.84,F=126.4,P<0.05)and invasion(61.67±16.26 vs.233.70±17.24、244.30±28.15,F=69.87,P<0.05)compared with either control group or blank group.SDC1 knockdown also significantly decreased the mRNA and protein expressionlevels of PCNA and MMP-9(P<0.05).Conclusion:SDC1 knockdown suppresses the capacities of proliferation,invasion and migration of glioma A172 cell,implying that SDC1 may serve as a novel target in the biotherapy of glioma.
【Key words】Glioma Syndecan-1 Proliferation and Invasion
脑胶质瘤是中枢神经系统最常见的原发性颅内肿瘤,患者的中位生存期低于15个月,目前临床综合治疗虽然取得一定进展,但其疗效并不理想[1]。多配体蛋白多糖-1(Syndecan-1,SDC1)是一类Ⅰ型跨膜蛋白多糖,可与广泛的胞外配体及胞膜受体相结合[2],介导胞内外信号的传导,与肿瘤的发生和进展密切相关[3]。然而SDC1在胶质瘤上是否表达尚不确定[4,5]。本课题在此基础上检测SDC1在不同胶质瘤细胞株中的表达水平,利用RNAi技术研究SDC1对胶质瘤增殖和侵袭的影响,寻找胶质瘤生物治疗的新靶点。
1 材料与方法
1.1材料与试剂 人胶质瘤细胞株U251、SHG-44、A172和U87(中国科学院上海细胞库);Syndecan-1-RNAi、scramble序列及转染试剂(上海吉凯基因);RNA及PCR扩增试剂盒(Takara公司)、Syndecan-1、β-actin、MMP-9、PCNA引物(大连宝生物);MTT试剂(Genview corporation);Transwell小室(Millipore);总蛋白提取试剂盒(上海碧云天);Syndecan-1鼠单克隆单体(Thermo Fisher Scientific)、MMP-9兔单克隆单体(Abcam)、PCNA兔单克隆单体(Abcam)。
1.2细胞培养 10%FBS的DMEM培养基,常规加入青霉素-链霉素混合液(1:100),37℃、5%CO2的恒温孵箱中常规培养U251、SHG-44、A172及U87胶质瘤细胞。
1.3 qRT-PCR检测不同细胞株中SDC1的表达水平及A172沉默后相关基因的表达 于对数期收集各组细胞,Trizol法提取各组总RNA,反转录和qRT-PCR反应按说明书进行。反应条件为:95℃预变性30s,95℃5s,58℃30s,40个循环。引物序列如下:syndecan-1-F 5'-CGTGGGGCTCATCTTTGCT-3',syndecan-1-R5'-TGGCTTGTTTCGGCTCCTC-3';β-actin-F 5'-CATGTACGTTGCTATCCAGGC-3',βactin-R 5'-CTCCTTAATGTCACGCACGAT-3';PCNA-F 5'-GTAATGTCGATAAAGAGGAGGAAGC-3',PCNA-R 5'-CATACTGAGTGTCACCGTTGAAGAG-3';MMP-9-F5'-TGTACCGCTATGGTTACACTCG-3',MMP-9-R5'-GGCAGGGACAGTTGCTTCT-3'。
1.4 Western blotting检测不同细胞株中SDC1的表达水平及A172沉默后相关蛋白的表达 收集各组细胞,按说明书提取总蛋白于-20℃保存。将各组蛋白质样品于10%SDS-PAGE凝胶进行电泳。电泳完成后,将蛋白转至PVDF膜,5%脱脂牛奶封闭2h,孵育一抗过夜,稀释比例如下:Syndecan-1 1:200;PCNA 1:200;MMP-9 1:1000;β-actin 1:2000。TBST漂洗后,孵育二抗l h(马抗小鼠1:4 000;山羊抗兔1:2 000),再次经TBST洗膜后,加入ECL发光液显影,采集图像。以β-actin为内参照,用图像处理软件FUSION对条带进行半定量分析。
1.5慢病毒感染胶质瘤A172细胞并构建稳定沉默SDC1的细胞株 取指数生长期A172细胞,按3×105~5×105个/孔接种于6孔板中,常规培养12h,根据预实验选择含干扰效果最佳的靶点序列5'-GACTGCTTTGGACCTAAAT-3'及空白对照组的scramble序列的病毒悬液,依照病毒转染手册加入对应6孔板,转染12h后更换常规培养基。72h后于倒置相差显微镜下观察绿色荧光蛋白表达,嘌呤霉素筛选,构建稳定转染细胞株,将稳定沉默的命名为干扰组(shSDC1),转染Scramble序列的为空白对照组(Blank Control),未转染者为阴性对照组(Negative Control)。并进行扩大培养及后续实验。
1.6 MTT法检测细胞活性 收集各组对数生长期细胞,以1×104个/孔的细胞密度接种于96孔板内,5%CO2的37℃孵箱内培养3d,每孔加入培养液体积10%的MTT,继续培养4h,小心吸取含MTT的培养上清,加入DMSO溶解形成甲臜晶体并通过酶联免疫检测仪测量OD值。每组设6个平行孔,重复3次。数据经Graphpad prism5软件处理,采用多组样本均数间比较。
1.7台盼蓝拒然法绘制生长曲线 取各组对数生长期细胞,以2×104cells/mL接种于6孔板中培养,每组各3个复孔,每24h收集各组细胞,台盼蓝拒然法计数,每孔计数3次,连续测定7次,以细胞数为纵坐标,间隔时间为横坐标绘制成生长曲线。数据经Graphpad prism5软件处理,通过配对t检验分析比较。
1.8流式细胞仪分析细胞周期的变化 收集各对数生长期细胞,以3×105~5×105个/孔的细胞密度接种于6孔板中,12h后更换无血清培养基饥饿16h,再次更换正常培养基,3d后收集各组细胞,75%预冷乙醇固定消化好的单细胞悬液过夜,再次离心收集细胞,加入溴化乙锭(50μg/mL),RNase A (100μg/mL),4℃避光孵育30 min。上流式细胞仪进行检测。
1.9 Transwell小室实验检测细胞迁移和侵袭能力收集对数生长期细胞,于Transwell上室加入200μL细胞悬液,使上室细胞总数为7×105个,并移入含600μL培养基的24孔板中。常规培养8h后,取出Tranwell小室,多聚甲醛固定并结晶紫染色,PBS洗去多余染色,棉签轻轻拭去上层细胞并晾干。将小室的下表面置于光学显微镜下观察,随机选取5个视野(上、中、下、左、右)进行计数并统计分析。侵袭实验需按1:5的比例加入Matrigel包被,迁移时间为20h,其余步骤相同。每个实验组均重复3次。
1.10统计学方法 采用Graphpad prism5分析处理,数据用均数±标准差表示,组间均数比较用单因数方差分析,进一步两两比较采用Tukey test。生长曲线采用配对t检验。检验水准α=0.05。
2 结果
2.1 SDC1在不同的胶质瘤细胞株中表达强度不同qRT-PCR和Western Blotting显示SDC1在胶质瘤A172细胞中高表达,其mRNA相对表达量约是U251星形胶质细胞的4.38倍,差异具有统计学意义(F=26.01,P<0.05);其蛋白的相对表达量约是U251的5.05倍,差异具有统计学意义(F=22.37,P<0.05),SHG-44星形胶质细胞的表达量与U251无明显差异(图1,表1)。

图1 SDC1在不同胶质瘤细胞株的相对表达水平
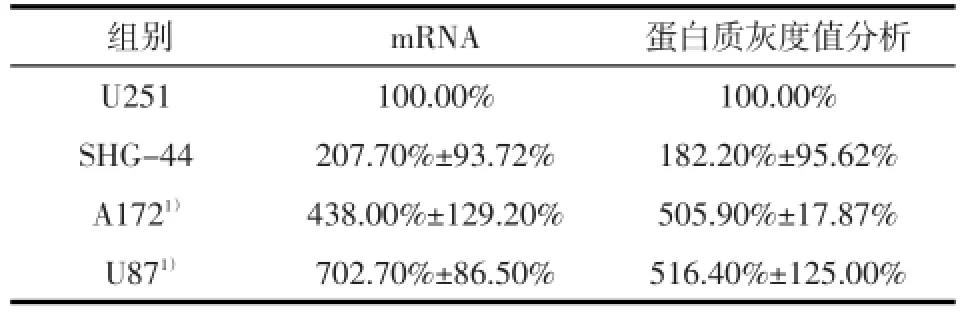
表1 SDC1在不同细胞株中的相对表达量(n=3)
2.2成功够建稳定沉默SDC1的A172细胞株将含Syndecan-1-RNAi和Scrambled序列的病毒悬液转染至胶质瘤A172细胞,镜下见细胞表达绿色荧光蛋白,嘌呤霉素筛选后,流式细胞技术检测转染率分别为 97.82%±0.04%和 83.50%±0.23%(图 2)。qRT-PCR和Western Blot显示稳定转染组中SDC-1mRNA(17.10%±3.63%vs.100.00%、75.78%± 9.82%,F=149.1,P<0.05)和蛋白水平(47.29%± 16.17%vs.100.00%、91.80%±26.88%,F=14.71,P<0.05)明显降低(图3A和表2),提示成功构建稳定株,用于后续实验。
2.3 SDC1的沉默抑制胶质瘤A172细胞的增殖能力 与阴性对照组和空白对照组相比,MTT法显示干扰组生长缓慢,在第3天出现明显的差异(1.44± 0.11 vs.2.22±0.28、2.19±0.10,F=17.3,P<0.05),随着时间的延长,生长曲线显示差异更加明显(P<0.05);流式细胞术发现干扰组S期细胞数目减少,细胞周期被阻滞于G0/G1期,其增殖率(S+G2)/(G1+ S+G2)明显降低(30.84%±3.4%vs.47.76%±0.38%、50.02%±3.38%,F=42.38,P<0.01)(图4)。
2.4 SDC1的沉默抑制胶质瘤A172细胞侵袭和迁移能力 与阴性对照组和空白对照组相比,Transwell迁移实验显示干扰组穿膜细胞数(58.40± 5.24 vs.255.8±16.09、226.5±22.84,F=126.4,P<0.01)明显降低;Transwell侵袭实验显示干扰组穿膜细胞数(61.67±16.26 vs.233.7±17.24、244.3± 28.15,F=69.87,P<0.01)也明显降低,差异具有显著性,阴性对照组和空白对照组无明显差异(图5)。

图2慢病毒成功感染A172细胞 A:携带靶点序列和Scrambled序列的慢病毒感染A172细胞后绿色荧光蛋白的表达(×200);B:嘌呤霉素筛选后的转染率
2.5 SDC1的沉默降低PCNA和MMP-9的表达水平 与阴性对照组和空白对照组相比,qRT-PCR显示干扰组中PCNA mRNA(20.67%±7.38%vs. 100.00%、109.80%±4.01%,F=304.7,P<0.05)和MMP-9 mRNA(27.76%±4.62%vs.100.00%、104.0%±5.98%,F=289.8,P<0.05)相对表达量明显降低;Western blotting显示干扰组中PCNA(65.83%±10.38%vs.100.00%、103.00%±17.68%,F= 9.14,P<0.05)和 MMP-9(55.82%±9.93%vs. 100.00%、100.50%±4.97%,F=47.92,P<0.05)蛋白相对表达量明显降低(图3B,C和表2)。
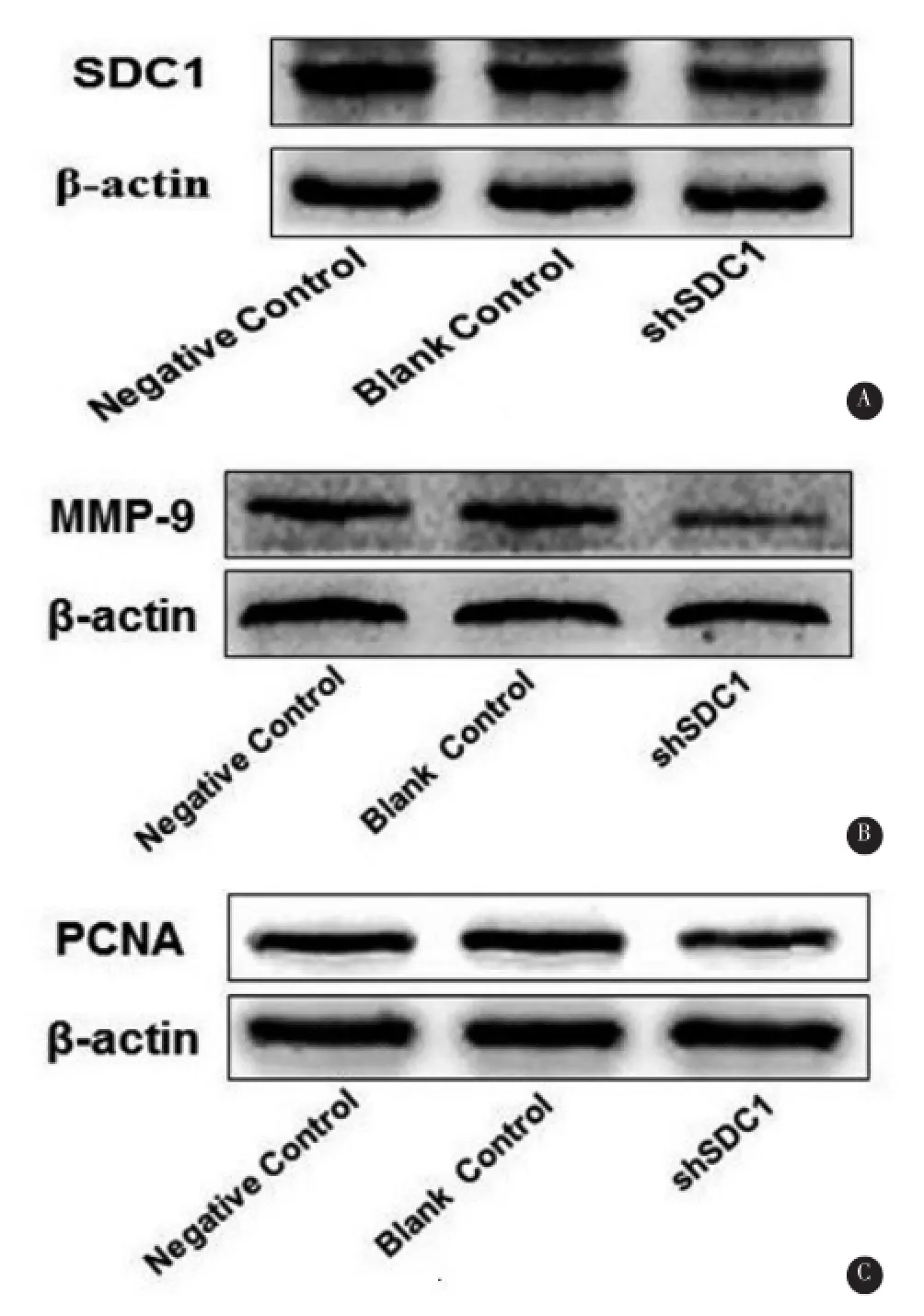
图3 SDC1的沉默抑制PCNA和MMP-9的表达

表2 SDC1的沉默抑制PCNA和MMP-9的表达(n=3)
3 讨论
多配体蛋白多糖(Syndecan)是一类Ⅰ型跨膜蛋白多糖,由跨膜的核心蛋白及其胞外相连的糖胺聚糖链共同组成;其核心蛋白的多功能区和糖胺聚糖链的多态性使其广泛参与细胞的分化、增殖和侵袭[6]。SDC1是一类广泛研究的亚型,其在肿瘤组织间质和瘤细胞的高表达与肿瘤患者的不良预后相关,如乳腺癌、胃癌、胰腺癌[3]、前列腺癌[7]和B淋巴瘤[8]等。然而SDC1在胶质瘤中的表达有相反报道,姜华[4]等发现SDC1在胶质瘤中的表达较正常组织低,其与肿瘤的级别无相关性;XU[5]等检测到SDC1高表达于胶质瘤组织中,且其表达强度与胶质瘤的等级和肿瘤患者的不良预后相关[4,5]。因此SDC1在胶质瘤中的表达尚无定论,其分子功能是否影响胶质瘤恶性生物学行为并不清楚。
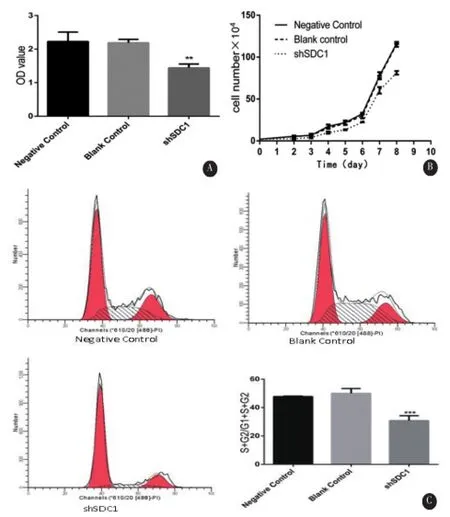
图4 SDC1的沉默抑制A172细胞的增殖。A:MTT法显示SDC1的沉默抑制A172的增殖能力;B:生长曲线显示干扰组生长缓慢;CD:流式细胞术显示干扰组细胞增殖率(S+G2/G1+S+G2)明显下降(mean±SD,n=3,**P<0.05,***P<0.01)
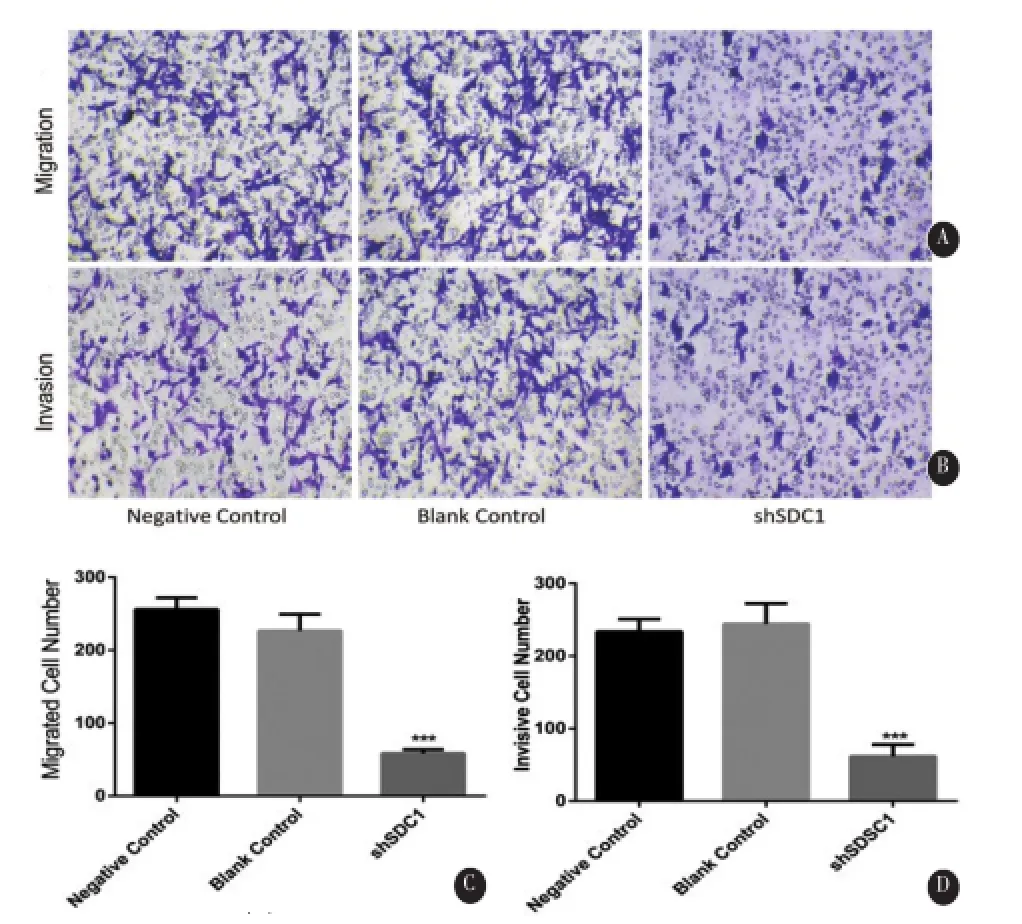
图5 SDC1的沉默抑制A172的迁移和侵袭。AC:SDC1的沉默抑制A172细胞的迁移(×200);BD:SDC1的沉默抑制A172细胞的侵袭(×200)(mean±SD,n=3,***P<0.01)
基于以上研究背景和组织标本对蛋白质与RNA提取纯度影响较大,本研究在不同的胶质瘤细胞株水平进行检测。结果显示,SDC1高表达于A172和U87细胞,低表达于U251和SHG-44细胞(图1和表1)。鉴于A172和U87细胞来源于GradeⅣ级的胶质瘤,U251和SHG-44来源于Grade Ⅱ-Ⅲ级胶质瘤,推测SDC1可能与胶质瘤的等级相关。这一结果与Xu等人的研究相符,进一步提示SDC1可能是胶质瘤的特异性分子标记物。
实验发现SDC1同时高表达于A172和U87细胞,但是其在A172细胞的蛋白水平表达更稳定(图1)。本课题组在此基础上,通过RNAi技术建立稳定沉默SDC1的A172细胞株。通过MTT实验、台盼蓝拒然法和Transwell小室实验发现SDC1基因的沉默抑制了A172细胞的增殖和侵袭(图4A,B和图5)。同时流式细胞术显示SDC1的沉默抑制细胞的S期,使干扰组细胞周期阻滞于G0/G1期,细胞的增殖率降低(图4C),与细胞功能学实验相一致。最后qRT-PCR和Western blotting发现干扰组细胞的PCNA和MMP-9表达降低(图3B,C和表2)。PCNA是一种小分子的核蛋白,与细胞DNA的合成关系密切,在S期的合成达成高峰,其量的变化反应DNA的合成情况和肿瘤细胞增殖及分化程度[9];MMP-9能够裂解肿瘤细胞表面重要的粘附分子,降解胶原蛋白、明胶蛋白等细胞外基质,从而促进肿瘤的侵袭和迁移[10]。PCNA和MMP-9的降低进一步证实SDC1的沉默抑制胶质瘤细胞的增殖与侵袭。
综上所述,SDC1在不同的胶质瘤细胞株中都有表达,且其表达强度可能与胶质瘤的等级相关。SDC1的沉默可能通过抑制胶质瘤A172细胞的PCNA和MMP-9途径抑制其增殖与侵袭,有望成为胶质瘤生物治疗的新靶点。本实验为寻找胶质瘤的特异靶点提供了基础,但SDC1基因沉默后通过何种机制引起PCNA和MMP-9表达的改变,又有哪些信号通路参与,目前尚不清楚,我们将在下一步进行深入的研究。
[1吴劲松,毛颖.脑胶质瘤手术理念和研究热点[J].中国神经精神疾病杂志,2009,35(6):376-379.
[2]XIAN X,GOPAL S,COUCHMAN JR.Syndecans as receptors and organizers of the extracellular matrix[J].Cell and Tissue Research,2010,339(1):31-46.
[3]GHARBARAN R.Advances in the molecular functions of syndecan-1(SDC1/CD138)in the pathogenesis of malignancies[J]. Critical Reviews in Oncology/Hematology,Elsevier Ireland Ltd,2015,94(1):1-17.
[4姜华,周幽心,邵忠,等.Syndecan-1在人脑胶质瘤中的表达及临床意义[J].苏州大学学报(医学版),2005,25(1):113-114.
[5]XU Y,YUAN J,ZHANG Z,et al.Syndecan-1 expression in human glioma is correlated with advanced tumor progression and poor prognosis[J].Molecular Biology Reports,2012,39(9):8979-8985.
[6]KWON MJ,JANG B,YI JY,et al.Syndecans play dual roles as cell adhesion receptors and docking receptors[J].FEBS Letters,Federation of European Biochemical Societies,2012,586(16):2207-2211.
[7]SHIMADA K,ANAI S,FUJII T,et al.Syndecan-1(CD138)contributes to prostate cancer progression by stabilizing tumour-initiating cells.[J].The Journal of pathology,2013,231(4):495-504.
[8]GHARBARAN R,GOY A,TANAKA T,et al.Fibroblast growth factor-2(FGF2)and syndecan-1(SDC1)are potential biomarkers for putative circulating CD15+/CD30+cells in poor outcome Hodgkin lymphoma patients.[J].Journal of hematology&oncology,Journal of Hematology&Oncology,2013,6(62):62.
[9许州,袁先厚,江普查等.Aurora A、PCNA在脑胶质瘤中的表达及临床意义[J].武汉大学学报(医学版),2010(02):227-229,136.
[10姚益群,刘莉萍,傅丹,等.胶质瘤患者肿瘤组织和血浆中MMP-9的表达及意义[J].中华神经外科疾病研究杂志,2014,13(4):322-325.
(责任编辑:甘章平)
Syndecan-1 knockdown inhibits the proliferation and invasion of A172 glioblastoma multiforme cells.
SHI Shuang,ZHONG Dong,WANG Bing,WANG Wentao,ZHANG Fuan,HUANG Haoyang.Department of Neurosurgery,The 1st Affiliated Hospital of Chongqing Medical University,Youyi Road,Chongqing 400016,China.Tel:023-89012163.
R739.41
A
10.3969/j.issn.1002-0152.2016.02.003
☆重庆市科委自然科学基金科研项目(编号:cstc2011jjA10091);财政部、卫生部国家临床重点专科建设项目[编号:财社(2001)170号]
*重庆医科大学附属第一医院神经外科,重庆医科大学附属第一医院实验研究中心(重庆 400016)
(E-mail:zhongdongdp@sina.com)
2015-11-28)
