电针、埋线对小鼠吗啡戒断和耐受调整作用的对比研究
2016-08-02王颖刘文王俊娟陈莎莎熊鹏贾亚妹柏灿薛红成都中医药大学成都60075阳澄湖镇度假区卫生院苏州538
王颖,刘文,王俊娟,陈莎莎,熊鹏,贾亚妹,柏灿,薛红(.成都中医药大学,成都 60075;.阳澄湖镇度假区卫生院,苏州 538)
·动物实验·
电针、埋线对小鼠吗啡戒断和耐受调整作用的对比研究
王颖1,刘文2,王俊娟1,陈莎莎1,熊鹏1,贾亚妹1,柏灿1,薛红1
(1.成都中医药大学,成都 610075;2.阳澄湖镇度假区卫生院,苏州 215138)
【摘要】目的 通过对吗啡戒断、耐受小鼠进行电针和穴位埋线治疗,观察小鼠海马和脊髓中 N-甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体和胆囊收缩素(cholecystokinin, CCK)的表达水平,探讨电针和埋线对吗啡戒断后戒断、耐受小鼠调整作用的差异。方法 将56只雄性C57BL/6J小鼠随机分为戒断空白组、戒断模型组、戒断埋线组、戒断电针组和耐受空白组、耐受模型组、耐受埋线组、耐受电针组,每组7只。吗啡戒断模型根据“7 d递增成瘾法”皮下注射盐酸吗啡注射液,戒断空白组在相同时间点注射等量生理盐水,戒断电针组小鼠每次注射盐酸吗啡注射液 15 min 后,使用韩式穴位神经刺激仪(HANS-200)电针刺激双侧肾俞穴;戒断埋线组于注射盐酸吗啡注射液15 min 后,将0.5 cm铬肠线埋入双侧肾俞穴内。第7天早上10点,腹腔注射盐酸纳洛酮注射液催瘾(4 mg/kg),并观察小鼠戒断反应。根据阿片依赖戒断症状柳田知司测评量表评分,并以酶联免疫吸附剂测定法(Elisa)检测海马和脊髓NMDA受体和CCK含量。按10 mg/kg皮下注射吗啡建立吗啡耐受模型。耐受空白组在相同的时间注射10 mL/kg的生理盐水,耐受埋线组于建立模型第1天在肾俞穴埋线治疗,耐受电针组在建立模型第1天起电针肾俞穴。经7 d治疗后,以Elisa方法检测海马和脊髓的 NMDA受体和CCK含量。结果 戒断模型组海马NR2B和CCK表达与戒断空白组比较,差异均具有统计学意义(P<0.05)。戒断电针组海马NR2B表达与戒断模型组比较,差异有统计学意义(P<0.05)。戒断埋线组和戒断电针组海马 CCK表达与戒断模型组比较,差异均具有统计学意义(P<0.05)。戒断模型组小鼠脊髓NR2A、NR2B、CCK表达与戒断空白组比较,差异均具有统计学意义(P<0.05)。戒断电针组脊髓NR2A、NR2B表达与戒断模型组比较,差异均具有统计学意义(P<0.05)。耐受模型组海马NR1、NR2B、CCK表达与耐受空白组比较,差异均具有统计学意义(P<0.05)。耐受埋线组海马CCK表达与耐受模型组比较,差异具有统计学意义(P<0.05)。耐受电针组海马NR1表达与耐受模型组和耐受埋线组比较,差异均具有统计学意义(P<0.05)。耐受埋线组和耐受电针组脊髓CCK表达与耐受模型组比较,差异均具有统计学意义(P<0.05)。结论 肾俞穴穴位埋线及电针治疗对减轻吗啡耐受及戒断均有治疗效果,且电针治疗优于穴位埋线。
【关键词】针刺疗法;埋线;电针;穴,肾俞(BL23);吗啡依赖;NMDA受体;胆囊收缩素;小鼠;埋藏疗法
吗啡依赖又称吗啡戒断,包括身体依赖和精神依赖[1],精神依赖表现为患者对阿片类药物的强烈的心理渴求,躯体依赖是指长期服用戒断性药物,突然停止药物给予而产生吗啡戒断症状。吗啡耐受是指长期使用吗啡后,吗啡的镇痛效果降低,为了保持与之前相同的镇痛效果,需增加药物的使用量。N-甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体是离子型谷氨酸受体,包括 NR1、NR2A、NR2B 3个主要亚基,NMDA 受体通道在学习记忆中开启[2],是学习和记忆塑造过程中的极其重要的受体之一。目前研究表明吗啡镇痛耐受大鼠的脊髓离子型谷氨酸受体 NMDA 受体的水平增加[3],腹侧被盖区内注射 NMDA受体拮抗剂(MK-801)可以明显缓解吗啡戒断大鼠的戒断症状[4],鞘内注射NOS反义寡核苷酸能减少吗啡戒断大鼠脊髓和脑干的NR1 mRNA的表达,从而抑制大鼠的戒断反应[5],由此说明NMDA受体与吗啡耐受、戒断和戒断的形成有关。胆囊收缩素(cholecystokinin, CCK)是脑内含量最高的神经肽之一,也是作用最强的内源性抗阿片肽,其广泛分布于大脑皮层、海马等神经系统中[6-7],作为神经递质或调质发挥重要作用[8],在调节焦虑等情感和学习认知过程中也发挥着显著作用[9]。因此,笔者认为NMDA受体和CCK均参与了吗啡戒断和耐受的形成。
脊髓、海马均为中枢神经系统,脊髓是传导感觉及运动的重要通路,也与痛觉过敏关系密切;海马为边缘系统,参与了情绪、学习、记忆等活动,亦为奖赏通路中的组成部分,NMDA受体和CCK受体均广泛存在于中枢神经系统。
针灸作为传统的中医疗法,其安全、副反应小,易于让患者接受,但对于吗啡戒断和耐受的针灸治疗方法目前多局限于电针或者针药结合,较少应用埋线疗法,而埋线是针灸治疗的创新模式。故本研究以吗啡戒断后戒断及耐受小鼠模型为基础,采取电针及穴位埋线两种方法治疗,观察这两种方法对小鼠脊髓和海马中NMDA受体及CCK含量影响,通过了解这两种方法的治疗结果间的差异,为临床选择合适的方法治疗吗啡戒断、耐受提供依据。
1 材料与方法
1.1 实验动物
56只健康雄性 C57BL/6J近交系小鼠,清洁级,5周龄,体重(12±2)g,由四川大学华西医学院提供,小鼠合格批号[SCXK(川)2009-09]。将小鼠分别放在鼠笼,并将笼子放在清洁隔离单元内,保持隔音、恒温(23 ±1)℃、通风、相对湿度60%~65%,自由进食饮水。
1.2 分组与造模
将56只C57BL/6J近交系小鼠,随机分为两组,分别为吗啡戒断组和吗啡耐受组,每组28只小鼠。
1.2.1 吗啡戒断模型
利用随机数字表将 28只小鼠随机分为戒断空白组、戒断模型组、戒断埋线组、戒断电针组,每组 7 只。根据 Gang Lu的 7 d递增成瘾法[10]分别于每日早上8:00和晚上8:00皮下注射吗啡,其中第1天的剂量为20 mg/kg,第2天为40 mg/kg,第3天为60 mg/kg,第4天为80 mg/kg,第5天、第6天为100 mg/kg,第7天为100 mg/kg(只在早上注射),戒断空白组每日在相同的时间范围内注射与吗啡模型等量 0.9% 氯化钠注射液,并于第7天末次注射2 h后予纳洛酮催瘾。按照阿片依赖戒断症状柳田知司测评量表观察小鼠1 h内戒断症状并进行评分,每15 min记录1次。
1.2.2 吗啡耐受模型
利用随机数字表将 28只小鼠随机分为耐受空白组、耐受模型组、耐受埋线组、耐受电针组,每组 7只。采用每日 2次,连续 7 d皮下注射吗啡,剂量为10 mg/kg,耐受空白组每日注射10 mg/kg的0.9%氯化钠注射液[11]。
1.3 治疗方法
戒断电针组、耐受电针组于早上注射吗啡30 min后将小鼠固定并进行电针治疗。参照《实验针灸学》取小鼠“肾俞”穴(BL23)。针尖向内下方进针约4 mm,然后连接韩式电针仪,采用经针模式,频率为2/15 Hz,电流为0.2 mA,留针15 min,电针后立即将小鼠放回笼内。每日1次,连续治疗7 d。
戒断埋线组、耐受埋线组根据参考文献[11],在实验第1天上午注射盐酸吗啡注射液后,采用埋线治疗。取小鼠“肾俞”穴(BL23)。将长约0.3 cm的铬肠线埋入穴位肌层或皮下组织内,然后继续接受吗啡注射,不予针刺。
戒断模型组、耐受模型组造模后于针刺时间捆绑固定,以平衡捆绑刺激等影响。戒断空白组、耐受空白组每日注射同等量氯化钠注射液,于注射后捆绑固定,不予其他处理。
1.4 观察指标
吗啡耐受组测定痛阈采用甩尾法,分别于模型建立前1 d测定基线,模型建立第 1、3、5、7 天注射吗啡后30 min,将小鼠尾巴后1/3与前2/3的交界处放置于光热测痛仪散热孔上,开启测痛仪,当小鼠尾部甩开时,测痛仪自动停止计时,痛阈仪上的时间即为小鼠痛阈,连续测量3次,取平均值。
1.5 样本处理
实验第7天,于电针后3 h,采用颈椎脱臼法处死全部小鼠。参考 George Paxinos[12]小鼠大脑立体定位图谱,取其脑部海马,脊髓,迅速放入-80℃冰箱内保存。 Elisa操作具体步骤参照Elisa试剂盒说明书进行操作。
1.6 统计学方法
所有数据采用 SPSS17.0 统计软件进行分析处理,各组数据采用单因素方差分析,方差齐选用LSD检验,方差不齐选用Tamhane's T2检验。以P<0.05表示差异具有统计学意义。
2 实验结果
2.1 戒断组各组吗啡戒断评分比较
本实验吗啡依赖模型建立是根据7 d递增成瘾法,在最后一次皮下注射吗啡后2 h,予腹腔注射4 mg/kg纳洛酮进行催促戒断,主要表现有湿狗样抖、腹泻、跳跃,并出现了不同程度的舔毛、震颤、激惹状态、烦躁不安、咬牙、体重下降等表现,结果表明吗啡戒断和戒断的动物模型建立成功。
由表 1可见,戒断模型组吗啡戒断评分与戒断空白组比较,差异具有统计学意义(P<0.05)。戒断埋线组和戒断电针组吗啡戒断评分与戒断模型组比较,差异均有统计学意义(P<0.05)。戒断埋线组吗啡戒断评分与戒断电针组比较,差异无统计学意义(P>0.05)。
表1 戒断组各组吗啡戒断评分比较 (±s,分)
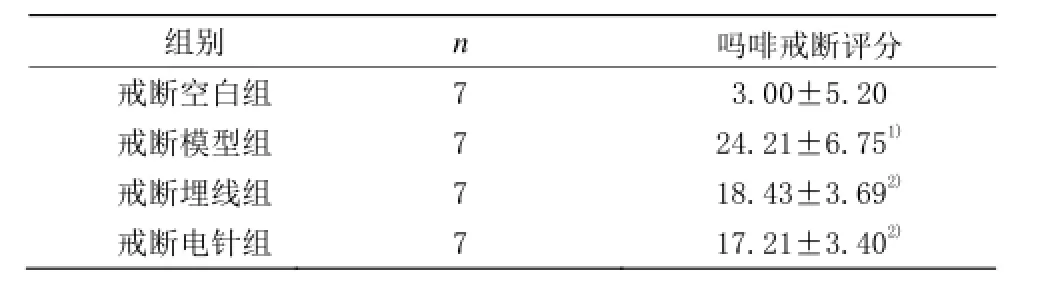
表1 戒断组各组吗啡戒断评分比较 (±s,分)
注:与戒断空白组比较1)P<0.05;与戒断模型组比较2)P<0.05
组别 n 吗啡戒断评分戒断空白组 7 3.00±5.20戒断模型组 7 24.21±6.751)戒断埋线组 7 18.43±3.692)戒断电针组 7 17.21±3.402)
2.2 电针、埋线对吗啡戒断小鼠海马NR1、NR2B、CCK表达的影响
由表2可见,戒断模型组海马 NR1表达与戒断空白组比较,差异无统计学意义(P>0.05)。戒断模型组海马NR2B和CCK表达与戒断空白组比较,差异均具有统计学意义(P<0.05)。戒断埋线组和戒断电针组海马NR1表达与戒断模型组比较,差异均无统计学意义(P>0.05)。戒断埋线组海马NR2B表达与戒断模型组比较,差异无统计学意义(P>0.05)。戒断电针组海马NR2B表达与戒断模型组比较,差异具有统计学意义(P<0.05)。戒断埋线组和戒断电针组海马CCK表达与戒断模型组比较,差异均具有统计学意义(P<0.05)。戒断埋线组海马NR1、NR2B、CCK表达与戒断电针组比较,差异均无统计学意义(P>0.05)。
表2 戒断组各组海马NR1、NR2B、CCK 表达比较 (±s)
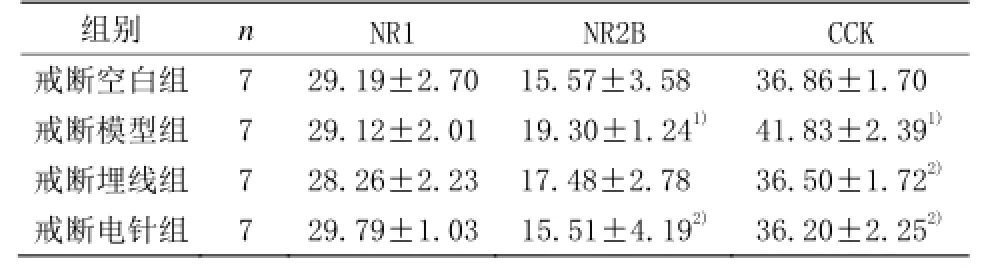
表2 戒断组各组海马NR1、NR2B、CCK 表达比较 (±s)
注:与戒断空白组比较1)P<0.05;与戒断模型组比较2)P<0.05
组别 n NR1 NR2B CCK戒断空白组 7 29.19±2.70 15.57±3.58 36.86±1.70戒断模型组 7 29.12±2.01 19.30±1.241) 41.83±2.391)戒断埋线组 7 28.26±2.23 17.48±2.78 36.50±1.722)戒断电针组 7 29.79±1.03 15.51±4.192) 36.20±2.252)
2.3 电针、埋线对吗啡戒断小鼠脊髓 NR1、NR2A、NR2B、CCK表达的影响
由表3可见,戒断模型组小鼠脊髓NR1表达与戒断空白组比较,差异无统计学意义(P>0.05)。戒断模型组小鼠脊髓NR2A、NR2B、CCK表达与戒断空白组比较,差异均具有统计学意义(P<0.05)。戒断埋线组脊髓NR2A、NR2B、CCK表达与戒断模型组比较,差异均无统计学意义(P>0.05)。戒断电针组脊髓 NR2A、NR2B表达与戒断模型组比较,差异均具有统计学意义(P<0.05)。戒断电针组脊髓CCK表达与戒断模型组比较,差异无统计学意义(P>0.05)。戒断埋线组脊髓NR2A、NR2B、CCK表达与戒断电针组比较,差异均无统计学意义(P>0.05)。
2.4 吗啡耐受空白组和模型组痛阈值比较
由表 4可见,耐受模型组治疗前痛阈值与耐受空白组比较,差异无统计学意义(P>0.05)。耐受空白组小鼠第1、3、5、7天痛阈值与同组治疗前比较,差异均无统计学意义(P>0.05)。耐受模型组小鼠第1、3、5天痛阈值与同组治疗前比较,差异均具有统计学意义(P<0.05)。耐受模型组第7天痛阈值与同组治疗前比较,差异无统计学意义(P>0.05)。说明模型组的痛阈值达到初始水平,提示吗啡耐受模型成功。
2.5 电针、埋线对吗啡耐受小鼠脊髓 NR1、NR2A、NR2B、CCK表达的影响
由表5可见,耐受模型组脊髓NR1、NR2A、NR2B、CCK表达与耐受空白组比较,差异均具有统计学意义(P<0.05)。耐受埋线组和耐受电针组脊髓NR1、NR2A、NR2B表达与耐受模型组比较,差异均无统计学意义(P>0.05)。耐受埋线组和耐受电针组脊髓CCK表达与耐受模型组比较,差异均具有统计学意义(P<0.05)。耐受埋线组脊髓NR1、NR2A、NR2B、CCK表达与耐受电针组比较,差异均无统计学意义(P>0.05)。
2.6 电针和埋线对吗啡耐受小鼠海马NR1、NR2B、CCK表达的影响
由表6可见,耐受模型组海马NR1、NR2B、CCK表达与耐受空白组比较,差异均具有统计学意义(P<0.05)。耐受埋线组海马CCK表达与耐受模型组比较,差异具有统计学意义(P<0.05)。耐受埋线组海马NR1、NR2B表达与耐受模型组比较,差异均无统计学意义(P>0.05)。耐受电针组海马NR1表达与耐受模型组和耐受埋线组比较,差异均有统计学意义(P<0.05)。耐受电针组海马NR2B、CCK表达与耐受模型组和耐受埋线组比较,差异均无统计学意义(P>0.05)。
表3 戒断组各组脊髓NR1、NR2A、NR2B、CCK表达比较 (±s)

表3 戒断组各组脊髓NR1、NR2A、NR2B、CCK表达比较 (±s)
注:与戒断空白组比较1)P<0.05;与戒断模型组比较2)P<0.05
组别 n NR1 NR2A NR2B CCK戒断空白组 7 10.63±3.44 14.89±1.68 11.76±1.22 29.21±5.73戒断模型组 7 10.52±2.18 16.89±1.911) 13.35±1.351) 34.05±2.371)戒断埋线组 7 11.54±2.09 15.53±1.25 12.12±1.50 30.57±4.12戒断电针组 7 10.25±2.71 15.02±1.502) 11.34±1.082) 31.44±2.99
表4 吗啡耐受空白组和模型组造模前后痛阈值比较 (±s)

表4 吗啡耐受空白组和模型组造模前后痛阈值比较 (±s)
注:与同组治造模前比较1)P<0.05
组别 n 造模前 第1天痛阈值 第3天痛阈值 第5天痛阈值 第7天痛阈值耐受空白组 7 1.69±0.49 1.69±0.52 1.90±0.20 2.01±0.22 1.96±0.33耐受模型组 7 1.76±0.33 3.68±1.961) 4.50±1.731) 3.09±0.641) 1.87±0.36
表5 耐受组各组脊髓NR1、NR2A、NR2B、CCK表达比较 (±s)
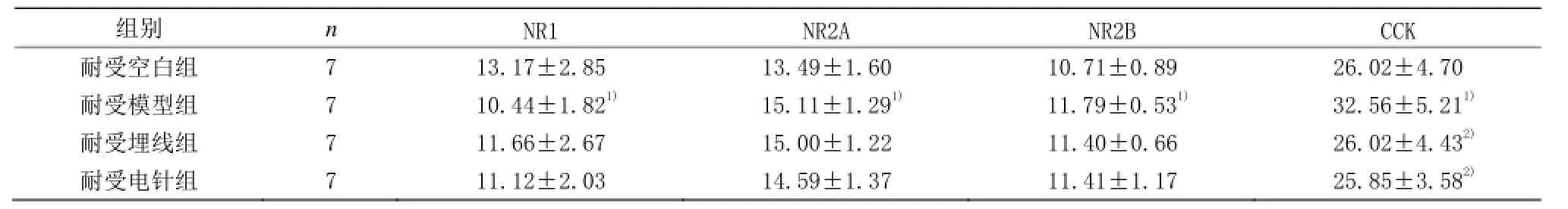
表5 耐受组各组脊髓NR1、NR2A、NR2B、CCK表达比较 (±s)
注:与耐受空白组比较1)P<0.05;与耐受模型组比较2)P<0.05
组别 n NR1 NR2A NR2B CCK耐受空白组 7 13.17±2.85 13.49±1.60 10.71±0.89 26.02±4.70耐受模型组 7 10.44±1.821) 15.11±1.291) 11.79±0.531) 32.56±5.211)耐受埋线组 7 11.66±2.67 15.00±1.22 11.40±0.66 26.02±4.432)耐受电针组 7 11.12±2.03 14.59±1.37 11.41±1.17 25.85±3.582)
表6 耐受组各组海马NR1、NR2B、CCK 表达比较 (±s)
注:与耐受空白组比较1)P<0.05;与耐受模型组比较2)P<0.05;与耐受埋线组比较3)P<0.05
组别 n NR1 NR2B CCK耐受空白组 7 30.09±1.62 14.44±2.56 36.45±3.27耐受模型组 7 27.96±1.181) 19.41±1.281) 39.43±1.761)耐受埋线组 7 28.50±1.81 16.16±3.49 36.76±2.822)耐受电针组 7 30.53±1.552)3) 16.29±3.75 38.96±0.93
3 讨论
吗啡戒断反应、耐受与依赖均为长期使用吗啡后对机体的毒性作用,这与中医学的病因病机相同[13]。有研究[11,14-15]证实,中药、针灸在吗啡耐受和戒断的治疗过程中取得了一定进展,且治疗手段多样。
NMDA受体的吗啡镇痛作用在临床上应用较多,但有证据表明,吗啡等阿片类药物在镇痛的同时亦可产生痛觉过敏[16],一次给予阿片类药物,可以使痛阈升高,但反复给予则镇痛效果减弱[17],为保持与之前相同的镇痛效果,需增加药量,此即为阿片耐受。目前对于吗啡戒断、耐受机制的研究包括了阿片受体、神经递质、受体后机制3个环节。CCK是脑内含量最高的一种神经肽,也是作用最强的内源性抗阿片肽之一,其广泛分布于大脑皮层、海马等神经系统中,作为神经递质或调质发挥重要作用[8]。CCK、CCK受体和内源性阿片肽、阿片受体在中枢神经系统内的分布具有密切关系[18-19],且Lee YM等[20]发现,脑和脊髓的CCK和内源性阿片肽的分布有明显的重叠。长期使用吗啡后,吗啡与体内阿片受体结合,从而负反馈抑制了内源性阿片肽,此时停止使用吗啡,注射纳洛酮后,可完全阻断吗啡与阿片受体的结合,加之内源性阿片肽匮乏,去甲肾上腺素能系统、乙酰胆碱能系统、多巴胺系统等不能保持正常的运行秩序,从而导致吗啡戒断者出现戒断症状[21-22]。
本实验吗啡依赖模型建立是7 d递增成瘾法。戒断模型组的戒断评分明显高于空白组(P<0.05),说明吗啡戒断模型成功建立。与戒断模型组相比,戒断埋线组和戒断电针组的戒断评分明显降低,提示电针及埋线均可明显缓解小鼠的戒断症状。吗啡戒断模型组小鼠海马和脊髓 NR1与戒断空白组比较,差异均无统计学意义(P>0.05),而海马 NR2B、CCK的表达及脊髓NR2A、NR2B、CCK较空白组升高(均P<0.05)。CCK表达升高与文献报道结果一致,说明 CCK参与了吗啡戒断的形成。有研究发现,长期应用吗啡后NMDA受体各亚型的表达结果并不一致,有升高[23-24]、降低[25]或不变[26],Bajo M等[27]观察了阿片耐受大鼠边缘系统中横核和中央杏仁核NR2A、NR2B mRNA及蛋白水平的变化,亦发现mRNA及蛋白表达水平不平衡。本实验结果显示,戒断模型组脊髓和海马中NMDA受体亚型NR1表达与戒断空白组并无统计学差异,其可能是 NR1并不参与吗啡戒断,亦可能是 mRNA和蛋白表达不平行所致,但NR2A、NR2B均有明显的升高趋势,故NMDA受体参与吗啡戒断的形成与文献报道是一致的。与戒断模型组相比,戒断埋线组和戒断电针组小鼠海马、脊髓 NR1 表达均无明显的统计学差异,戒断埋线组海马 CCK表达较戒断模型组降低(P<0.05);戒断电针组海马NR2B、CCK和脊髓NR2A、NR2B表达较戒断模型组均显著降低(P<0.05);戒断埋线组海马NR1、NR2B 和脊髓 NR1、NR2A、NR2B、CCK表达较戒断模型组均无统计学差异(P>0.05),戒断电针组海马NR1和脊髓NR1、CCK表达较戒断模型组均无统计学差异(P>0.05)。说明电针及埋线对吗啡戒断小鼠可以通过降低 NMDA受体及 CCK的表达产生治疗作用。
本实验结果表明,吗啡耐受模型组小鼠海马、脊髓NR1的表达较耐受空白组降低,而海马NR2B、CCK及脊髓NR2A、NR2B、CCK的表达较耐受空白组升高,两组比较差异均具有统计学意义(P<0.05),提示吗啡耐受使CCK、NMDA受体亚型NR2A、NR2B上调,而降低NR1水平。Mao J等[28]研究发现腰髓使用NMDA受体拮抗剂可以阻断吗啡耐受的产生,而颈髓使用却不能阻断,故考虑吗啡耐受的产生部位在脊髓。而吗啡戒断和“奖赏通路”有关,中脑边缘系统是戒断药物发挥奖赏效应的主要神经通路,而阿片等戒断药物导致神经元的可塑性变化是导致戒断和复吸的基础[29]。 故以往研究吗啡戒断、戒断多集中于中脑边缘系统,而研究吗啡耐受多集中于脊髓水平。脊髓、海马均为中枢神经系统,而脊髓为较低水平,是传导感觉及运动的重要通路,也与痛觉过敏关系密切;海马为较高水平的边缘系统,参与了情绪、学习、记忆等活动,亦为奖赏通路中的组成部分。本实验结果显示,吗啡戒断和耐受模型 NMDA受体和CCK的表达在脊髓、海马两个不同水平的变化趋势一致,说明慢性吗啡给予不仅影响了脊髓水平的痛觉传导,也影响了海马参与的情绪、学习、记忆活动。经过电针和埋线治疗后,NMDA受体与CCK水平均得到了不同程度的调整,耐受埋线组海马和脊髓 CCK表达较耐受模型组降低(P<0.05);耐受电针组海马NR1升高和脊髓CCK降低(P<0.05);耐受埋线组海马NR1、NR2B和脊髓NR1、NR2A、NR2B表达较耐受模型组无统计学差异(P>0.05);耐受电针组海马 NR2B、CCK和脊髓NR1、NR2A、NR2B表达较耐受模型组均无统计学差异(P>0.05)。说明电针及埋线可以调整吗啡耐受小鼠脊髓和海马中NMDA受体和CCK的水平而产生治疗作用。
吗啡戒断电针组与埋线组相比,电针组小鼠脊髓和海马中 NMDA受体及 CCK的表达均无统计学差异(P>0.05),但结合整体,戒断埋线组海马 CCK降低明显,而戒断电针组海马NR2B、CCK和脊髓NR2A、NR2B均明显降低(P<0.05),故电针对吗啡戒断的调整在分子水平上较穴位埋线范围更广,且戒断电针组NMDA受体和 CCK整体水平较戒断埋线组更低,结合吗啡戒断症状,电针组的戒断症状评分略低于埋线组,故考虑电针治疗吗啡戒断的效果比穴位埋线佳。吗啡耐受电针组小鼠海马 NR1较耐受埋线组升高(P<0.05),其余NMDA受体亚型和CCK均无明显统计学差异,但穴位埋线中所用羊肠线的吸收时间一般为 10~15 d,吗啡耐受为吗啡长期作用的结果,可能经短时间治疗电针和埋线的效果并不明显,但从本实验的结果来看,电针对吗啡耐受小鼠的治疗效果略优于埋线组。因此,在临床选择治疗吗啡戒断和耐受的方法时,可以选择电针治疗。
参考文献
[1] 李倩,刘萍.阿片类药物依赖性机制研究进展[J].齐鲁药事,2006,25(9):548-549.
[2] 白俊伟,徐波,曹桂霞.记忆储存的分子机制[J].中国临床康复,2005,9(48):100-102.
[3] Wong CS, Hsu MM, Chou YY, et a1. Morphine tolerance increases [3H] MK-801 binding affinity and constitutive neuronal nitric oxide synthase expression in rat spinal cord[J]. Br J Anaesth, 2000,85(4):587-591.
[4] 王惠玲,赵晏,向晓辉,等.腹侧被盖区微注射 MK-801对大鼠吗啡戒断症状的影响[J].第四军医大学学报,2004,25(16):1448-1451.
[5] 曹君利,张励才,曾因明,等.鞘内注射 NOS反义寡核苷酸抑制吗啡戒断大鼠脊髓和脑干NMDA1A受体mRNA表达的增加[J].生理学报,2001,53(1):27-31.
[6] 赵丽,丛斌,吴嫒嫒,等.吗啡对原代培养大鼠海马神经元 CCK受体mRNA表达的影响[J].中国药理学通报,2006,22(4):479-483.
[7] Greenwood RS, Godar SE, Reaves TA, et al. Cholecystokinin in hippocampal pathways[J]. J Comparat Neurol, 1981,203(3):335-350.
[8] Beinfeld MC. An introduction to neuronal cholecystokinin[J]. Peptides, 2001,22(8):1197-1200.
[9] Hebb AL, Poulin JF, Roach SP, et al. Cholecystokinin and endogenous opioid peptides: interactive influence on pain, cognition, and emotion[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2005,29 (8):1225-1238.
[10] Lu G, Zhou QX, Kang S, et al. Chronic morphine treatment impaired hippocampal long-term potentiation and spatial memory via accumulation of extracellular adenosine acting on adenosine A1 receptors[J]. J Neurosci, 2010,30(14):5058-5070.
[11] 王珂,刘惠芬,周文华.“足三里”和“肾俞”穴位埋线对大鼠吗啡镇痛耐受和运动行为敏化的影响[J].中国针灸,2008,28(7):509-513.
[12] George Paxinos, Keith B.J. Franklin. The Mouse Brain in Stereotaxic Coordinates[M]. London: Academic Press, 2001.
[13] 曹阳,王文萍,郭隽馥,等.中药复方对小鼠吗啡镇痛耐受影响的研究[J].中国全科医学,2012,15(30):3554-3556.
[14] 欧桂珍,崔瑾,邹阳,等.艾灸“百会”穴对小鼠盐酸吗啡成瘾行为影响的实验研究[J].中国针灸,1998,18(9):549-550.
[15] 司马蕾,刘波涛,厉建春,等.电针对骨癌痛-吗啡耐受大鼠痛行为和降钙素基因相关肽的影响[J].中华行为医学与脑科学杂志,2013,22(5):388-390.
[16] Laulin JP, Célèrier E, Larcher A, et al. Opiate tolerance to daily heroin administration: an apparent phenomenon associated with enhanced pain sensitivity[J]. Neurosci, 1999,89(3):631-636.
[17] Laulin JP, Larcher A, Célèrier E, et al. Long-lasting increased pain sensitivity in rat following exposure to heroin for the first time[J]. Eur J Neurosci, 1998,10(2):782-785.
[18] Crawley JN, Corwin RL. Biological actions of cholecystokinin[J]. Peptides, 1994,15(4):731-755.
[19] Hebb AL, Poulin JF, Roach SP, et al. Cholecystokinin and endogenous opioid peptides: interactive influence on pain, cognition, and emotion[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2005,29 (8):1225-1238.
[20] Lee YM, Beinborn M, McBride EW, et al. The human brain cholecystokinin-B/gastrin receptor. Cloning and characterization[J]. J Biol Chem, 1993,268(11):8164-8169.
[21] Adams WJ, Yeh SY, Woods LA, et al. Drug-test interaction as a factor in the development of tolerance to the analgesic effect of morphine[J]. J Pharmacol Exp Ther, 1969,168(2):251-257.
[22] Kayan S, Woods LA, Mitchell CL. Experience as a factor in the development of tolerance to the analgesic effect of morphine[J]. Eur J Pharmacol, 1969,6(3):333-339.
[23] 杨明理,钱刚,罗素元,等.吗啡条件性位置偏爱大鼠纹状体谷氨酸递质含量和NR2B亚基表达变化[J].解剖学杂志,2012,35(1):69-71.
[24] Narita M, Aoki T, Suzuki T. Molecular evidence for the involvement of NR2B subunit containing N-methyl-D-aspartate receptors in the development of morphine-induced place preference[J]. Neuroscience,2000,101(3):601-606.
[25] Siggins GR, Martin G, Roberto M, et al. Glutamatergic transmission in opiate and alcohol dependence[J]. Ann N Y Acad Sci, 2003,(1003):196-211.
[26] Lim G, Wang SQ, Sung B, et al. Expression of spinal NMDA receptor and PKCgamma after chronic morphine is regulated by spinal glucocorticoid receptor[J]. J Neuroscience, 2005, 25(48):11145-111 54.
[27] Bajo M, Crawford EF, Roberto M, et al. Chronic morphine treatment alters expression of N-methyl-D-aspartate receptor subunits in the extended amygdale[J]. J Neurosci Res, 2006,83(4):532-537.
[28] Mao J, Price DD, Zhu J. The inhibition nitric oxide-activated-vated poly(ADP-ribose) synthetase atenuates transsynaptic alteration of spinal cord dorsal horn neurons and neuropathic pain in the rat[J]. Pain, 1997,72(3):355-366.
[29] Kalivas PW, O'Brien C. Drug addiction as a pathology of staged neuroplasticity[J]. Neuropsychopharmacology, 2008,33(1):166-180.
【中图分类号】R2-03
【文献标志码】A
DOI:10.13460/j.issn.1005-0957.2016.03.0349
文章编号:1005-0957(2016)03-0349-06
收稿日期2015-09-30
基金项目:四川省教育厅基金项目(2005B005);成都中医药大学科技发展基金项目(ZRMS201359)
作者简介:王颖(1988 - ),女,2012级硕士生
通信作者:薛红(1971 - ),女,研究员,Email:cdxuehong@126.com
Comparative Study of the Regulating Effects of Electroacupuncture Versus Catgut Embedding on Mouse Morphine Withdrawal and Tolerance
WANG Ying1, LIU Wen2, WANG Jun-juan1, CHEN Sha-sha1, XIONG Peng1, JIA Ya-mei1, BAI Can1,XUE Hong1.
1.Chengdu University of Traditional Chinese Medicine,Chengdu 610075,China; 2.Yangchenghu Town Resort Area Hospital,Suzhou 215138,China
[Abstract]Objective To observe expression levels of N-methyl-D-aspartate (NMDA) receptor and cholecystokinin (CCK) in the hippocampus and spinal cord in morphine withdrawal or tolerance mice treated by electroacupuncture or catgut embedding and explore the difference between the regulating effects of electroacupuncture and catgut embedding on morphine withdrawal and tolerance. Methods Fifty-six male C57BL/6J mice were randomly allocated to withdrawal control, withdrawal model, withdrawal catgut embedding and withdrawal electroacupuncture groups, and tolerance control, tolerance model, tolerance catgut embedding and tolerance electroacupuncture groups, 7 mice in each group. A model of morphine withdrawal was made by subcutaneous injection of morphine hydrochloride using 7-day increasing addiction method. The withdrawal control group was injected with an equal volume of normal saline at the same time points. In the withdrawal electroacupuncture group, electroacupuncture at bilateral points Shenshu was performed using a Han's acupoint nerve stimulation device (HANS-200) at 15 min after an injection of morphine hydrochloride. In the withdrawal catgut embedding group, 0.5 cm chromic catgut was embedded in bilateral points Shenshu at 15 min after an injection of morphine hydrochloride. Addiction was promoted by intraperitoneal injection of naloxone 4 mg/kg at 10 o'clock on the seventh day's morning and Withdrawal reactions were observed in the mice. The score was recorded using the Ryuta Tomoji opioid withdrawal symptoms evaluation scale. NMDA receptor and CCK contents in the hippocampus and spinal cord were measured by enzyme-linked immunosorbent assay (ELISA). A model of morphine tolerance was made by subcutaneous injection of morphine 10 mg/kg. The tolerance control group was injected with tolerance normal saline 10 ml/kg at the same time. In the tolerance catgut embedding group, catgut was embedded in point Shenshu at the first day after model making. In the tolerance electroacupuncture group, point Shenshu was given electroacupuncture at the first day after model making. After seven days of treatment, NMDA receptor and CCK contents in the hippocampus and spinal cordwere measured by ELISA. Results There were statistically significant differences in hippocampal NR2B and CCK expressions between the withdrawal model and withdrawal control groups (P<0.05). There was a statistically significant difference in hippocampal NR2B expression between the withdrawal electroacupuncture and withdrawal model groups (P<0.05). There was a statistically significant difference in hippocampal CCK expression between the withdrawal catgut embedding or withdrawal electroacupuncture group and the withdrawal model group (P<0.05). There were statistically significant differences in spinal cord NR2A, NR2B and CCK expressions between the withdrawal model and withdrawal control groups (P<0.05). There were statistically significant differences in spinal cord NR2A and NR2B expressions between the withdrawal electroacupuncture and withdrawal model groups (P<0.05). There were statistically significant differences in hippocampal NR2A, NR2B and CCK expressions between the tolerance model and tolerance control groups (P<0.05). There was a statistically significant difference in hippocampal CCK expression between the tolerance catgut embedding and tolerance model groups (P<0.05). There was a statistically significant difference in hippocampal NR1 expression between the tolerance electroacupuncture group and the tolerance model or tolerance catgut embedding group (P<0.05). There was a statistically significant difference in spinal cord CCK expression between the tolerance catgut embedding or withdrawal electroacupuncture group and the tolerance model group (P<0.05). Conclusions Both catgut embedding and electroacupuncture at point Shenshu have a reducing effect on morphine tolerance and withdrawal. The therapeutic effect of electroacupuncture is better than that of catgut embedding.
[Key words]Acupuncture therapy; Catgut embedding therapy; Electroacupuncture; Point, Shenshu; Morphine dependence;NMDA receptor; Cholecystokinin; Mice; Embedding therapy
