秋水仙素和60Co-γ射线对无芒隐子草种子萌发的影响
2016-08-02张代玉张吉宇王彦荣
张代玉,吴 凡,张吉宇,王彦荣,张 岩,罗 栋
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院, 甘肃 兰州 730020)
秋水仙素和60Co-γ射线对无芒隐子草种子萌发的影响
张代玉,吴 凡,张吉宇,王彦荣,张 岩,罗 栋
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院, 甘肃 兰州 730020)
摘要:通过不同剂量秋水仙素和60Co-γ射线处理,系统分析了无芒隐子草(Cleistogenes songorica)种子的发芽率、发芽指数及幼苗生长。结果表明,秋水仙素处理对无芒隐子草种子的发芽率和发芽指数有一定程度的抑制作用,经0.1%浓度处理48 h的种子,其发芽率和发芽指数分别为对照组的54.3%和43.3%,分别是41%和0.55;不同剂量60Co-γ射线对无芒隐子草种子的发芽率、发芽指数及幼苗生长产生不同的影响。低剂量(50~200 Gy)提高种子发芽率和发芽指数,高剂量(400~2 000 Gy)抑制种子发芽率、发芽指数及幼苗生长。其中,600 Gy辐射处理的发芽率为48.5%。因此,0.1%浓度处理48 h和600 Gy可分别作为秋水仙素和60Co-γ射线处理的半致死剂量。本研究初步确定的半致死剂量,可为进一步研究无芒隐子草种质资源创新提供理论依据。
关键词:无芒隐子草;秋水仙素;60Co-γ射线;发芽
植物诱变技术可通过利用外界因素在短时间内获得有价值的突变体,是育成新品种和创造新种质资源的重要方法。20世纪以来,人们在植物创造突变体领域已取得了丰硕的成果,其研究方法主要包括叠氮化物、烷化剂和抗生素类等化学诱变和紫外线、X射线、γ射线、离子束和激光处理等物理诱变[1],其主要对象为大豆(Glycinemax)、高粱(Sorghumbicolor)、小麦(Triticumaestivum)、水稻(Oryzasativa)和玉米(Zeamay)等农作物[2-5]。我国牧草育种研究工作起步尚晚,种质资源匮乏,迫切需要育成创新种质资源。目前关于牧草诱变及应用的研究尚少。王文恩等[6]以60Co-γ射线对狗牙根(Cynodondactylon)种子进行了诱变效应的研究,得出辐射剂量大于350 Gy时, 抑制干种子发芽且随着剂量增大而加强。鲍智娟和邢秀芹[7]用不同浓度的秋水仙素对甘草(Glycyrrhiazuralensis)萌动种子经不同时间处理后,结果表明,0.2%浓度秋水仙素处理24 h效果最好。房永雨等[8]利用不同浓度秋水仙素和不同处理时间对高丹草(Sorghumsudanense)杂交F1种子的诱变效果进行了分析,发现适宜的秋水仙素浓度和时间处理组合分别为0.1%、24 h和0.05%、36 h。
无芒隐子草(Cleistogenessongorica)为多年生禾本科植物,是我国西北荒漠草原的重要优良牧草资源[9-11],主要分布于中国内蒙古、陕西、宁夏、甘肃、青海及新疆等地,具有抗旱、耐寒等特点,对促进西北地区畜牧业发展和维持脆弱生态系统具有重要作用[12]。前人对无芒隐子草的萌发[13]、抗旱功能基因[14]以及氮肥对其产量的影响[15]等做了研究,而秋水仙素和60Co-γ射线对其种子的萌发及幼苗生长尚未见报道。本研究以内蒙古阿拉善荒漠草原的无芒隐子草种子为材料,研究秋水仙素和60Co-γ射线对其种子发芽及幼苗生长的影响,旨在为无芒隐子草种质资源创新提供有价值的参考。
1材料与方法
1.1材料
无芒隐子草种子于2010年9月采自内蒙古阿拉善荒漠草原,将种子贮藏在4℃恒温种质库中待用。
1.2方法
1.2.1不同剂量秋水仙素对种子的处理参考张焕玲等[16]用秋水仙素对杜仲(Eucommiaulmoides)种子诱变的研究,在室温下,用质量分数0.05%、0.1%、0.2%和0.3%的无菌秋水仙素分别浸泡种子24和48 h,然后用消毒的纱布将种子包起来清水冲洗1~2 h,每个处理100粒种子,4次重复,以未经处理的种子作为对照。
1.2.2不同辐射剂量60Co-γ射线对种子的处理将无芒隐子草干种子装入硫酸纸小袋,参考云锦凤[17]对不同牧草辐照剂量的研究结果,于2013年9月4日利用60Co-γ射线在兰州辐射技术开发中心辐射研究所进行辐射,辐射剂量分别为50、100、200、400、600、800、1 000和1 200 Gy,每个处理100粒种子,4次重复,以未经处理的种子作为对照。
1.2.3发芽试验将未经处理的和不同诱变处理后的种子铺于滤纸上晾干,所有种子用0.1%氯化汞消毒10 min,无菌水冲洗至少3次,后置于铺有两层滤纸(去离子水湿润)的培养皿(直径为10 cm)中,25 ℃下培养(16 h光照和8 h黑暗),每皿100粒种子,4次重复,以后每天统计发芽数,当胚根长度大于1 mm统计为发芽,持续14 d,第12~14天无种子发芽,则试验结束。第7天每培养皿均随机取10株各处理幼苗,测定胚根和胚芽长并计算其发芽指数。发芽指数(GI)[18]的计算公式为:GI= ∑(Gt/Dt)。Gt代表发芽第1,2,3,...,t,7天的种子发芽率,Dt为相应的种子发芽天数。
1.3数据处理
试验数据均采用Excel 2007进行统计及制图,并应用SPSS 16.0软件以LSD多重比较及Duncan’s检验进行差异性检验。
2结果与分析
2.1不同剂量秋水仙素对无芒隐子草种子萌发的影响
不同浓度秋水仙素处理24和48 h的种子发芽率均低于对照,且24 h处理的种子发芽率高于48 h处理的,表明不同浓度的秋水仙素对无芒隐子草种子发芽有一定的抑制作用(图1)。在所有处理中,0.3%秋水仙素浸种处理48 h的种子最终发芽率最低,为31%;0.3%秋水仙素浸种处理24 h的种子最终发芽率最高,为66.5%;0.1%秋水仙素处理48 h的种子最终发芽率是41%,为对照组发芽率的54.3%。
经不同浓度秋水仙素处理的无芒隐子草种子培养7 d后,各处理下的无芒隐子草发芽指数均显著低于对照组(P<0.05)(图2)。供试秋水仙素处理中,0.3%浸种处理24 h的种子的发芽指数显著高于其它处理的;0.3%浓度处理48 h的种子发芽指数在所有处理中最低,为0.42;0.1%秋水仙素处理48 h的种子发芽指数为0.55,是对照组发芽指数的43.3%。
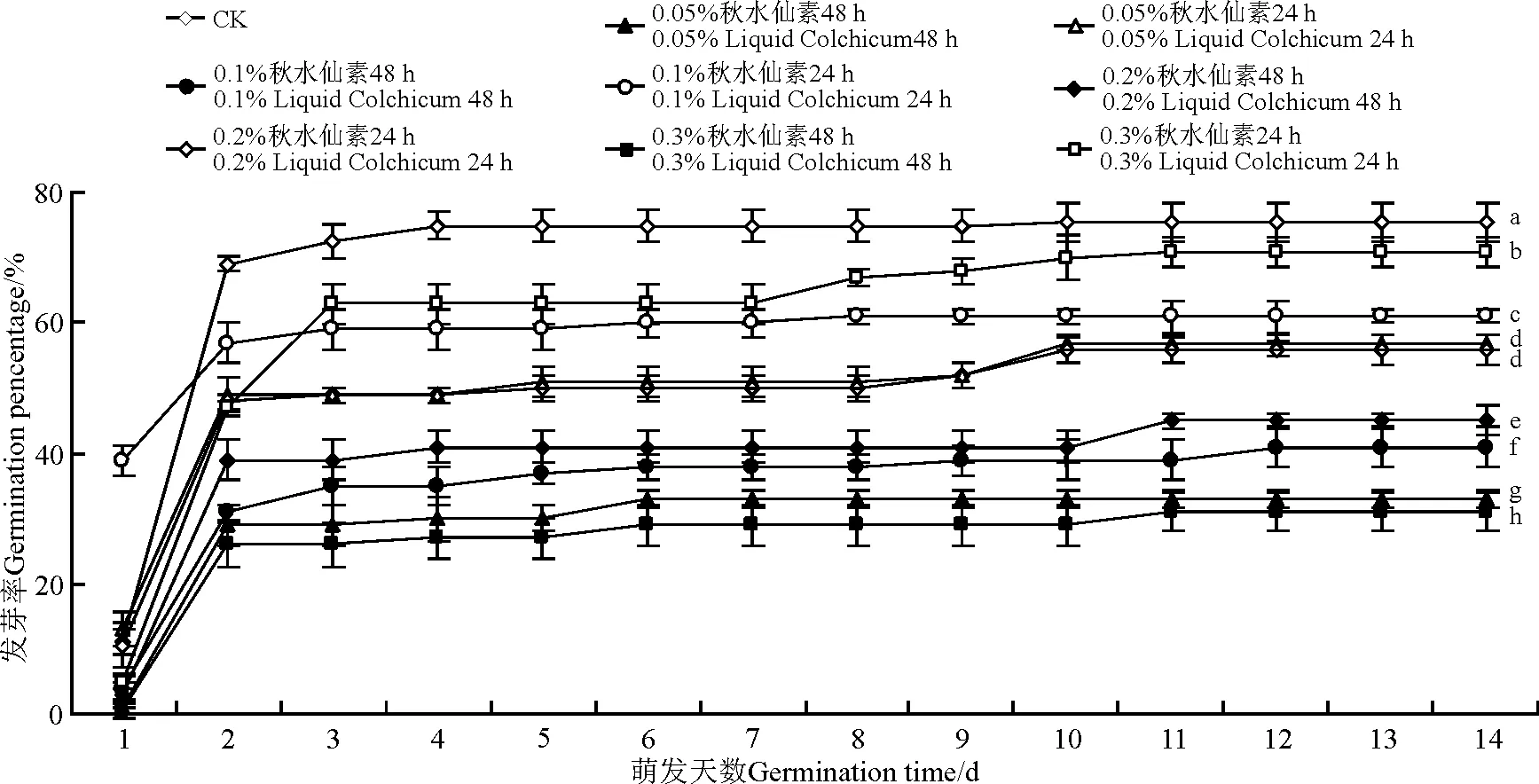
图1 秋水仙素处理对无芒隐子草种子发芽的影响
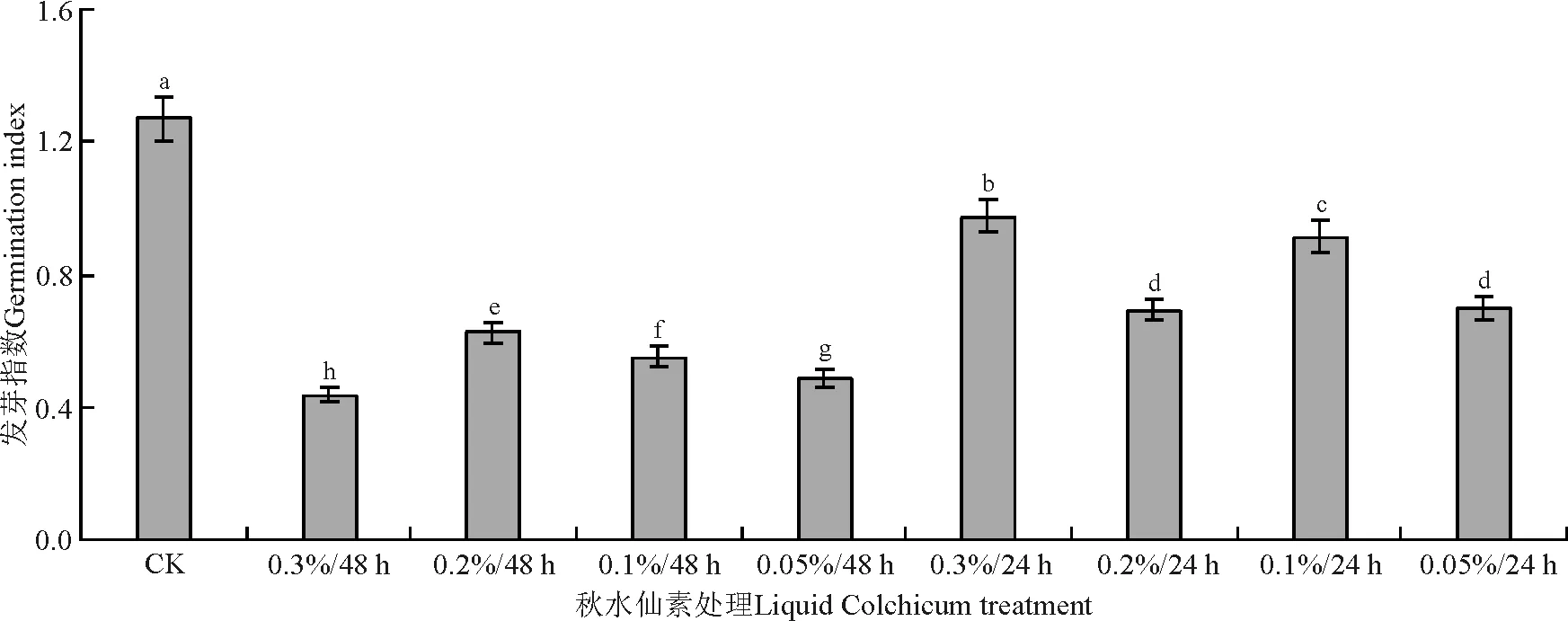
图2 秋水仙素处理对无芒隐子草发芽指数的影响
注:不同小写字母表示不同处理间差异显著(P<0.05)。下同。
Note: Different lower case letters indicate significant difference among different treatments at 0.05 level. The same below.
2.2不同剂量秋水仙素对无芒隐子草幼苗生长的影响
不同浓度秋水仙素处理的种子培养7 d后,无芒隐子草幼苗长显著小于对照的(P<0.05)(图3),表明秋水仙素对无芒隐子草的幼苗生长具有明显的抑制作用。不同处理间的幼苗胚芽长差异显著。当处理时间一定时,随秋水仙素浓度的升高,无芒隐子草种子胚根、胚芽长呈下降趋势,表明秋水仙素对无芒隐子草幼苗生长的抑制作用随药剂浓度升高而增强。当处理浓度相同时,24 h处理的种子胚根、胚芽长均大于48 h处理的,表明秋水仙素对无芒隐子草幼苗生长的抑制作用随药剂处理时间延长而增强。
2.3不同剂量60Co-γ射线处理对无芒隐子草种子发芽的影响
不同剂量的60Co-γ射线辐射无芒隐子草种子后,其发芽率不同。50、100和200 Gy 3个辐射剂量的辐照处理均促进了无芒隐子草种子的发芽,发芽率分别为85.0%、84.5%和84.0%,但与对照无显著差异(P>0.05)(图4)。其它辐射剂量处理后的种子发芽率显著低于对照(P<0.05),其中1 000和1 200 Gy的高辐射剂量延缓了种子发芽。
不同剂量60Co-γ射线辐射处理的无芒隐子草种子培养7 d后,经50、100和200 Gy 3个辐射剂量处理的无芒隐子草种子发芽指数均显著高于对照(P<0.05)的(图5),表明低剂量60Co-γ射线处理明显促进无芒隐子草的早期发芽。供试其它辐射剂量处理的无芒隐子草种子发芽指数均显著低于对照(P<0.05),其中,1 000和1 200 Gy 两个辐射剂量的发芽指数低,且两者间无显著差异,表明高剂量的60Co-γ射线辐射对无芒隐子草种子前期发芽具有明显的抑制作用。

图3 秋水仙素对无芒隐子草幼苗胚根与胚芽长的影响
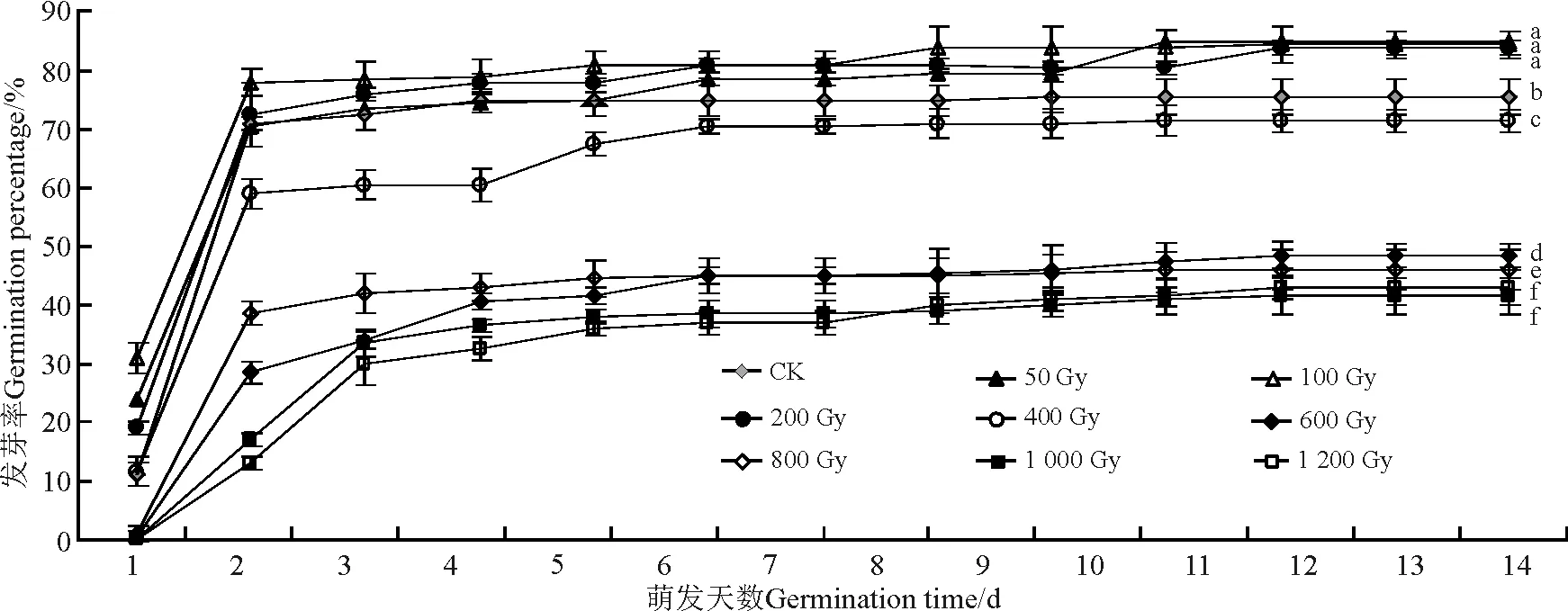
图4 60Co-γ射线处理对无芒隐子草种子发芽的影响
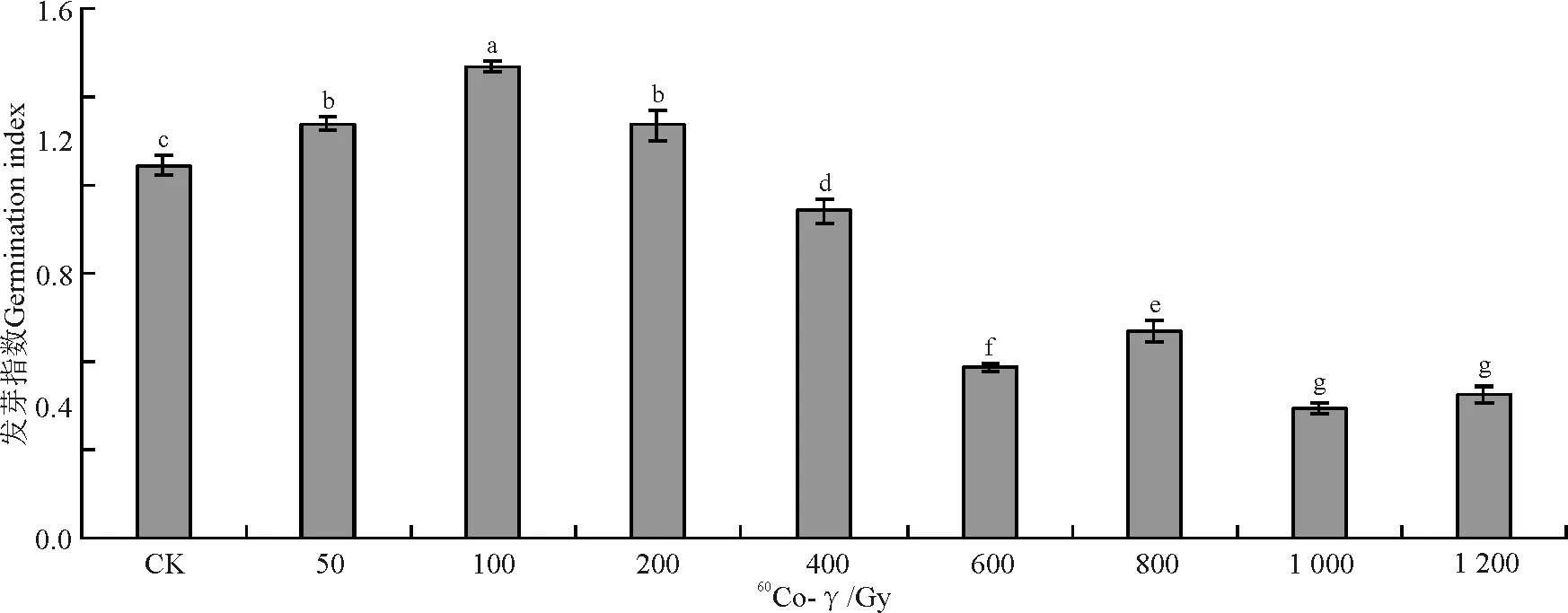
图5 60Co-γ射线处理对无芒隐子草发芽指数的影响
2.4不同剂量60Co-γ射线处理对无芒隐子草幼苗生长的影响
无芒隐子草种子经不同剂量60Co-γ射线处理后,50和200 Gy辐射剂量下,萌发7 d后的幼苗胚芽长均显著高于对照(P<0.05);1 200 Gy辐射剂量下无芒隐子草幼苗的胚根(0.5 cm)和胚芽长(0.55 cm)最小,显著低于对照的胚根(1.69 cm)和胚芽长(1.06 cm),表明高剂量辐射显著抑制了幼苗生长。
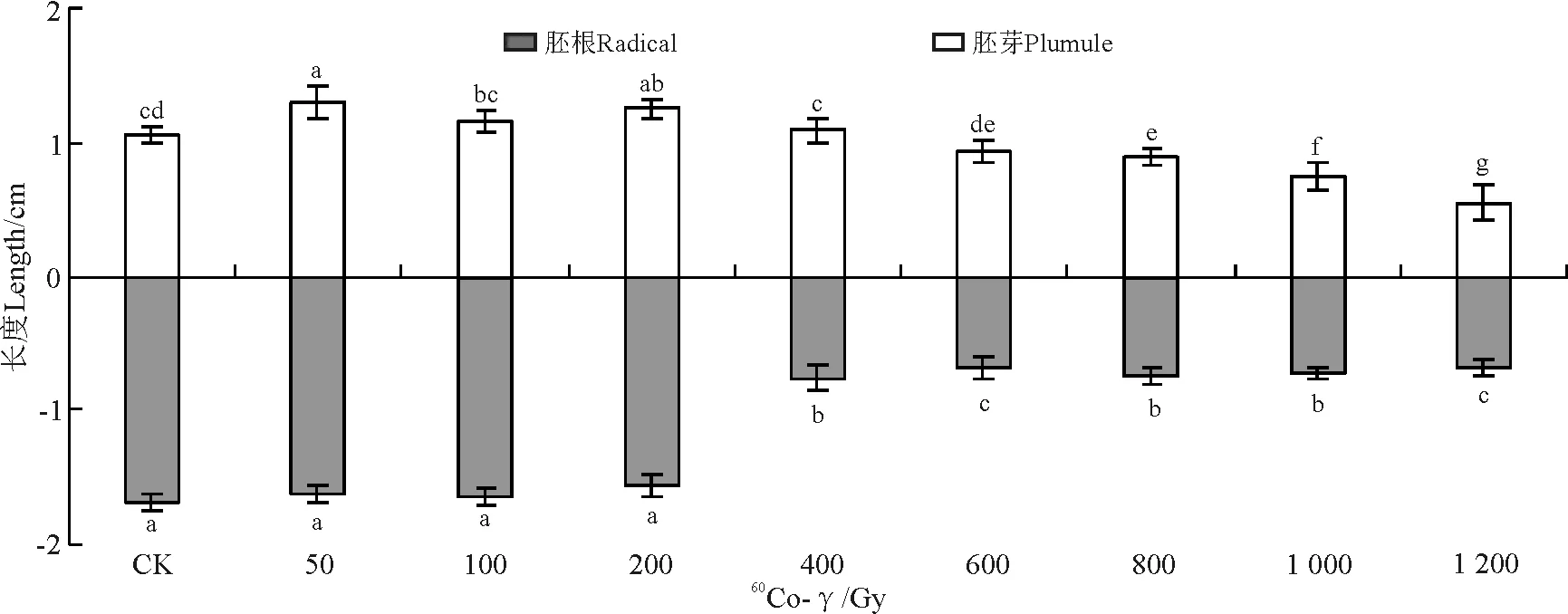
图6 60Co-γ射线处理对无芒隐子草胚根和胚芽长的影响
3讨论与结论
化学诱变剂秋水仙素阻止染色体分离,加倍体细胞的染色体数量,可经进一步诱导形成多倍体植株,但对染色体的结构无显著影响,且很少发生不良变异,因此在诱变育种中被广泛利用[19]。由于秋水仙素对植物材料有毒害作用,若处理不当,常常使材料在处理过程中死亡,影响成苗率,但不同植物、品种或器官对秋水仙素的敏感程度不同,因此筛选适宜的诱变剂浓度和处理时间尤为重要。在加倍玉米单倍体效率的研究中,得出秋水仙素质量浓度为0.4~1.0 mg·L-1时单倍体玉米的加倍率是5.5%~16.5%[20]。利用秋水仙素对青岛百合(Liliumtsingtauense)进行浸种诱导多倍体,结果表明,以0.05%的秋水仙素处理24 h,诱导效果最佳[21]。利用不同浓度秋水仙素和处理时间处理日本矮紫薇(Lagerstroemiaindica)种子,结果表明,随着处理浓度的增加和处理时间的延长,其发芽率下降[22]。用秋水仙素处理地锦(Parthenocissustricuspidata)体胚,结果表明,0.05%秋水仙素处理48 h以上对地锦体胚萌发有显著抑制作用[23]。本研究表明,处理时间的延长发芽率降低,这与穆红梅等[22]的研究结论一致。其中,0.1%浓度秋水仙素处理48 h无芒隐子草种子的发芽率和发芽指数分别为41%和0.55,均为对照组的50%,并且对幼苗生长的抑制作用不明显,因此,0.1%秋水仙素处理48 h可初步确定为秋水仙素诱变的最适宜剂量。
前人研究表明,生姜(Rhizomazingiberis)[24]、石斛兰(Dendrobium)[25]、非洲菊(Gerberajamesonii)[26]等植物均随秋水仙素浓度的升高或处理时间的延长,受害程度加重,种子成活率等指标呈下降趋势。本研究发现,秋水仙素处理对无芒隐子草的发芽具有一定的抑制作用,且发芽率随处理时间延长而降低,但是发芽率随着处理浓度变化并无明显的规律。出现这种现象的原因可能是因为秋水仙素处理种子受多个因素影响,如药剂的浓度、处理的时间、诱变材料自身的性质、诱变材料的抗逆性等,其中种子的保护程度是一个非常重要的因素。在生产实践中,无芒隐子草的种子有稃片保护,所以药剂渗透时间应较长。
60Co-γ射线能量高、穿透力强、射程远,故一次可照射很多种子,而且剂量较均匀,是辐射诱变育种中最常用的诱变源。很多研究[27-29]表明,低剂量的辐射处理对种子发芽具促进作用,而高剂量的辐射抑制种子发芽且对种胚产生伤害,出现低剂量辐射促进植物生长、提高发芽率的原因可能是因为种子内生物自由基或有关酶的活性经辐射处理后产生了变化,进而加快了种子的代谢,对种子的发芽产生促进作用。王月华等[30]证实,低剂量的60Co-γ射线处理促进草地早熟禾(Poapratensis)种子的萌发。蔡春菊等[31]曾提到高剂量的60Co-γ射线处理对毛竹(Phyllostachysedulis)的种胚组织产生了伤害作用,抑制了细胞的分裂,延缓了毛竹种子的萌发。本研究中使用低剂量(50、100和200 Gy)的60Co-γ射线辐射, 在无芒隐子草中出现了种子发芽率不同程度地高于对照,且发芽率和发芽指数均高于其它处理,其中100 Gy对无芒隐子草的胚根长抑制作用最小。其它辐射剂量处理后的种子发芽率和发芽指数均低于对照,采用600 Gy60Co-γ射线辐射无芒隐子草种子,最终发芽率为48.5%。
诱变育种中,适宜诱变剂量是诱变成功的关键。除种子萌发和幼苗生长外,田间出苗情况、酶活性等生理代谢指标及细胞有丝分裂指数等细胞学效应的研究均也应作为选择适宜辐射剂量的依据。本研究仅对无芒隐子草种子的萌发进行了研究,初步确定了最佳剂量,能否定向变异和选育尚无法得出结论,有待进一步深入研究。
参考文献(References)
[1]徐明,路铁刚.植物诱变技术的研究进展.生物技术进展,2011,1(2):90-97.
Xu M,Lu T G.Research progress of plant mutagenesis technology.Current Biotechnology,2011,1(2):90-97.(in Chinese)
[2]Till B J,Reynolds S H,Weil C,Springer N,Burtner C,Young K,Bowers E,Codomo C A,Enns L C,Odden A R,Greene E -A,Comai L,Henikoff S.Discovery of induced point mutations in maize genes by TILLING.BMC Plant Biology,2004,4(1):12.
[3]Till B J,Cooper J,Tai T H,Colowit P.Discovery of chemically induced mutations in rice by TILLING.BMC Plant Biology,2007,7(1):19.
[4]Cooper Z,Till B J,Laport R G,Darlow M,Kleffner J.TILLING to detect induced mutations in soybean.BMC Plant Biology,2008,8(1):9.
[5]Xin Z,Wang M L,Barkley N A,Burow G.Applying genotyping (TILLING) and phenotyping analyses to elucidate gene function in a chemically induced sorghum mutant population.BMC Plant Biology,2008,8(1):103.
[6]王文恩,包满珠,张俊卫.60Co-γ射线对狗牙根干种子的辐射效应.草地学报,2007,15(2):187-189.
Wang W E,Bao M Z,Zhang J W.The effect of60Co-γ ray irradiation onCynodondactylondry seeds.Acta Agrestia Sinica,2007,15(2):187-189.(in Chinese)
[7]鲍智娟,邢秀芹.秋水仙素处理甘草种子诱导多倍体的研究.吉林农业科技学院学报,2009,18(4):90-93.
Bao Z J,Xing X Q.Study of conformation polyploidy onGlycyrrhizauralensisseed dealt with by colchicine.Journal of Jilin Agricultural Science and Technology College,2009,18(4):90-93.(in Chinese)
[8]房永雨,谢锐,于肖夏,于卓,马艳红.秋水仙素处理高丹草杂种F1种子诱变效果分析.中国草地学报,2013,18(6):40-45.
Fang Y Y,Xie R,Yu X X,Yu Z,Ma Y H.Analysis of mutagenic effect of colchicineson seeds of sorghum-sudangrass hybrid F1.Chinese Journal of Grassland,2013,18(6):40-45.(in Chinese)
[9]陈默君,贾慎修.中国饲用植物志.北京:中国农业出版社,2002:1362.
[10]周志宇.阿拉善荒漠草地类初级营养类型研究.兰州:甘肃科学技术出版社,1990:139-162.
[11]郇庚年.甘肃张掖主要野生草坪植物.草业科学,1989,6(5):60-64.
Xun G N.The major wild turf grass species in Zhangye Area,Gansu Province.Pratacultural Science,1989,6(5):60-64.(in Chinese)
[12]武艳培,王彦荣,胡小文,张宝林.围栏封育对无芒隐子草非结构性碳水化合物的影响.西北植物学报,2007,27(11):2298-2305.
Wu Y P,Wang Y R,Hu X W,Zhang B L.Effects of enclosing on non-structure carbohydrate ofCleistogenessongorica.Acta Botanica Boreale Occidentali Sinica,2007,27(11):2298-2305.(in Chinese)
[13]鱼小军,王彦荣,曾彦军,苏德.温度和水分对无芒隐子草和条车前种子萌发的影响.生态学报,2004,24(5):883-887.
Yu X J,Wang Y R,Zeng Y J,Su D.Effects of temperature and osmotic potential on seed germination ofCleistogenessongoricaandPlantagolessingii.Acta Ecologica Sinica,2004,24(5):883-887.(in Chinese)
[14]段珍,狄红艳,张吉宇,霍雅馨,孔令芳.无芒隐子草CsLEA基因超表达载体和反义表达载体构建.草业科学,2014,31(8):1475-1480.
Duan Z,Di H Y,Zhang J Y,Huo Y X,Kong L F.Construction of the over and antisense expression vector ofCsLEAgene.Pratacultural Science,2014,31(8):1475-1480.(in Chinese)
[15]贾存智,王彦荣,李欣勇.施氮对无芒隐子草种子产量的影响.草业科学,2014,31(9):1746-1751.
Jia C Z,Wang Y R,Li X Y.Effect of nitrogen application on seed yield ofCleistogenessongorica.Pratacultural Science,2014,31(9):1746-1751.(in Chinese)
[16]张焕玲,李俊红,李周岐.秋水仙素处理杜仲种子诱导多倍体的研究.西北林学院学报,2008,23(1):78-81.
Zhang H L,Li J H,Li Z Q.Studies on polyploid induction in vitro ofEucommiaulmoidesOliv.Journal of Northwest Forestry University,2008,23(1):78-81.(in Chinese)
[17]云锦凤.牧草及饲料作物育种学.北京:中国农业出版社,2001:87-90.
[18]毕辛华.种子检验.北京:农业出版社,1986:94-118.
[19]程金水.园林植物遗传育种学.北京:中国林业出版社,2006:376-398.
[20]王贺,李继竹,张继伟,慈佳宾,姜龙,张野,杨伟光.秋水仙素和除草剂浸芽加倍玉米单倍体效率的研究.吉林农业大学学报,2013,35(4):384-388.
Wang H,Li J Z,Zhang J W,Ci J B,Jiang L,Zhang Y,Yang W G.Study on doubling efficiency of maize haploids bud soaked by herbicide and colchicine.Journal of Jilin Agricultural University,2013,35(4):384-388.(in Chinese)
[21]张俊芳,刘庆华,王奎玲,刘庆超,孙阳.秋水仙素诱导青岛百合四倍体研究.核农学报,2009,23(3):454-457.
Zhang J F,Liu Q H,Wang K L,Liu Q C,Sun Y.Tetraploid induction ofLiliumtsingtauenseby colchicine.Journal of Nuclear Agricultural Sciences,2009,23(3):454-457.(in Chinese)
[22]穆红梅,杨传秀,陆长民,卢露,秦欣欣,郭建杰.秋水仙素处理日本矮紫薇种子变异的初步研究.北方园艺,2011,17(3):103-105.
Mu H M,Yang C X,Lu C M,Lu L,Qin X X,Guo J J.Effect of pinchingon flower yield and quality of carnation grown in greenhouse.Northern Horticulture,2011,17(3):103-105.(in Chinese)
[23]李正红,孙振元,彭镇华.秋水仙素诱导地锦多倍体研究.核农学报,2005,19(6):430-435.
Li Z H,Sun Z Y,Peng Z H.Study on colchiploid of:Parthenocissustricuspidatainduced by colchicines.Journal of Nuclear Agricultural Sciences,2005,19(6):430-435.(in Chinese)
[24]郭启高,张钟灵,周虹,梁国鲁,宋明.秋水仙碱诱导生姜多倍体的研究.西南农业大学学报,2000,22(5):400-402.
Guo Q G,Zhang Z L,Zhou H,Liang G L,Song M.In vitro induction of polyploidy from colchicines-treated zingiber officinale roscse.Journal of Southwest Agricultural University,2000,22(5):400-402.(in Chinese)
[25]Sarathum S,Hegele M,Tantiviwat S,Nanakorn M.Effect of concentration and duration of colchicine treatment on polyploidy induction inDendrobiumscabrilingueL.Europe Journal of Horticultural Sciences,2010,75(3):123-127.
[26]Saikat G,Nirmal M,Somnath B,Prakash K D.Induction and identification of tetraploids using in vitro colchicine treatment ofGerberajamesoniiBoluscv.Sciella.Plant Cell Tissue and Organ Culture,2011,106:485-493.
[27]王文恩,包满珠,张俊卫.60Co-γ辐射对日本结缕草干种子的辐射效应研究.草业科学,2009,26(5):155-160.
Wang W E,Bao M Z,Zhang J W.The effect of60Co-γ irradiation on dry seeds ofZoysiajaponica.Pratacultural Science,2009,26(5):155-160.(in Chinese)
[28]吴茂力,刘勇强,张子龙.60Co-γ辐射对水稻陈种子活力复苏的影响.西南农业学报,2010,23(4):1013-1016.
Wu M L,Liu Y Q,Zhang Z L.Effect of ray irradiation by light intensity of60Co-γ ray on old rice seed vigour.Southwest China Journal of Agricultural Science,2010,23(4):1013-1016.(in Chinese)
[29]霍雅馨,王娜,张吉宇,张岩,孔令芳.3种诱变因子对箭筈豌豆种子萌发的影响.草业科学,2013,31(3):438-445.
Huo Y X,Wang N,Zhang J Y,Zhang Y,Kong L F.Effects of three mutagens on seed germination ofViciasativa.Pratacultural Science,2013,31(3):438-445.(in Chinese)
[30]王月华,韩烈保,尹淑霞,刘贵浩,程晓霞.射线辐射对早熟禾种子发芽及种子内酶活性的影响.中国草地学报,2006,28(1):54-57.
Wang Y H,Han L B,Yi S X,Liu G H,Cheng X X.The effect of60Co-γ ray irradiation on seeds germination and the activity of enzymes of seeds ofKentuckybluegrass.Chinese Journal of Grassland,2006,28(1):54-57.(in Chinese)
[31]蔡春菊,高健,牟少华.60Co-γ辐射对毛竹种子活力及早期幼苗生长的影响.核农学报,2007,21(5):436-440.
Cai C J,Gao J,Mou S H.Effects of60Co-γ ray irradiation on seed vigor and young seedling growth ofPhyllostachysedulis.Journal of Nuclear Agricultural Sciences,2007,21(5):436-440.(in Chinese)
(责任编辑张瑾)
DOI:10.11829/j.issn.1001-0629.2015-0234
*收稿日期:2015-04-23接受日期:2015-07-08
基金项目:科技部“973”课题(2014CB138704);国家自然科学基金(31572453)
通信作者:张吉宇(1977-),男,甘肃民乐人,副教授,博士,研究方向为草类作物育种与生物技术。E-mail:zhangjy@lzu.edu.cn
中图分类号:S816;S335.3;Q945.34
文献标识码:A
文章编号:1001-0629(2016)3-0424-07* 1
Corresponding author:Zhang Ji-yuE-mail:zhangjy@lzu.edu.cn
Effect of colchicines and60Co-γ-rays on germination ofCleistogenessongoricaseeds
Zhang Dai-yu, Wu Fan, Zhang Ji-yu, Wang Yan-rong, Zhang Yan, Luo Dong
(State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China)
Abstract:This experiment systematically analyzed germination percentage, germination index and seedlings growth of Cleistogenes songorica with different doses of colchicine's and60Co-γ-rays treatments. The results showed that colchicine had certain degree of inhibition on seed germination of C. songorica. With the treatment of 0.1% colchicine solution for 48 h, the germination percentage and germination index were 54.3% and 43.3% of the control which were 41% and 0.55, respectively. However, the effects of60Co-γ-rays on germination percentage, germination index and the growth of seedlings varied with does. Low doses(50~200 Gy)increased germination percentage and germination index whereas high doses(400~2 000 Gy)inhibited the germination percentage, germination index and seedling growth. The germination percentage was 48.5% under the treatment of 600 Gy. The present study preliminary determined the semi-lethal dose treatment was 0.1% colchicine solution for 48 h and 600 Gy60Co-γ-rays, respectively, which provided a theoretical basis for the innovation of germplasm resources in C. songorica.
Key words:Cleistogenes songorica; colchicine;60Co-γ-rays; germination
张代玉,吴凡,张吉宇,王彦荣,张岩,罗栋.秋水仙素和60Co-γ射线对无芒隐子草种子萌发的影响.草业科学,2016,33(3):424-430.
Zhang D Y,Wu F,Zhang J Y,Wang Y R,Zhang Y,Luo D.Effect of colchicines and60Co-γ-rays on germination ofCleistogenessongoricaseeds.Pratacultural Science,2016,33(3):424-430.
植物生产层
第一作者:张代玉(1989-)女,甘肃靖远人,在读硕士生,研究方向为作物栽培与耕作学。E-mail:zhangdaiyu024@163.com
