芡欧鼠尾草的组织培养和快速繁殖
2016-08-02李伟丽黄丽芳夏新界
李伟丽,黄丽芳,夏新界
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南 长沙 410125;2.中国科学院大学, 北京 100049)
芡欧鼠尾草的组织培养和快速繁殖
李伟丽1,2,黄丽芳1,夏新界1
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南 长沙 410125;2.中国科学院大学, 北京 100049)
摘要:以芡欧鼠尾草(Salvia hispanica)成熟种子为外植体,1/2MS为基本培养基,研究不同浓度的外源激素对愈伤组织的诱导、增殖和生根的影响,从而初步建立了芡欧鼠尾草组织培养的快速繁殖体系。结果表明,诱导种子愈伤组织的最适宜培养基为1/2MS+10.0 mg·L-16-BA+1.0 mg·L-1NAA+0.4 mg·L-1ZT,诱导率为66.5%;不定芽增殖的最适培养基为1/2MS+3.0 mg·L-16-BA+0.5 mg·L-1NAA,增殖倍数为7.69;生根的最适培养基为1/2MS+0.5 mg·L-1NAA,生根率达100%,平均生根数为5.68;移栽后植株生长良好,成活率较高,达97%。
关键词:芡欧鼠尾草;成熟种子;组织培养;快速繁殖
芡欧鼠尾草(Salviahispanica)为唇形科鼠尾草属一年生草本植物,英文名为Chia(奇亚),原产于墨西哥南部和危地马拉北部。喜阳,但也能忍耐半阴,耐旱,耐贫瘠,不耐涝,适于生长在热带和亚热带地区[1-2]。芡欧鼠尾草的种子又称奇亚籽,具有悠久的食用和药用历史[3]。除直接食用外,也被用于饼干、面包、酸奶等食品的生产[4-5]。同时,奇亚籽也可作为营养强化剂及食品添加剂。我国已于2014年批准奇亚籽为新食品原料。研究表明,奇亚籽中富含多种蛋白质、矿质元素、维生素、ω-3系列多不饱和脂肪酸和抗氧化剂等成分,具有维持正常血脂水平、抗肿瘤、抗氧化、改善糖尿病和心血管疾病等作用,广泛应用于医药、食品、化妆品等方面[6-10]。
随着消费者保健意识的增强和对健康营养食品要求的不断提高,芡欧鼠尾草已成为国内外食品研究领域的热点,在食品和医药工业中有着巨大的开发利用前景[11]。近年来随着人们对芡欧鼠尾草的需求逐渐扩大和开发日渐迅速,原料需求逐步增加。由于工业需求的不断增加,大量野生资源被消耗,芡欧鼠尾草种质资源面临枯竭。因此,人工种植和栽培芡欧鼠尾草受到重视,利用组织培养可以在短期内生产大量的优质种苗,可为芡欧鼠尾草的生理生化、遗传转化工作提供理论参考。目前,关于药用鼠尾草属植物组织培养有一些报道,如王宗霞和康慧[12]通过顶芽培养获得了蓝花鼠尾草(S.farinacea)的再生植株;王萌等[13]通过叶片获得了甘西鼠尾草(S.przewalskii)的再生植株;有关芡欧鼠尾草组织培养的研究在国外也有一定报道,如Mirian等[14]通过幼嫩叶片、子叶和带芽茎段3种外植体,首次进行芡欧鼠尾草的微体快繁研究;Marconi等[15]以茎段为材料建立了芡欧鼠尾草的组织培养体系。然而国内则尚未见相关报道。基于此,本研究以芡欧鼠尾草的种子为外植体,探讨芡欧鼠尾草再生组织培养的最佳条件,以期为人工规模化生产芡欧鼠尾草提供重要的技术参考,同时对保护芡欧鼠尾草野生种质资源具有重要的现实意义。
1材料与方法
1.1试验材料
试验材料来源于中国科学院作物耐逆境分子生物学课题组试验基地,选用成熟的芡欧鼠尾草种子为外植体。
1.2试验方法
1.2.1无菌材料的获得选取芡欧鼠尾草无病、无虫害的成熟种子。将种子置于消毒瓶中,用70%乙醇溶液消毒30 s,再用无菌水冲洗3~4次后放入0.1%升汞(HgCl2)溶液中浸泡10 min,期间不断摇晃,取出后用无菌水清洗5~6次,无菌滤纸吸干种子表面水分。
1.2.2种子愈伤组织的诱导和分化将外植体接种到1/2MS基本培养基中,利用L9(34)正交试验设计,研究不同浓度的NAA(0、0.5和1.0 mg·L-1)、6-BA(3.0、5.0和10.0 mg·L-1)和ZT(0、0.4和0.8 mg·L-1)组合对愈伤组织诱导的影响。因芡欧鼠尾草种子较小(图1),用1 000 μL移液枪吸取种子。将种子接种于诱导培养基上,每个处理接种5瓶,每瓶接种10个,重复4次。接种20 d后统计种子愈伤组织的诱导率和分化率。
1.2.3不定芽的增殖将诱导出的丛生芽分成单株,基部保留部分愈伤块,切割后接种到增殖培养基上增殖培养,以1/2MS为基本培养基,附加不同浓度的6-BA和NAA。每个处理接种5瓶,每瓶接种5个,重复4次。30 d后,观察统计不定芽的增殖倍数和生长状况。
1.2.4继代生根待不定芽生长至约4 cm时自基部剪下,接种至适宜的增殖培养基中继代培养,每30 d左右继代一次。生根培养时,将组培苗接种至添加不同浓度NAA的1/2MS培养基中培养。每个处理接种5瓶,每瓶接种5个,重复4次。培养16 d后,观察统计不定芽的生根率、平均生根系数及生长状况。
1.2.5炼苗移栽取生长健壮、叶色浓绿、根系发达、长8~10 cm的组培苗,打开瓶盖,室温条件下炼苗2 d后取出,清洗根部残留的培养基,稍微蘸取IBA (0.1 mg·L-1) 溶液,再将其移栽至小盆中,移栽基质为泥炭土和珍珠岩(1∶1)的混合基质(培养基质预先用1/1 000的高锰酸钾溶液浸泡2 h,沥干备用),遮阴培养,散射光照。每周喷施1/2的营养液一次,定期观察幼苗生长情况,20 d后,统计移栽苗的成活率。然后,将部分组培苗置于温室中继续培养,另一部分组培苗移栽于大田中,完全暴露于自然的环境下。
1.3培养条件
培养基均以1/2MS为基本培养基,培养基含蔗糖30 g·L-1、琼脂8 g·L-1,培养基在高压灭菌前将pH值调至5.8。培养温度为(25±2) ℃,空气相对湿度为70%,光照强度为2 000 lx,光照时间为12 h·d-1。
1.4评价指标
诱导率=(诱导出愈伤组织外植体数/接种的外植体总数)×100%;
分化率=(有芽形成的愈伤组织块数/愈伤组织的总数)×100%;
增殖倍数=增殖后的幼苗数/接种的幼苗数;
生根率=(生根的幼苗数/接种的幼苗数)×100%;
平均生根数=根的总数/生根的苗数。
数据采用SPSS 19.0软件对所测数据进行统计分析,用平均值和标准误差表示测定结果,并用Duncan法对各测定结果进行多重比较。
2结果与分析
2.1不同激素浓度的培养基对种子诱导的影响
将无菌的种子接种到诱导培养基上培养,各处理均能诱导出愈伤组织。培养20 d左右开始形成愈伤组织,且部分愈伤组织的边缘同步分化出绿色的小芽(图1),随后不断增加。以愈伤组织的诱导率和分化率为指标,记录数据并对诱导率进行极差分析(表1)。结果表明,不同浓度的6-BA、NAA和ZT组合对愈伤组织的诱导和分化有明显影响,单独使用6-BA对愈伤组织诱导率极低,处理A6、A8的诱导率(42.5%、40.5%)显著高于处理A2、A3(15.5%、12.5%)(P<0.05)。可知NAA较ZT对芡欧鼠尾草种子愈伤组织诱导更有效,更有利于愈伤的诱导。同时,根据R值判断可知,6-BA、NAA、ZT对愈伤组织的诱导作用为NAA>6-BA>ZT。经多重比较分析可知,处理A9培养基配方对愈伤组织诱导的效果更明显,显著高于其它处理(P<0.05)。A9条件下丛生芽诱导率高达66.5%,且不定芽叶片嫩绿,茎较粗。因此,处理A9,即1/2MS+10.0 mg·L-16-BA+1.0 mg·L-1NAA+0.4 mg·L-1ZT是芡欧鼠尾草种子诱导的最适宜培养基。
2.2不同浓度的6-BA、NAA组合对不定芽增殖的影响
将初代培养的0.5 cm以上的不定芽接种于增殖培养基中培养。随后,不定芽体积不断增多,迅速伸长(图1)。方差分析与多重比较结果表明,不同浓度NAA和6-BA组合对芡欧鼠尾草不定芽增殖有明显影响。培养基中仅含NAA时,不定芽增殖倍数随NAA浓度增加先升高后下降,其最大值为6.78(表2);当NAA浓度为0.5 mg·L-1时,不定芽增殖倍数随6-BA浓度增加而下降,最大值为7.69。因此,最适宜不定芽增殖的NAA浓度为0.5 mg·L-1。NAA浓度为0.5 mg·L-1时不定芽增殖倍数均较高,其中处理B5的不定芽增殖倍数显著高于其它处理(P<0.05),不定芽增殖倍数最高。且处理B5诱导出的不定芽苗叶色浓绿,茎较粗壮,植株较高。因此,处理B5,即1/2MS+0.5 mg·L-1NAA+3.0 mg·L-16-BA是芡欧鼠尾草不定芽增殖的最适宜培养基。
2.3不同培养基对生根与移栽的影响
将经增殖培养长至4 cm左右高的组培苗,转入生根培养基中培养。培养5 d后,基部分化出根点,9 d后长出白色根,16d后统计结果。结果表明,各处理条件下的幼苗易生根,且生长状况好。不定芽在不添加任何激素的1/2MS培养基中,同样可以诱导出根,生根率高达90%(表3),但诱导生根时间较长,且根较细弱;添加低浓度的NAA(0.1~0.5 mg·L-1)可促进芡欧鼠尾草根的形成,生根率达98%以上,不同浓度之间无显著差异。NAA浓度为0.5 mg·L-1时,培养9 d左右可形成完整根系,根长而多(图1),平均根数最高达5.68,显著高于其它处理(P<0.05)。综上所述,本试验中芡欧鼠尾草适宜生根培养基为1/2MS+0.5 mg·L-1NAA。芡欧鼠尾草试管苗移栽成活率较高,在温室炼苗、移栽后20 d,新叶长出,生长旺盛,移栽成活率达97%。生长于温室和大田中的植株长势均较好,叶色浓绿(图1)。
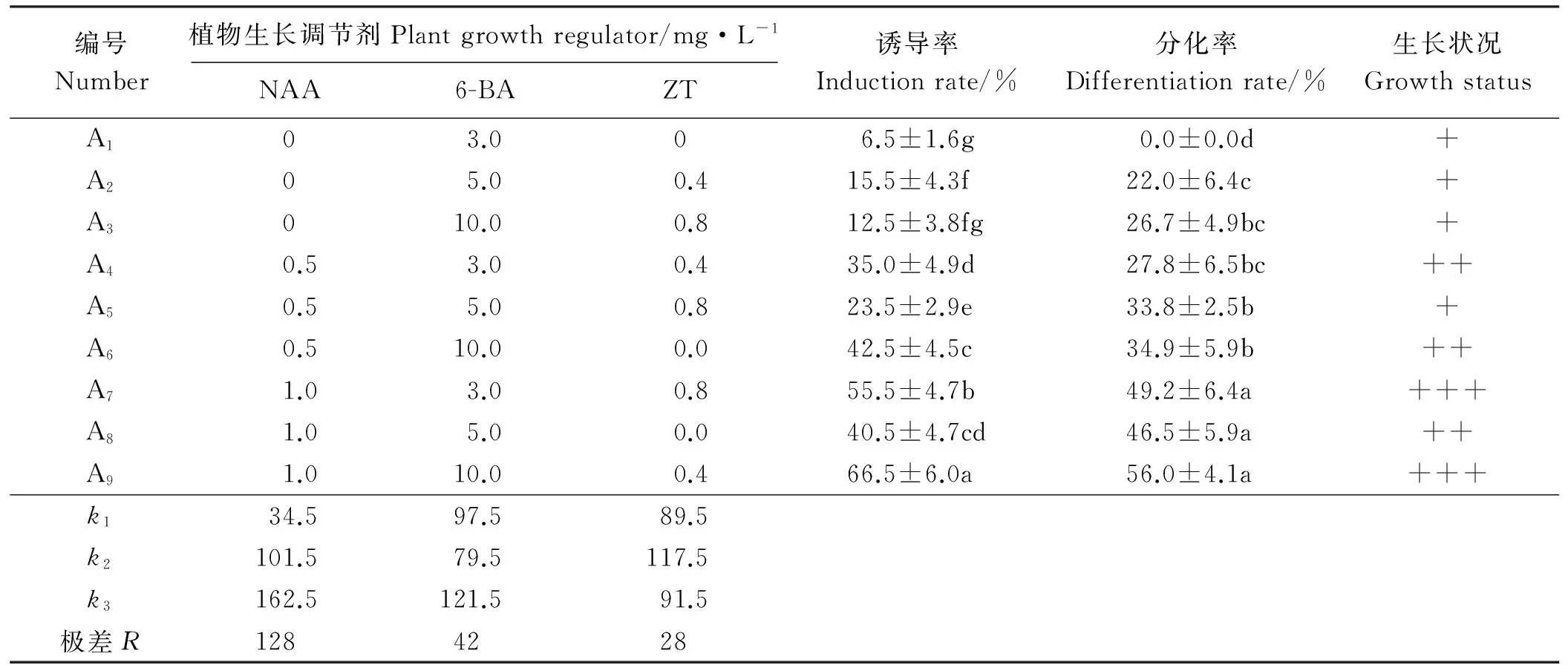
表1 不同浓度NAA, 6-BA和 ZT组合对愈伤组织诱导的影响
注:表中数据为平均值±SD。同列不同小写字母表示差异显著(P<0.05)。“+”表示生长的强弱,越多表示长势越好。表2、表3同。
Note: Values are represented as mean ± SD. Different lower case letters within the same column show significant difference at 0.05 level. “+” in the table means the growing status, more “+” indicates stronger vigorous growth. The same in Table 2 and Table 3.

图1 芡欧鼠尾草种子的离体培养和植株再生
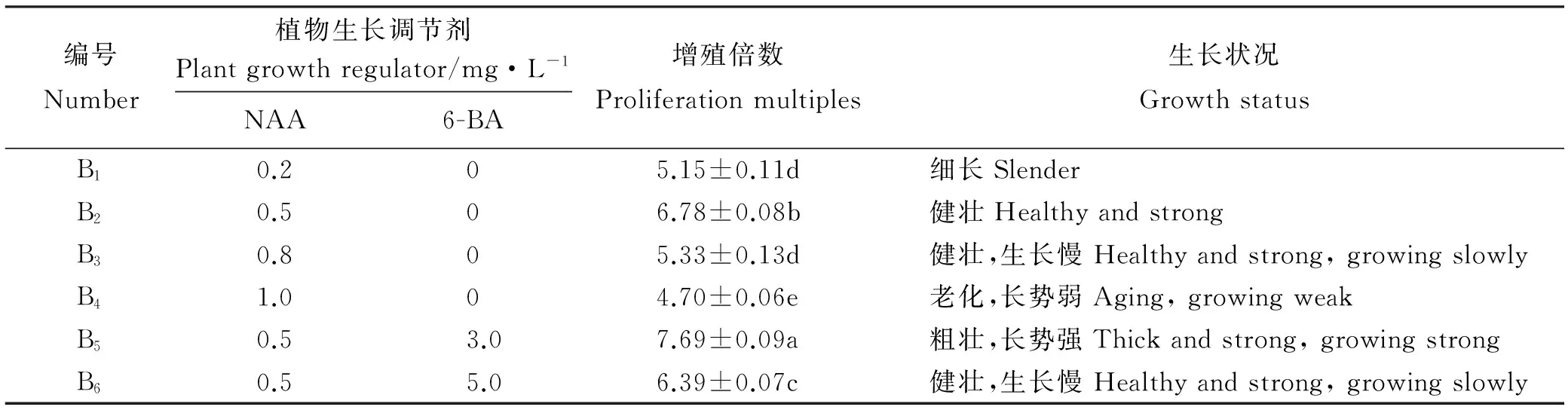
编号Number植物生长调节剂Plantgrowthregulator/mg·L-1NAA6-BA增殖倍数Proliferationmultiples生长状况GrowthstatusB10.205.15±0.11d 细长SlenderB20.506.78±0.08b 健壮HealthyandstrongB30.805.33±0.13d 健壮,生长慢Healthyandstrong,growingslowlyB41.004.70±0.06e 老化,长势弱Aging,growingweakB50.53.07.69±0.09a 粗壮,长势强Thickandstrong,growingstrongB60.55.06.39±0.07c 健壮,生长慢Healthyandstrong,growingslowly
3讨论与结论
在植物组织培养中,植物细胞受到包括生理、形态、生化等多因素的影响,其中外植体和植物激素是关键的制约因素。唇形科鼠尾草属植物丛生芽诱导常用的外植体多为叶片、茎段、茎尖、顶芽[16-19],较少有关种子作为外植体的报道[20-22]。成熟种子同其它类型外植体相比,取材容易,受消毒的影响小,且不受季节和植株发育时期等因素的限制,具备取材方便、操作简单等特点。因此,成熟种子作为外植体进行组织培养建立一个高频的植株再生体系成为大多数研究者的首选[23]。所以,本研究选择的外植体为芡欧鼠尾草成熟的种子。

表3 不同培养基对移栽苗生根的影响
此外,在植物组织培养中,植物生长调节剂用量虽然微小,但不可缺少[24]。植物激素起着传递遗传物质的脱分化、再分化等发育信号的作用[25]。植物激素中细胞分裂素的主要作用是促进细胞分裂,诱导愈伤组织[26]。在鼠尾草植物愈伤组织诱导中,6-BA是重要的激素之一,对愈伤组织的诱导起决定性作用。本研究发现,外植体在仅含6-BA的培养基上也能诱导出愈伤组织,这与鼠尾草属其它植物研究结果不同[21]。分析原因可能是基本培养基种类,鼠尾草种类、材料部位和激素浓度的不同造成的,这一问题仍有待进一步研究。值得一提的是,愈伤组织诱导中细胞分裂素和生长素的比例尤为重要[27]。根据前人研究可知,6-BA(0.4~3.0 mg·L-1)与NAA(0.06~1.0 mg·L-1)的比值通常在6~10,本研究所加6-BA和NAA配比符合这一范围。
有研究表明,在继代培养过程中,需附加外源生长素来维持愈伤组织的增殖和生长,生长素进入愈伤组织的细胞后,诱发一系列生理效应,进而维持细胞在继代培养过程中正常的生理活动[28]。适当增加NAA的浓度有利于提高不定芽的增殖率。本研究在增殖培养中提高了NAA的含量比例。NAA浓度为0.5 mg·L-1时,不定芽增殖率随6-BA浓度增加而下降,且最高增殖率时6-BA浓度为3.0 mg·L-1,这一结果与沙红和瘳康[17]指出的当6-BA浓度高于0.8 mg·L-1时,鼠尾草增殖倍数开始减少的观点有一定差异。
根据沙红和廖康[17]的研究得知,1/2MS培养基的生根效果优于MS培养基,生根率最高为70%。本研究发现,在完全不含植物生长调节剂的1/2MS培养基,生根率达到90%,更有利于根的生成,且再生植株长势也较好。因此,1/2MS培养基较适合于芡欧鼠尾草组培苗的生根培养。这一结果也与房师梅等[18]对丹参(S.miltiorrhiza)组培快繁技术的研究结果一致,而与王宗霞和康慧[12]对蓝花鼠尾草(S.farinacea)生根的研究结果相反。
本研究用种子作外植体,试验材料取材容易,数量大。将种子接种在诱导培养基上,直接长出愈伤的同时,又能分化出芽,而且同步诱导愈伤和芽的频率高,转入生根培养基中9 d左右形成完整植株;不仅简化了操作过程,而且大大缩短了培养时间,节省了生产成本,可批量生产,应用价值高。再生体系的建立不仅使芡欧鼠尾草的大规模快繁生产成为可能,还为今后芡欧鼠尾草优质种质资源再生体系的构建以及生理生化研究等方面提供了技术保障。
参考文献(References)
[1]中国科学院中国植物志编集委员会.中国植物志.北京:科学出版社,1977:70.
Editorial Committee of Chinese Journal of Plant of Chinese Academy of Sciences.Flora of China.Beijing:Science Press,1997:70.(in Chinese)
[2]Cahill J P.Human selection and domestication of chia.Journal of Ethnobiology,2005,25(2):155-174.
[4]Rendon-Villalobos R,Ortiz-Sanchez A,Solorza-Feria J,Trujillo-Hernández C A.Formulation,physicochemical,nutritional and sensorial evaluation of corn tortillas supplemented with chia seed (SalviahispanicaL).Czech Journal of Food Sciences,2012,30(2):118-125.
[5]Borneo R,Aguirre A,Len A E.Chia(SalviahispanicaL.)gel can be used as egg or oil replacer in cake formulations.Journal of the American Dietetic Association,2010,110(6):946-949.
[6]马云芳,相启森,申瑞玲,董吉林,林娟.奇亚籽的营养成分、健康功效和在食品工业中的应用.食品工业,2015,36(5):207-211.
Ma Y F,Xiang Q S,Shen R L,Dong J L,Lin J.Nutritional components,health-promoting effects of chia seeds and their application in the food industry.The Food Industry,2015,36 (5):207-211.(in Chinese)
[7]张正付,陈鸿珊,李卓荣.鼠尾草属植物化学成分及活性研究进展.中国新药杂志,2007,16(9):665-672.
Zhang Z F,Chen H S,Li Z R.Research of constituents and bioactivity ofSalviaspp.Chinese Journal of New Drugs,2007,16(9):665-672.(in Chinese)
[8]胡忠红,易自力,王红权,艾辛,谭昕,陈智勇.芡欧鼠尾草脂肪酸成分分析.中国粮油学报,2011,26(12):106-108.
Hu Z H,Yi Z L,Wang H Q,Ai X,Tan X,Chen Z Y.Oil content and fatty acid composition ofSalviahispanicaL.Journal of the Chinese Cereals and Oils Association,2011,26 (12):106-108.(in Chinese)
[9]秦海燕,陈季武.鼠尾草叶提取物清除自由基、抗氧化作用的研究.食品科学,2006,27(7):89-92.
Qin H Y,Chen J W.Study on scavenging free radical and anti-oxidation effects of extracts fromSalviaofficinalisleaves.Food Science,2006,27(7):89-92.(in Chinese)
[10]Bulgakov V P,Inyushkina Y V,Fedoreyev S A.Rosmarinic acid and its derivatives:Biotechnology and applications.Critical Reviews in Biotech-nology,2012,32(3):203-217.
[11]曹丽敏.鼠尾草属植物研究进展.湖南农业科学,2009(3):137-139,147.
Cao L M.Advances and perspective in studies on SalviL.Hunan Agricultural Sciences,2009(3):137-139,147.(in Chinese)
[12]王宗霞,康慧.蓝花鼠尾草组织培养试验研究.内蒙古科技与经济,2003(9):19-22.
Wang Z X,Kang H.Studies on tissue culture ofSalviafarinacea.Inner Mongolia Science Technology & Economy,2003(9):19-22.(in Chinese)
[13]王萌,张丽,谢显莉,张利.甘西鼠尾草愈伤组织诱导、增殖及分化研究.中草药,2011,42(6):1206-1209.
Wang M,Zhang L,Xie X L,Zhang L.Induction,proliferation,and differentiation on callus culture ofSalviaprzewalskii.Chinese Traditional and Herbal Drugs,2011,42(6):1206-1209.(in Chinese)
[14]Mirian B,Osvaldo D S,Melisa B,María E V,Héctor B,Cecilia S.In vitro response of differentSalviahispanicaL.(Lamiaceae) explants.Molecular Medicinal Chemistry,2010,21:125-126.
[15]Marconi P L,Lpez M C,De Meester J,Bovjin C,Alvarez M A.In vitro establishment ofSalviahispanicaL. plants and callus.Biotecnología Ve-getal,2013,13(4):203-207.
[16]周建国,刘珊珊,毛志远,张硕霖,李文华,李荣文,刘杨.丹参组织培养技术的初步研究.食品与药品,2015,17(2):93-95.
Zhou J G,Liu S S,Mao Z Y,Zhang S L,Li W H,Li R W,Liu Y.Preliminary study on tissue culture technique ofSalviamiltiorrhizaBunge.Food and Drug,2015,17(2):93-95.(in Chinese)
[17]沙红,廖康.药用鼠尾草的组织培养研究.新疆农业大学学报,2006,29(4):53-55.
Sha H,Liao K.Study on tissue culture in medical herbsSalaviaofficinalis.Journal of Xinjiang Agricultural University,2006,29(4):53-55.(in Chinese)
[18]房师梅,雷世俊,王洪波,王裕,丁雪珍.丹参组培快繁技术研究.北方园艺,2013(21):123-126.
Fang S M,Lei S J,Wang H B,Wang Y,Ding X Z.Study on tissue culture and rapid propagation ofSalvia.Northern Horticul-ture,2013(21):123-126.(in Chinese)
[19]文锦芬,邓明华,施卫省,彭春秀.鼠尾草离体培养植株再生体系的建立.昆明理工大学学报(理工版),2007,32(6):84-88.
Wen J F,Deng M H,Shi W S,Peng C X.Establishment ofSalviain-vitro plant regeneration system.Journal of Kunming University of Science and Technology (Natural Science Edition),2007,32(6):84-88.(in Chinese)
[20]李守岭,张骥,王应清,李国明,张丽萍.3种植物生长调节剂对鼠尾草种子萌发的影响.湖南农业科学,2015(3):68-70.
Li S L,Zhang J,Wang Y Q,Li G M,Zhang L P.Effects of 3 kinds of plant growth regulator on the germination of Sage seed.Hunan Agricultural Sciences,2015(3):68-70.(in Chinese)
[21]瞿珍.鼠尾草种子无菌培养及快繁技术研究.安徽农学通报,2010,16(23):64-65.
Qu Z.Study on sterile culture and rapid breeding technique of Sage seed.Anhui Agricultural Science Bulletin,2010,16(23):64-65.(in Chinese)
[22]刘丽,郭巧生,王云鹏,赵荣梅.药用鼠尾草种子萌发特性的初步研究.中国中药杂志,2006,31(19):1587-1589.
Liu L,Guo Q S,Wang Y P,Zhao R M.Study on characteristics of seed germination ofSalviaofficinalis.China Journal of Chinese Materia Medica,2006,31(19):1587-1589.(in Chinese)
[23]蒋新民,杨春华,刘羽.不同激素配比对“ABBY”草地早熟禾愈伤组织诱导的影响.草业科学,2013,30(12):1974-1979.
Jiang X M,Yang C H,Liu Y.Influence of different hormone combinations on Kentucky bluegrass ‘ABBY’ callus induction.Pratacultural Science,2013,30(12):1974-1979.(in Chinese)
[24]钏秀娟,陈彩虹,罗丽娟.热研5号柱花草高频、优质愈伤组织的诱导.草业科学,2015,32(1):78-84.
Chuan X J,Chen C H,Luo L J.Callus induction ofStylosanthesguianensiscv.Reyan No.5.Pratacultural Science,2015,32(1):78-84.(in Chinese)
[25]张芳芳,王鹏,姬丹丹,向凤宁.南方红豆杉愈伤组织培养条件的优化及紫杉醇积累的基因表达效应分析.中草药,2010,41(12):2058-2062.
Zhang F F,Wang P,Ji D D,Xiang F N.Optimization of callus culture conditions forTaxuschinensisvar.maireiand effect of gene expression of Taxol accumulation.Chinese Traditional and Herbal Drugs,2010,41(12):2058-2062.(in Chinese)
[26]李合生.现代植物生理学.北京:高等教育出版社,2002.
Li H S.Modern Plant Physiology.Beijing:Higher Education Press,2002.(in Chinese)
[27]黄科,唐婧,刘自震,汤玲,蒲云红,刘奕清.生长素和细胞分裂素对桑树离体繁育的影响.西南大学学报(自然科学版),2015,37(3):1-8.
Huang K,Tang J,Liu Z Z,Tang L,Pu Y H,Liu Y Q.Influences of auxin and cytokine on propagation in vitro of mulberry.Journal of Southwest University (Natural Science Edition),2015,37(3):1-8.(in Chinese)
[28]舒庆艳,徐夙侠,金治平,杨永芳,刘公社.mRNA差异显示技术分离羊草基因体外培养过程中特定基因及特性分析.草业学报,2007,16(5):113-120.
Shu Q Y,Xu S X,Jin Z P,Yang Y F,Liu G S.Isolation and characterization of genes ofLeymuschinensisduring in vitro culture using cDNA dif-ferential display technique (DDRT-PCR).Acta Prataculturae Sinica,2007,16(5):113-120.(in Chinese)
(责任编辑武艳培)
DOI:10.11829/j.issn.1001-0629.2015-0424
*收稿日期:2015-08-06接受日期:2015-10-09
基金项目:湖南省科技计划项目——名贵畅销花卉新品种繁育与产业化开发研究(2014FJ3089)
通信作者:黄丽芳(1976-),女(回族),湖南中方人,助理研究员,硕士,主要从事花卉和药用植物品种选育与栽培技术研究。E-mail:hlf@isa.ac.cn
中图分类号:Q943.1
文献标识码:A
文章编号:1001-0629(2016)3-0393-07* 1
Corresponding author:Huang Li-fangE-mail: hlf@isa.ac.cn
Tissue culture and rapid propagation ofSalviahispanica
Li Wei-li1,2, Huang Li-fang1, Xia Xin-jie1
(1.Key laboratory of Agro-Ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China;2.University of Chinese Academy of Science, Beijing 100049, China)
Abstract:In order to establish the tissue culture and rapid propagation system of Salvia hispanica, the present study explored the impacts of different concentrations of hormone on callus induction, proliferation and root induction with the mature seed of S. hispanica as explant and 1/2MS as the basic medium. The results showed that the optimal medium for callus induction was 1/2MS medium with 10.0 mg·L-16-BA, 1.0 mg·L-1NAA and 0.4 mg·L-1ZT, which had the highest induction rate of 66.5%. The optimal medium for the proliferation was 1/2MS medium with 3.0 mg·L-16-BA and 0.5 mg·L-1NAA, with the highest multiplication coefficient of 7.69. The optimal medium for the root induction was 1/2MS medium with 0.5 mg·L-1NAA, which had the highest root induction rate of 100% and the average rooting coefficient of 5.68. Plants grew very well after transplanting with a survival rate of 97%.
Key words:Salvia hispanica; mature seed; tissue culture; rapid propagation
李伟丽,黄丽芳,夏新界.芡欧鼠尾草的组织培养和快速繁殖.草业科学,2016,33(3):393-399.
Li W L,Huang L F,Xia X J.Tissue culture and rapid propagation ofSalviahispanica.Pratacultural Science,2016,33(3):393-399.
第一作者:李伟丽(1988-),女,河南商水人,在读硕士生,主要从事药用植物品种选育与栽培技术工作。E-mail:wlli1127@126.com
