千里香杜鹃根系生物量时空动态特征及其生态适应性
2016-08-02曹文侠李文
曹文侠,李文
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
千里香杜鹃根系生物量时空动态特征及其生态适应性
曹文侠,李文
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
摘要:以东祁连山高寒杜鹃灌丛草地建群种-千里香杜鹃为对象,研究了灌丛基部和灌丛间千里香杜鹃及其他植物根系生物量水平与垂直分布特征,以及不同生育期的动态规律。结果表明,随土层的深入,千里香杜鹃地下粗根、细根生物量,以及群落其他植物的地下活根及死根生物量均随土层的深入显著降低,千里香杜鹃地下细根生物量的90%分布在0~20 cm的土层中,千里香杜鹃灌丛基部生物量大于灌丛间。千里香杜鹃细根生物量在萌动期和休眠前相对较低,从6月份开始进入快速增长期,7月达最大;表层峰值的出现总是早于深层,而灌丛间峰值早于灌丛基部,灌丛间细根变幅活跃。群落其他植物地下生物量从萌动初开始下降,7月达最低,8月出现小幅增长后开始下降,在生长季末呈现较大幅度增长;随土层加深,死根生物量比例增加,7, 8月份0~10 cm层土壤中千里香杜鹃活根占总生物量的比值最大,此时,群落活根总量接近或大于死根,但年平均群落死根量大于活根,深层动态升降的出现滞后于表层。
关键词:高寒灌丛草地;千里香杜鹃;根系生物量;时空动态
青藏高原是全球气候变化的敏感地区,同时,青藏高原环境变化对全球气候变化具有强烈影响[1]。青藏高原东北缘的祁连山国家级自然保护区是青藏、蒙古、黄土三大高原交汇地带,保护区内植被类型多样,其中灌丛地4.13×105hm2,分布在海拔3000~3900 m的高山及亚高山地区的杜鹃(Rhododendronspp.)灌丛草甸和柳类(Salixspp.)灌丛草甸草地,在涵养水源和防止土壤侵蚀等生态服务功能的发挥中具有极其重要的地位,对维护绿洲生态系统的平衡和遏制荒漠化有着不可替代的作用,成为自然保护区的主要保护对象[2-3]。但高寒杜鹃灌丛草地生态服务功能的生物学机制等相关问题的研究并未得到足够的重视,因而缺少对高寒杜鹃灌丛资源保护和利用的实际指导作用。高寒灌丛通过调整养分[4-5]和地上生物量[6-7]的分配,有效利用水、热资源,以适应高寒气候及缓冲放牧[8-9]、增温[10-11]等给灌丛草地系统带来的影响,进而改变草地系统土壤碳储量[4,10-11]与微生物活动[12-13]。植物地下部分的研究对探究植物适应环境机理有十分重要的意义[14],高寒地区灌丛草地地下生物量特征及植物根系特征是研究植物对高寒环境适应性的重要途径[15-16],而仅从群落水平研究地下生物量,仍不能深入理解群落内各物种的不同贡献及种间的相互作用。
在植物地下根系统中,尽管细根(直径≤1 mm)所占的比例并不大,但细根在吸收水分和矿物质、合成和储存营养、通过更新与土壤微生物的相互作用,在整个生态系统的碳循环中起着十分重要的作用[17-18],因此,细根的一些参数可作为评价木本植物的重要指标[19]。细根的比例直接影响根系的生理功能和对土壤资源的利用能力[20],细根所占的相对比例越大,活跃生长的根尖数目就越多。因此,对细根的准确量化是理解植物地下生产力的关键[21-24],也可为理解植物与土壤间的相互作用提供帮助,更是碳循环研究的重要内容[25-26]。目前,对作物地下根系空间分布及不同生育期的生物量动态规律研究很受重视[27],对水分涵养植被高寒杜鹃灌丛草地建群种根系分布与细根动态规律的研究是深入理解其生态功能的重要途径。
因此,本研究以东祁连山高寒杜鹃灌丛的优势种—千里香杜鹃(Rhododendronthymifolium)为对象,从物种水平研究其地下根系的基本参数及根系生物量的水平和垂直分布特征,以及不同生育期的动态规律及与其他植物间的关系,反映整个群落的地下动态特征及其在系统中的功能,为全面了解该系统的生态特征及人为扰动下的群落稳定机制提供理想的入口,并为千里香杜鹃灌丛草地的有效保护、科学管理与合理利用提供科学依据。
1材料与方法
1.1样地自然概况
试验地位于祁连山东段的甘肃省天祝藏族自治县抓喜秀龙乡,地理坐标N 37°11′-37°13′,E 102°29′-102°33′,海拔从2950 m的河谷地带向南延伸至海拔4300 m的马牙形石峰,达到该区的最高峰马牙雪山。境内地形受马牙雪山和雷公山强烈隆起的影响,形成东西向的峡谷地带,西高东低,金强河上游流贯其中,两侧山峰高出谷地百米至数百米,区内形成山地和河谷两大典型地形。在海拔3050 m以上的山地阴坡成带分布着高寒杜鹃灌丛草甸与高寒柳灌丛草甸,阶地与河谷带分布有金露梅(Potentillafruticosa)灌丛草地,阳坡则以高寒草甸草原为主。全区气候寒冷潮湿,空气稀薄,太阳辐射强烈。年均温-0.1 ℃,1月平均气温-18.3 ℃,7月12.7 ℃,>0 ℃的年积温1380 ℃,水热同期,年日照时数2600 h,年降水量416 mm,多为地形雨,主要集中于7-9月,植物生长季为120~140 d。年蒸发量1592 mm。无绝对无霜期,仅分冷、热两季。
1.2试验设计与取样方法
试验地选在远离牧民居住点,无伐薪、破坏程度较轻、灌丛较密、受放牧活动干扰很小的杜鹃灌丛,位于甘肃农业大学高山草原试验站正南的泉干沟中段(马牙雪山前山,东北坡),面积约为1 km2,海拔3130 m,坡向北偏东5°,坡度35°,灌层盖度73%,高85~90 cm,群落优势种为千里香杜鹃与头花杜鹃(R.capitatum),分盖度均在40%以上,亚优势种为山生柳(Salixoritrepha),分盖度为20%以上,伴生种主要有鬼箭锦鸡儿(Caraganajubata)、金露梅、烈香杜鹃(R.anthopogonoides)、高山绣线菊(Spiraeaalpina)、红花岩生忍冬(Lonicerarupicola)、刚毛忍冬(Lonicerahispida)等,灌下草本植物主要有珠芽蓼(Polygonumviviparum)和北极果(Arctousalpinus),总盖度30%~40%。
试验于2006年5-11月间进行,取样时间综合考虑千里香杜鹃生长发育的几个关键阶段:萌动期、展叶开花期、茎叶快速生长和次年花芽分化发育期、种子果实发育成熟期、休眠前期共5个时期。在样地内随机选取30株样丛,进行检测。并从中选择出5个标准株丛,无明显的病虫危害,生长状况良好,株丛高度和丛分枝数为群落中该种杜鹃的平均值,树冠无明显的干枯折损,周围至少有3丛以上同种杜鹃株丛。
李鹏等[28]在伯姆[29]提出1/4营养面积取样法的基础上,提出了样圆法研究刺槐(Robiniapseudoacacia)根系,这比随机取样方法误差更小,本研究借鉴了李鹏等[30]、赵忠等[31]的研究思路,并结合应用Tomlinson等[32]的土钻法,以减少对植被的破坏性挖掘。分别于每个样株的灌丛基部(植冠垂直投影边缘至灌基区)和灌丛间(同种杜鹃的不同株丛间距的中心点)各选5个取样点,用直径10 cm土钻分3层(0~10 cm, 10~20 cm和20~30 cm)取样,并将同层的5钻土样混合后作为1个重复。杜鹃根的地下分布以沿坡面向上分布为主,因此坡地取样点布设在样丛的两侧和上方(图1)。经试验前测试,该取样方法与随机取样间差异并不显著(P>0.05),但可减少取样的工作量。当土钻遇石块或大根粗根难以正常下钻时,可适当变换钻的位置。
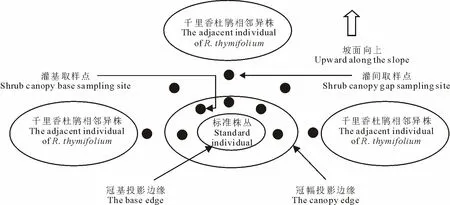
图1 杜鹃根取样示意图Fig.1 Sampling of R. thymifolium roots
将取好的样品装入塑料袋内并编号,带回室内进行分离,不能及时分离的样品在-20 ℃贮藏,直到被完全分离,所有样品的加工处理在20 d内完成[33]。根系和土壤用湿筛法[29]进行冲洗分离,冲洗工具由2个不同孔径(0.44和0.30 mm)的筛子组成,其中大孔径的筛子在上,小孔径的筛子在下,冲洗时较粗的根留在大孔径的筛子中,细毛根则留在小孔径的筛子中,待泥水冲干净后即可达到根系与土壤完全分离的目的,再用镊子将根系从两个筛子中挑出,用沉淀法清除细沙等,挑除枯枝、叶和苔藓等杂物。通过根的分枝模式、颜色、末端特点、弯曲程度和抗拉弹性等物理特性及气味等将千里香杜鹃根与其他灌木根系及草本(包括根茎)进行分离[33],并进一步区分活根和死根[34]。
根据千里香杜鹃根系的形态与结构特征,从活根中分拣出千里香杜鹃根系与非千里香杜鹃植物根系(主要包括其他灌木及草本植物的根和根茎),并参照前人关于粗根和细根的划分标准[24,29],进一步将千里香杜鹃根按骨干根(直径Φ≥5 mm),粗根(Φ=1~5 mm)与细根(Φ≤1 mm)进行分拣,分类装入信封中在80 ℃的烘箱中烘至恒重,称其干重。
1.3千里香杜鹃根系的主要识别要点
本研究参考前人的方法[29,35-36],并以杜鹃灌丛群落主要植物根系的单独挖掘识别为基础,对千里香杜鹃根系进行了准确识别和分离。千里香杜鹃细根较易与珠芽蓼、北极果及苔草(Carexspp.)根混淆。珠芽蓼根较直,无表皮、中空,轻扭搓时有明显变形,而杜鹃根手感刚挺,有较大弹性。北极果细根黑、具纵纹、质软、光滑,苔草根光滑、直伸均匀,根的色泽也有明显差别。所有杜鹃根在湿润状态下容易分拣,初检时为防错检,借助于解剖镜识辨。不同杜鹃一般较少同时出现在同一土样中,出现时,也容易分辨。千里香杜鹃根系黑褐色、多扭曲不直、手感坚挺,7月份根系快速生长期颜色变亮变浅,10月底根皮发黑褐色。通过在烧杯清水中进行悬浮,来辅助筛选出色泽鲜活的明显活根及质软的幼根。对色泽较暗的根可轻轻用力进行牵拉,如果韧性和弹性较好,且拉断后截面及髓部鲜活,则可判定为活根,否则为死根,并与轻质和重质死根碎痟一并计算为死根。
1.4数据分析
采用Microsoft Excel 2007进行数据的初步整理,用SPSS 17.0对同层不同时期根系生物量进行单因素方差分析(One-way ANOVA)。
2结果与分析
2.1千里香杜鹃地下不同直径根系生物量特征及时空动态
群落中,千里香杜鹃不同直径根生物量特征及时空动态变化如图2所示。灌丛基部和灌丛间千里香杜鹃粗根、细根及总活根生物量随土层的深入均表现出逐渐降低的规律,且0~10 cm和10~20 cm土层千里香杜鹃根生物量不同生育期波动较大,其中0~10 cm变幅最大,而20~30 cm变动很小,基本保持相对平稳。在整个试验期,灌丛基部和灌丛间0~30 cm土层千里香杜鹃粗根生物量均在8月20日达最大,但灌丛基部是灌丛间的1.33倍。灌丛基部0~10 cm土层粗根生物量占0~30 cm土层总粗根生物量的比例为50%~76%,最大比值出现在7月14日;灌丛间0~10 cm土层粗根生物量占总粗根生物量的比例为59%~93%,最大比值出现在8月20日。灌丛基部和灌丛间0~30 cm土层千里香杜鹃细根生物量均在7月14日达最大,6月13日最小,从水平空间分布动态看,杜鹃细根生物量峰值出现的先后顺序为灌丛基部早于灌丛间;从垂直空间看,0~10 cm土层早于10~20 cm层,10~20 cm层又早于20~30 cm层。千里香杜鹃总活根生物量灌丛基部和灌丛间均在8月20日最大,除6月13日外,灌丛基部0~30 cm土层总活根生物量显著高于灌丛间,灌丛基部0~10 cm土层总活根占0~30 cm土层总活根的比例为53%~77%,灌丛间为55%~89%。
2.2群落中除千里香杜鹃外的其他植物不同类型根系生物量特征及时空动态
千里香杜鹃灌丛群落中除千里香杜鹃外的其他所有植物总活根生物量特征及时空动态变化如图3所示。随着土层深度增加,其他植物根系生物量急剧降低。杜鹃群落除千里香杜鹃外的其他所有植物总活根生物量在7月份之前处于下降过程,7月后才开始较快增长,比千里香杜鹃细根开始增长的时间相对滞后。
千里香杜鹃灌丛群落地下总活根、地下总死根和地下总根生物量均随着深度增加,数量急剧降低(图4)。群落地下0~10 cm土层总活根生物量在7、8月较高,9月小幅下降,生长季末又略有增长。10~20 cm和20~30 cm土层变化趋势基本一致,都在7月处于低谷,且变幅较小。从水平分布看,0~10 cm土层除杜鹃之外的其他植物的地下生物量,以及地下总活根生物量的增长在灌丛基部早于灌丛间。总体上,地下死根生物量也有相似的动态规律,即先降后升,以7、8月份植物旺盛生长期较低,从灌丛基部数据看,这一升降总是以表层出现较早,且0~10 cm土层死根组织的生物量变动较大。地下总根仍是0~10 cm土层的生物量远大于其他两层,9月份时,10~20 cm和20~30 cm土层总根量接近。0~20 cm土层总根量于8、9月份后开始增加,于11月初达到较高水平,而20~30 cm 11月初较低。
2.3杜鹃群落中千里香杜鹃根系所占的比例及动态
千里香杜鹃根系占杜鹃群落的比例如图5所示,其中千里香杜鹃活根生物量占群落总活根生物量的比率波动较大(图5)。总体上,10~20 cm土层千里香杜鹃活根比值较高,其余两层差异不明显,最低值出现在6月,7月是杜鹃生长发育的最佳时期,这一比值无论从水平、还是垂直空间均达到了最高峰 (只有灌丛间0~10 cm层8月测值才达到最高),之后开始下降,但11月初又有小幅回升。0~10 cm土层千里香杜鹃活根生物量比率在不同生长阶段间变动相对缓和, 10~20 cm土层千里香杜鹃活根生物量比率增幅剧烈。 千里香杜鹃活根生物量比率及其动态在水平空间尺度上并无显著差异。千里香杜鹃群落总死根与总活根生物量的比值变化明显,不同土层中死根生物量的年平均值大于活根,且随土层的加深,总死根与总活根生物量比值增大,但不同土层间差异明显,萌动期这一比值在3个土层间较为接近,但随着生长高峰期的到来,10~20 cm和20~30 cm土层中死根比例显著上升,但0~10 cm土层死根量有轻微降低,并于生长旺盛期出现活根总量大于死根的阶段,之后月份比值开始增长,但灌丛基部与灌丛间无明显差异。

图2 千里香杜鹃地下不同直径根生物量特征及时空动态Fig.2 Different diameter roots biomass temporal dynamic of R. thymifolium 不同小写字母表示同层根系不同日期间差异显著(P<0.05)。下同。Different small letters indicate the significant differences (P<0.05) under the same soil layers among different date. The same below.

图3 千里香杜鹃群落中其他植物总活根生物量时间动态Fig.3 Live roots biomass temporal dynamic of non R. thymifolium community

图4 千里香杜鹃群落地下根生物量时间动态Fig.4 Biomass temporal dynamic of R. thymifolium community roots

图5 杜鹃活根、死根生物量比率的时间动态Fig.5 Biomass percentage temporal dynamic of R. thymifolium community in total live and dead roots
3讨论
根系的生长积累与周转,是植物对环境温度、水分的反映,也是植物地上与地下相互作用与平衡的结果[37]。研究分析东祁连山高寒杜鹃灌丛群落优势种——千里香杜鹃的地下根系分布特征与时空动态,有助于更好理解植物对高寒环境的适应策略及其在生态系统中的地位与作用。千里香杜鹃根系活根与死根生物量随土层深度的增加表现出逐渐降低的规律,活根大部分分布于表层土壤中。群落中除千里香杜鹃外的其他植物地下总活根、地下总死根及群落地下总生物量也随土层深度的增加急剧降低,这一规律与其他生态系统中地下生物量的垂直分布规律一致[38]。但千里香杜鹃灌丛植物的根系分布相对较浅,这与高寒地区深层土壤温度过低,影响根系活动有关。
千里香杜鹃活根生物量在年内不同生育期的动态变幅随土层深度的增加依次减小,其中,0~10 cm土层变幅最大,20~30 cm土层保持相对平稳。高寒灌丛植物生长的主要限制因素是温度,受土壤温度及理化特性的影响,细根生物量多集中分布于表层,随土层深度的增加而减少,较深土层对温度响应迟滞。不同土层细根分布的差异是细根功能转换的反映,也是对土壤资源有效性变化的反映[39]。表层土壤养分含量高、水分充足、温度较为适宜,细根主要集中在表层内以获取水分和养分,而少量分布在下层的细根主要功能为吸收水分[40]。本研究中,0~10 cm土层千里香杜鹃细根从6月份开始进入快速生长期,于7月达最大,且0~10 cm土层千里香杜鹃细根生物量峰值的出现早于深层。10~20 cm土层的千里香杜鹃细根生物量峰值出现在8月,这可能与表层土壤首先受到气温回升的影响有关。从水平分布动态看,灌丛基部千里香杜鹃细根生物量大于灌丛间。从水平空间分布看,灌丛间的千里香杜鹃细根生物量峰值出现早于灌丛基部,这可能是因为灌丛间能接收到更多的太阳辐射,土壤温度提升较快,从而加快了植物地下部分的活动所致。
细根的生长与死亡具有明显的季节性动态[21,41],灌丛基部、灌丛间千里香杜鹃细根动态变化表现为5、6月萌动期最低,7月份最高,之后又开始下降。这一动态变化反映出千里香杜鹃与环境温度因子之间的一种适应。5月份植物随着土壤的消融和温度的回升,植物开始进入一个新的生长季,但由于植物同化作用尚未完全建立,因此植物需要以自身细根能量贮备的消耗为代价,因而出现了6月份细根生物量的暂时性快速下降。随着植物营养生长的加快,细根也进入快速生长期,以保证植物对水分及营养的需要,细根生物量于7月份达到最高峰,之后由于气温逐渐开始降低,植物生长减缓,细根的生长速度也随之降低。另外,这一变化是否还与降水有关尚需进一步探讨。
千里香杜鹃与其他植物间的关系是千里香杜鹃优势地位的体现。群落中除千里香杜鹃外的其他植物的活根生物量在7月之前处于下降过程,7月后才开始较快增长,至8月达到一小峰值,9月后略有下降,但从整个生长季的动态看,呈明显的“U”字型曲线,即生长季开始时群落中其他植物根系具有较高的生物量,随着植物地上部分的生长发育而下降,至生长季末,地下生物量升至最大。这是因为其他植物主要为千里香杜鹃灌下的草本植物及少量其他灌木,因受杜鹃冠层的遮挡,下层草本植物和其他灌木的发育受到一定抑制。另外,草本植物中珠芽蓼所占比例较高,其发达的块茎在生长期出现营养从地下部分向地上部分流转,而生长季末出现从地上部分向地下部分流转的趋势,可能是形成以上变化的主要原因。千里香杜鹃群落地下总活根生物量,在0~10 cm土层表现为7、8月较高,9月小幅下降,生长季末又略有增长的“双峰型”变化趋势,10~20 cm和20~30 cm土层变化趋势与0~10 cm基本一致,这与宇万太和于永强[42]的研究结果一致。
群落总死根与总活根之比的峰值表层早于深层,这同样是表层土壤温度回升较早,促进了细根的生长和死根的分解,而细根的死亡与周转受温度的影响[43-44]。千里香杜鹃活根在整个地下活根中所占的比例在萌动初开始下降,6月达最低,可能与杜鹃主要进行营养生长有关,而此时草本植物等其他植物根量也因早期返青萌发生长消耗而出现下降,但降幅滞后于杜鹃,7月千里香杜鹃根量比已居全生长季最高,而后适度下降。7月中下旬千里香杜鹃的根量比居全年最高,这与千里香杜鹃占居群落地上的高层优势空间,获得充足的光热资源,较早开始快速生长,而底层草本植物及其他中层灌木则受到一定程度的抑制有关。但相对而言,较早时期千里香杜鹃开花及展叶期叶量较少,对底层的遮蔽较小,底层植物实现了分蘖等早期的生长准备,并为生长季末达到较高的地下生物量(根、根茎、分蘖节等)做好了必要的贮备。这一特点也对千里香杜鹃灌丛草地群落中不同植物种的共存与多样性维持有重要意义。
千里香杜鹃群落死根占总根系生物量的比值8月最小,这可能是7月较高的土壤温度促进了微生物对死根组织的分解的结果。因为死根在总地下根量中所占比例很高,所以相应的总地下生物量也是全年中最低时期。从千里香杜鹃群落总死根与总活根生物量比值看,不同土层中死根生物量的年平均值大于活根,且随土层的加深,这一比值逐渐增大,这与高寒区植物死根分解代谢较慢,出现积累有关。萌动期(5、6月)这一比值在3个土层间较为接近,但随着生长高峰期(7、8月)的到来,10~20 cm和20~30 cm土层中这一比值显著上升,而0~10 cm土层死根量有轻微降低,并于生长旺盛期出现活根总量大于死根的阶段,8月后比值开始增长,但灌丛基部与灌丛间无明显差异。总体上,10~20 cm土层为千里香杜鹃活根比值最高的土层,其余两层差异不明显,这既可能是千里香杜鹃与其他植物间的地下竞争有关[45],也可能是千里香杜鹃分布于10~20 cm土层的粗根比例较高,更新较缓。千里香杜鹃活根占总活根生物量的比率变幅较大,最低值出现在5、6月千里香杜鹃萌动期,这一比值于7月份达最高。
从以上分析可以看出,千里香杜鹃地下细根主要分布在0~20 cm的浅层土壤中,并主要集中分布在灌丛基部;千里香杜鹃的细根从6月份开始快速增长,7月达最大,这与植物地上的旺盛生长期吻合,且灌丛间细根变幅比冠基下活跃;活根、死根更新的月动态变幅规律明显,深层动态升降的出现滞后于表层。千里香杜鹃通过根系在垂直与水平空间的适应性分布,有效利用土壤及光热资源,并与群落中其他植物间保持适宜的竞争与稳定共存关系,奠定了其在群落中的优势地位。千里香杜鹃在其不同生育时期通过细根的生长更新及时空动态变化,以适应高寒地区的低温等严酷生境,在杜鹃灌丛草地生态系统的物质循环与生态功能维持中发挥着重要作用。
References:
[1]Wang C S, Meng F D, Li X E,etal. Responses of alpine grassland ecosystem on Tibetan Plateau to climate change: A mini review. Chinese Journal of Ecology, 2013, 32(6): 1587-1595.
[2]Liu Z, Shen W S, Che K J,etal. Ecological resilience of Qilian mountain nature reserve. Journal of Ecology and Environment, 2006, 22(3): 19-22, 75.
[3]Hu Z Z. Ecosystem services of rangeland/grassland: Ⅱ Items of ecosystem services of rangeland/grassland. Grassland and Turf, 2005, 1: 3-10.
[4]Wei W, Cao W X, Qi J,etal. Influence of grazing disturbance on stoichiometric characteristics of alpine rhododendron shrub lands underground soil nutrient pool. Chinese Journal of Eco-Agriculture, 2012, 20(8): 1024-1029.
[5]Gao Q, Yang X C, Yin C Y,etal. Estimation of biomass allocation and carbon density in alpine dwarf shrubs in Garzê Zangzu Auto-nomous Prefecture of Sichuan Province, China. Chinese Journal of Plant Ecology, 2014, 38(4): 355-365.
[6]Lei L, Liu X D, Wang S L,etal. Assignment rule of alpine shrubs biomass and its relationships to environmental factors in Qilian Mountains. Ecology and Environmental Sciences, 2011, 20(11): 1602-1607.
[7]Zhang W L, Ren S C, Yao X S,etal. Aboveground biomass and water storage allocation in alpine willow shrubs in the Qilian Mountains in China. Journal of Mountain Science, 2015, 12(1): 207-217.
[8]Zhu Z H, Wang X A, Li Y N,etal. Predicting plant traits and functional types response to grazing in an alpine shrub meadow on the Qinghai-Tibet Plateau. Science China Earth Sciences, 2012, 55(5): 837-851.
[9]Cao W X, Xu C L, Zhang D G,etal. Ecological responses of soil bulk density and water content to different non-grazing patterns in alpine rhododendron shrubland. Acta Prataculturae Sinica, 2011, 20(3): 28-35.
[10]Dawes M A, Hagedorn F, Zumbrunn T,etal. Growth and community responses of alpine dwarf shrubs to in situ CO2enrichment and soil warming. New Phytologist, 2011, 191(3): 806-818.
[11]Li H Q, Li Y N, Zhang F W,etal. Carbon budget of alpinePotentillafruticosashrub land based on comprehensive techniques of static chamber and biomass harvesting. Acta Ecologica Sinica, 2014, 34(4): 925-932.
[12]Wang G R, Chen X R, Zhang J Z,etal. The temporal and spatial distribution of soil microorganism physiological floras in alpine shrubs of the eastern Qilian mountains. Acta Prataculturae Sinica, 2011, 20(2): 31-38.
[13]Yang C D, Long R J, Chen X R,etal. Seasonal dynamics in soil microbial biomass and enzymatic activities under different alpine brushlands of the Eastern Qilian Mountains. Acta Prataculturae Sinica, 2011, 20(6): 135-142.
[14]Moshe S. Root study: why is it behind other plant studies. American Journal of Plant Sciences, 2013, 4: 198-203.
[15]Zhou H K, Zhou L, Zhao X Q,etal. Study of formation pattern of below-ground biomass inPotentillafruticosashrub. Acta Prataculturae Sinica, 2002, 11(2): 59-65.
[16]Wu Y, Deng Y, Zhang J,etal. Root size and soil environments determine root lifespan: evidence from an alpine meadow on the Tibetan Plateau. Ecological Research, 2013, 28(3): 493-501.
[17]McCormack M L, Dickie I A, Eissenstat D M,etal. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes. New Phytologist, 2015, 207(3): 505-518.
[18]Aerts R, Bakker C, De Caluwe H. Root turnover as determinant of the cycling of C, N and P in a dry heathland ecosystem. Biogeochemistry, 1992, 15(3): 175-190.
[19]Bakker M R. Fine-root parameters as indicators of sustainability of forest ecosystems. Forest Ecology and Management, 1999, 122(1): 7-16.
[20]Leppälammi-Kujansuu J, Aro L, Salemaa M,etal. Fine root longevity and carbon input into soil from below- and aboveground litter in climatically contrasting forests. Forest Ecology and Management, 2014, 326: 79-90.
[21]Wang D H, Zhao Z, Zhang Y. The fine root ofRobiniapseudoacaciaand soil moisture in the Loess Plateau. Journal of Northwest Forestry University, 2012, 27(1): 1-5.
[22]Liao L P, Chen C Y, Zhang J W,etal. Turnover of fine roots in pure and mixedCunninghamialanceolataandMicheliamacclureiforests. Chinese Journal of Applied Ecology, 1995, 6(1): 7-10.
[23]Shan J P, Tao D L, Wang M,etal. Fine roots turnover in a broad-leavedKoreanpineforest of Changbai mountain. Chinese Journal of Applied Ecology, 1993, 4(3): 241-245.
[24]Lin X H, Wang Z H, Chen Q B,etal. Vertical distribution and annual dynamics of fine roots ofHeveabrasiliensisat different ages. Acta Ecologica Sinica, 2008, 28(9): 4128-4135.
[25]Wachowski J, Landhäusser S M, Lieffers V J. Depth of root placement, root size and carbon reserves determine reproduction success of aspen root fragments. Forest Ecology and Management, 2014, 313: 83-90.
[26]Jha P, Mohapatra K P, Dubey S K. Fine roots carbon mineralization and soil carbon stabilization under major tree species of the semi-arid region of India. National Academy Science Letters, 2014, 37(5): 413-418.
[27]Yang L W, Zhang Y Q. Developing patterns of root systems of four cereal crops planted in dryland areas. Scientia Agricultura Sinica, 2011, 44(11): 2244-2251.
[28]Li P, Li Z B, Zhao Z. Study of the method for determining sampling number for root investigation. Research of Soil and Water Conservation, 2003, 10(1): 146-149.
[29]Boehm. Methods of Studying Root System[M]. Xue D R, Tan X L, translation. Beijing: Science Press, 1985.
[30]Li P, Zhao Z, Li Z B,etal. Research on root distribution parameters ofRobiniapseudoacaciaon different sites in Chunhua county. Journal of Nanjing Forestry University (Natural Science Edition), 2002, 26(5): 32-36.
[31]Zhao Z, Li P, Wang N J. Distribution patterns of root systems of main planting tree species in Weibei Loess Plateau. Chinese Journal of Applied Ecology, 2000, 11(1): 96-100.
[32]Tomlinson H, Traore A, Teklehaimanot Z. An investigation of the root distribution ofParkiabiglobosain Burkina Faso, West Africa, using a logarithmic spiral trench. Forest Ecology and Management, 1998, 107(1): 173-182.
[33]Parrotta J A, Lodge D J. Fine root dynamics in a subtropical wet forest following hurricane disturbance in Puerto Rico. Biotropica, 1991, 23(4): 343-347.
[34]Li G D. TTC staining method to distinguish the root of life. China’s Grassland and Forage Grass, 1986, 3(1): 34-36.
[35]Persson H A. The distribution and productivity of fine roots in boreal forests. Plant and Soil, 1983, 71(1-3): 87-101.
[36]Persson H. Fine-root production, mortality and decomposition in forest ecosystems. Vegetation, 1980, 41(2): 101-109.
[37]Wardle D A, Bardgett R D, Klironomos J N. Ecological linkages between aboveground and belowground biota. Science, 2004, 304: 1629-1633.
[38]Plante P M, Rivest D, Vézina A,etal. Root distribution of different mature tree species growing on contrasting textured soils in temperate windbreaks. Plant and Soil, 2014, 380(1-2): 429-439.
[39]Wang R L, Cheng R M, Xiao W F,etal. Fine root production and turnover inPinusmassonianaplantation in Three Gorges Reservoir Area of China. Chinese Journal of Applied Ecology, 2012, 23(9): 2346-2352.
[40]Burton A J, Pregitzer K S, Hendrick R L. Relationships between fine root dynamics and nitrogen availability in Michigan northern hardwood forests. Oecologia, 2000, 125(3): 389-399.
[41]Hulugalle N R, Broughton K J, Tan D K Y. Fine root production and mortality in irrigated cotton, maize and sorghum sown in vertisols of northern New South Wales, Australia. Soil and Tillage Research, 2015, 146: 313-322.
[42]Yu W T, Yu Y Q. Advances in the research of underground biomass. Chinese Journal of Applied Ecology, 2001, 12(6): 927-932.
[43]Li Q S, Wang D M, Xin Z B,etal. Root distribution in typical sites of Lijiang ecotone and their relationship to soil properties. Acta Ecologica Sinica, 2014, 34(8): 2003-2011.
[44]Yu X J, Jing Y Y, Xu C L,etal. Effect of film mulching on growth and crown and root characteristics of alfalfa in an alpine meadow. Acta Prataculturae Sinica, 2015, 24(6): 43-52.
[45]Leppälammi-Kujansuu J, Salemaa M, Kleja D B,etal. Fine root turnover and litter production ofNorwaysprucein a long-term temperature and nutrient manipulation experiment. Plant and Soil, 2014, 374(1-2): 73-88.
参考文献:
[1]王常顺, 孟凡栋, 李新娥, 等. 青藏高原草地生态系统对气候变化的响应. 生态学杂志, 2013, 32(6): 1587-1595.
[2]刘庄, 沈渭寿, 车克钧, 等. 祁连山自然保护区生态承载力分析与评价. 生态与农村环境学报, 2006, 22(3): 19-22, 75.
[3]胡自治. 草原的生态系统服务: Ⅱ. 草原生态系统服务的项目. 草原与草坪, 2005, 1: 3-10.
[4]魏巍, 曹文侠, 祁娟, 等. 放牧干扰对高寒杜鹃灌丛草地地下养分库化学计量特征的影响. 中国生态农业学报, 2012, 20(8): 1024-1029.
[5]高巧, 阳小成, 尹春英, 等. 四川省甘孜藏族自治州高寒矮灌丛生物量分配及其碳密度的估算. 植物生态学报, 2014, 38(4): 355-365.
[9]曹文侠, 徐长林, 张德罡, 等. 杜鹃灌丛草地土壤容重与水分特征对不同休牧模式的响应. 草业学报, 2011, 20(3): 28-35.
[11]李红琴, 李英年, 张法伟, 等. 基于静态箱式法和生物量评估海北金露梅灌丛草甸碳收支. 生态学报, 2014, 34(4): 925-932.
[12]王国荣, 陈秀蓉, 张俊忠, 等. 东祁连山高寒灌丛草地土壤微生物生理功能群的动态分布研究. 草业学报, 2011, 20(2): 31-38.
[13]杨成德, 龙瑞军, 陈秀蓉, 等. 东祁连山高寒灌丛草地土壤微生物量及土壤酶季节性动态特征. 草业学报, 2011, 20(6): 135-142.
[15]周华坤, 周立, 赵新全, 等. 金露梅灌丛地下生物量形成规律的研究. 草业学报, 2002, 11(2): 59-65.
[21]王迪海, 赵忠, 张彦. 黄土高原刺槐细根与土壤水分特征. 西北林学院学报, 2012, 27(1): 1-5.
[22]廖利平, 陈楚莹, 张家武, 等. 杉木、火力楠纯林及混交林细根周转的研究. 应用生态学报, 1995, 6(1): 7-10.
[23]单建平, 陶大立, 王淼, 等. 长白山阔叶红松林细根周转的研究. 应用生态学报, 1993, 4(3): 241-245.
[24]林希昊, 王真辉, 陈秋波, 等. 不同树龄橡胶 (Heveabrasiliensis) 林细根生物量的垂直分布和年内动态. 生态学报, 2008, 28(9): 4128-4135.
[27]杨丽雯, 张永清. 4种旱作谷类作物根系发育规律的研究. 中国农业科学, 2011, 44(11): 2244-2251.
[28]李鹏, 李占斌, 赵忠. 根系调查取样点数确定方法的研究. 水土保持研究, 2003, 10(1): 146-149.
[29]伯姆. 根系研究法[M]. 薛德榕, 谭协麟译. 北京: 科学出版社, 1985.
[30]李鹏, 赵忠, 李占斌, 等. 淳化县不同立地上刺槐根系的分布参数. 南京林业大学学报 (自然科学版), 2002, 26(5): 32-36.
[31]赵忠, 李鹏, 王乃江. 渭北黄土高原主要造林树种根系分布特征的研究. 应用生态学报, 2000, 11(1): 96-100.
[34]李光棣. 辨别死活根的TTC染色法. 中国草原与牧草, 1986, 3(1): 34-36.
[39]王瑞丽, 程瑞梅, 肖文发, 等. 三峡库区马尾松人工林细根生产和周转. 应用生态学报, 2012, 23(9): 2346-2352.
[42]宇万太, 于永强. 植物地下生物量研究进展. 应用生态学报, 2001, 12(6): 927-932.
[43]李青山, 王冬梅, 信忠保, 等. 漓江水陆交错带典型立地根系分布与土壤性质的关系. 生态学报, 2014, 34(8): 2003-2011.
[44]鱼小军, 景媛媛, 徐长林, 等. 高寒区垄沟覆膜方式对苜蓿生长、根颈及根系特征的影响. 草业学报, 2015, 24(6): 43-52.
DOI:10.11686/cyxb2015323
*收稿日期:2015-06-29;改回日期:2015-09-30
基金项目:国家自然科学基金(31360569)资助。
作者简介:曹文侠(1970-),男,甘肃会宁人,副教授,博士。E-mail: caowx@gsau.edu.cn
* 1Spatio-temporal trends for fine root biomass of alpineRhododendronthymifoliumand their significance for ecological adaptation in Qilian Mountains
CAO Wen-Xia, LI Wen
GrasslandScienceCollegeofGansuAgriculturalUniversity,GrasslandEcosystemKeyLaboratoryofMinistryofEducation,Si-no-U.S.ResearchCentersforSustainableGrasslandandLivestockManagement,Lanzhou730070,China
Abstract:Rhododendron thymifolium is a dominant species in alpine azalea shrub land in Eastern Qilian Mountains. The horizontal and vertical distribution of root biomass for R. thymifolium and of other associated plant species were measured under the shrub canopy and in the gaps between plants of R. thymifolium, and seasonal trends were monitored. Coarse and fine-root biomass, and other species root biomass decreased with increasing soil depth. For R. thymifolium, 90% of fine root biomass was located in the 0-20 cm soil layer, and root biomass under the shrub canopy was greater than that in the between-plant gaps. The fine-root biomass of R. thymifolium was less during the germination period and pre-dormancy periods; the fine roots grew rapidly from June, and reached peak values in July. Peak values always occurred earlier in the surface layer than in the deep layer, and roots in gap areas appeared earlier than those in the shrub canopy area. Gaps between shrubs were regions of active fine root growth. Root biomass of other species began to decline from the sprout period, and was low in July, then reached a maximum at the end of the growing season. The annual average dead root biomass was greater than live root biomass, the dead∶live root biomass ratio increased with soil depth.
Key words:alpine shrub land; Rhododendron thymifolium; root biomass; spatio-temporal trends
http://cyxb.lzu.edu.cn
曹文侠, 李文. 千里香杜鹃根系生物量时空动态特征及其生态适应性. 草业学报, 2016, 25(7): 52-61.
CAO Wen-Xia, LI Wen. Spatio-temporal trends for fine root biomass of alpineRhododendronthymifoliumand their significance for ecological adaptation in Qilian Mountains. Acta Prataculturae Sinica, 2016, 25(7): 52-61.
