多层螺旋CT双期扫描与生长抑素受体显像在胰腺内分泌肿瘤诊断中的比较
2016-08-02潘卫东薛华丹
王 辉,李 平,潘卫东,薛华丹
1新疆维吾尔自治区人民医院放射科,乌鲁木齐 8300002中国医学科学院 北京协和医学院 北京协和医院放射科,北京 100730
·论著·
多层螺旋CT双期扫描与生长抑素受体显像在胰腺内分泌肿瘤诊断中的比较
王辉1,李平2,潘卫东2,薛华丹2
1新疆维吾尔自治区人民医院放射科,乌鲁木齐 8300002中国医学科学院北京协和医学院北京协和医院放射科,北京 100730
摘要:目的比较多层螺旋CT双期增强扫描与生长抑素受体显像(SRS)对胰腺神经内分泌肿瘤(pNET)诊断的敏感性。方法收集2012年5月至2015年1月在北京协和医院经病理确诊的28例pNET患者的临床资料,术前均行CT及SRS检查,分析并对比CT双期扫描及SRS对pNET的诊断能力。结果CT双期扫描和SRS对pNET患者总的诊断敏感性分别为92.8%(26/28)和71.4%(20/28),差异有统计学意义(P=0.031)。对功能性pNET患者的诊断敏感性分别为94.1%(16/17)和58.8%(10/17),差异无统计学意义(P=0.218);对无功能性pNET患者的诊断敏感性分别为90.9%(10/11)和90.9%(10/11),差异无统计学意义(P=0.740)。对无转移pNET患者的诊断敏感性分别为90.4%(19/21)和57.1%(12/21),差异无统计学意义(P=0.125);对合并转移pNET患者的诊断敏感性分别为100%(7/7)和100%(7/7)。对G1级患者的诊断敏感性分别为84.6%(11/13)和53.8%(7/13),对G2级患者的诊断敏感性分别为100%(12/12)和 83.3%(10/12),对G3级患者的诊断敏感性分别为100%(3/3)和100%(3/3)。CT双期扫描和SRS对病灶直径≤2.0 cm的pNET诊断敏感性分别94.7%(18/19)和52.6%(10/19),差异有统计学意义(P=0.008);CT双期扫描和SRS对病灶直径>2.0 cm的pNET诊断敏感性分别为92.8%(13/14)和100%(14/14)。结论CT双期扫描对pNET患者的诊断敏感性高于SRS。pNET患者的病理分级越低,CT双期扫描与SRS相比优势越明显。对于直径≤2.0 cm的病灶,SRS容易出现假阴性,需同时结合其他影像学检查。
关键词:CT双期扫描;生长抑素受体显像;胰腺内分泌肿瘤
ActaAcadMedSin,2016,38(3):312-317
胰腺神经内分泌肿瘤(pancreas neuroendocrine tumors,pNET)为起源于胚胎前肠的神经内分泌细胞,可分为功能性和无功能性两大类。最常见的功能性pNET是胰岛素瘤,其次为胃泌素瘤,胰腺血管活性肠肽瘤和类癌则较为罕见。无功能性pNET缺乏特定的临床症状,无激素分泌,故无法进一步进行分类[1]。目前术前用于pNET检查的常见手段主要有内镜超声(endoscopic ultrasound,EUS)、B超、CT、MRI、生长抑素受体显像(somatosatatin receptor scintigraphy,SRS)等[2]。国外研究显示,CT、MRI、B超和EUS等可提供67.9%~89.2%的病灶检出率,对肿瘤定位、评估疾病进展情况、制定治疗方案及预后判断具有重要价值[3]。本研究回顾性分析了2012年5月至2015年1月在北京协和医院就诊并经病理证实的28例pNET患者的临床资料,比较了多层螺旋CT双期增强扫描与SRS对pNET诊断的敏感性,以期为今后的临床应用提供参考。
对象和方法
对象2012年5月至2015年1月在北京协和医院就诊,经病理检查证实,术前均行胰腺CT平扫、双期增强检查和生长抑素受体(somatosatatin receptor,SSTR)99TCm—HYNIC-TOC显像的pNET患者28例,其中,男12例,女16例,平均年龄(46.8±11.2)岁(21~75岁)。
病理及临床分类
病理分级:参照世界卫生组织2010年分类标准,根据核分裂象数和/或Ki- 67阳性指数对胃肠胰腺神经内分泌肿瘤(gastroenteropancreatic neuroendocrine tumors,GEP-NETs)进行病理分级:(1)G1级:核分裂象数<2/10高倍视野或Ki- 67≤2%;(2)G2级:核分裂象数2~20/10高倍视野或2%
20%[2]。
临床分类:(1)根据有无实验室内分泌检查异常(胰岛素、胃泌素、胰高血糖素)分为功能性和无功能性pNET;(2)根据病灶大小分为直径≤2.0 cm或直径>2.0 cm的pNET;(3)根据有无转移灶,分为有转移和无转移pNET。
CT双期扫描采用西门子64层螺旋CT(Somatom Sensation 64,Forchheim,Germany)及GE宝石CT(Discovery CT750 HD)。西门子64层螺旋CT动脉期扫描参数:管电流/管电压160 mA/120 kV,螺距因子1.5,准直0.6 mm×64,层间距/层厚1.0 mm/0.7 mm,扫描时间动脉期延迟启动扫描方式位于腹主动脉双肾动脉水平团注示踪,触发后5 s启动(阈值100HU)。GE宝石CT扫描参数:管电流/管电压165 mA/ 120 kV,螺距0.984∶1,层间距/层厚 0.742 mm/0.625 mm。增强扫描采用对比剂欧乃派克或优维显70~100 ml,以3.0~5.0 ml/s的流率经肘正中静脉注射。
图像分析所有图像调入GE工作站(Centricity RIS CE V3.0)中进行分析及诊断。由1名工作10年以上腹部放射学专业放射诊断学医师读片决定诊断,采用GE工作站测量软件测量结果并记录。医师记录基于CT图像所得到的影像诊断结果及肿瘤部位、大小及强化方式。强化方式通过测量感兴趣区CT值定义:(1)等密度强化:增强后肿瘤与周围正常胰腺实质CT值差值<10 HU;(2)低密度强化:增强后肿瘤CT值低于周围正常胰腺实质10 HU;(3)高密度强化:增强后肿瘤CT值高于周围正常胰腺实质10 HU;(4)无强化:增强后与平扫同层面肿瘤CT值差值<10 HU[4]。根据临床综合检查结果及手术病理结果对28例患者进行病理分级、功能性及无功能分类、无转移及合并转移分类、病灶直径≤2.0 cm及>2.0 cm分类。
SRS采用双探头(Millennium VG&Hawkeye system,美国GE公司)单光子发射计算机体层摄影(single photon emission computed tomography,SPECT)仪,带有完整的X线透扫系统(低剂量CT,SPECT/CT),配低能高分辨平行孔准直器。静脉注射99Tcm-HYNIC-TOC 350~400 MBq,1、4 h后行全身显像。部分阳性病变区域和可疑病变区域行平面显像或SPECT/CT显像。由工作10年以上核医学专业诊断医师记录基于SRS所见的影像诊断结果及肿瘤部位,胰腺实质内发现SSTR99Tcm-HYNIC-TOC高表达灶为阳性,反之则为阴性。
统计学处理采用SPSS 11.0统计软件,计算CT双期扫描和SRS对功能性pNET、无功能pNET、无转移的pNET、病灶直径≤2.0 cm的pNET诊断敏感性及pNET总的诊断敏感性,采用McNemar检验(确切概率法),P<0.05为差异有统计学意义。
结果
病理及临床分类情况28例患者中,G1级13例,G2级12例,G3级3例。功能性pNET 17例,其中胰岛素瘤11例,胃泌素瘤5例,胰高血糖素瘤1例;无功能性pNET 11例。多发性内分泌腺瘤1型(MEN- 1型)4例,胰岛素增高2例,胃泌素增高2例。28例患者共有33个病灶,其中,19个病灶直径≤2.0 cm,14个病灶直径>2.0 cm。7例出现转移灶,其中肝转移5例(合并肾上腺及骨转移1例),肾转移者1例,胆总管转移者1例。
影像学检查结果
CT双期扫描:pNET的表现为胰腺实质内发现平扫和/或动脉期和/或门脉期高于正常胰腺实质的病灶区。功能性pNET一般体积较小,为境界清晰的实性结节,增强扫描呈边界清楚的明显高于正常胰腺实质的高密度病灶区;无功能性pNET体积较大,为境界清晰的囊实性肿块,可有钙化灶,增强扫描呈实性成分明显高于正常胰腺实质的高密度病灶区,囊性成分无强化。本组28例pNET患者中,26例经CT双期扫描诊断为pNET,其中,17例呈明显高于正常胰腺的均匀强化结节(图1);9例呈不均匀强化结节,表现为中央囊变坏死,边缘呈明显强化高于正常胰腺(图2、3)。1例未发现异常,表现为等密度强化结节;1例诊断为胆总管恶性肿瘤,表现为低密度强化肿块;2例的病理分级均为G1级。
SRS:28例患者中,99Tcm-HYNIC-TOC高表达20例;阴性8例,其中,G1级胰岛素瘤6例,G1级胃泌素瘤1例,G2级未分类无功能pNET 1例。

A.CT平扫,胰腺体部等密度结节,直径约1.1 cm(箭头);B. 增强动脉期病灶呈明显高密度均匀强化(箭头);C. 延时扫描强化程度减弱,呈等密度强化(箭头)
A. CT plain scan reveals an isodense nodule sized 1.1 cm (arrow) in pancreatic body;B.in the arterial phase,lesion was significantly and homogeneously enhanced(arrow);C.in the delayed phase,enhancement of lesion was decreased(arrow)
图 1胰岛素瘤CT图像
Fig 1CT image of insulinoma

pNET:胰腺神经内分泌肿瘤
pNET:pancreas nuroendocrine tumors
A.CT平扫,胰腺钩突部低密度肿块,大小约4.0 cm×3.0 cm(箭头);B.增强动脉期呈不均匀强化,中央液化坏死,无强化,边缘实性成分呈高密度强化(箭头);C.延时扫描病灶边缘呈等密度强化,中央低密度为液化坏死区(箭头)
A.CT plain scan shows a 4.0 cm×3.0 cm hypodense mass in pancreas hook(arrow);B.enhancement is inhomogeneous in arterial phase,with the liquefaction necrosis in center without reinforcement;the solid component in its edge was enhanced(arrow);C. in the delay phare,the edge of lesion was homogeneously enhanced,with the hypodense center being liquefied necrotic(arrow)
图 2无功能pNET的CT图像
Fig 2CT image of non-functioning pNET
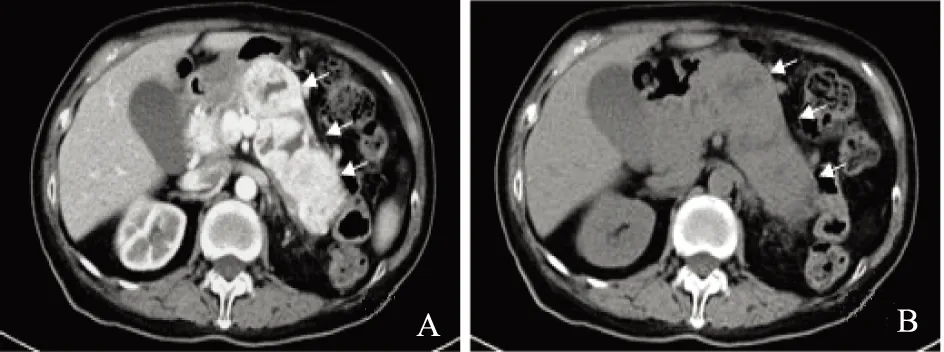
A.CT平扫,胰腺体积增大,体尾部多发低密度肿块,中央见更低密度(箭头);B.增强动脉期肿块呈边缘明显强化,中央液化坏死,无强化(箭头)
A.CT plain scan reveals that the pancreatic volume increased,with multiple hypodense masses in pancreas body and tail, the center showed even lower density(arrow);B.the edge of the lesion was enhanced in arterial phase, the center showed liquefaction and necrosis,but without enhancement(arrow)
图 3多发无功能pNET的CT图像
Fig 3CT image of multi-nonfunctional pNET
CT双期扫描和SRS敏感性的比较CT双期扫描和SRS对pNET患者总的诊断敏感性分别为92.8%(26/28)和71.4%(20/28),差异有无统计学意义(P=0.031)。
功能分类的比较:CT双期扫描和SRS对功能性pNET患者的诊断敏感性分别为94.1%(16/17)和58.8%(10/17),差异无统计学意义(P=0.218);对无功能性pNET患者的诊断敏感性分别为90.9%(10/11)和90.9%(10/11),差异无统计学意义(P=0.740)。
有无转移分类的比较:CT双期扫描和SRS对无转移pNET患者的诊断敏感性分别为90.4%(19/21)和57.1%(12/21),差异无统计学意义(P=0.125);对合并转移pNET患者的诊断敏感性分别为100%(7/7)和100%(7/7)。
病理分级比较:CT双期扫描和SRS对G1级患者的诊断敏感性分别为84.6%(11/13)和53.8%(7/13),对G2级患者的诊断敏感性分别为100%(12/12)和 83.3%(10/12),对G3级患者的诊断敏感性分别为100%(3/3)和100%(3/3)。
病灶大小比较:28例患者共有33个病灶,其中,19个病灶直径≤2 cm,14个病灶直径>2.0 cm。CT双期扫描和SRS对病灶直径≤2.0 cm的pNET诊断敏感性分别为94.7%(18/19)和52.6%(10/19),差异有统计学意义(P=0.008);CT双期扫描和SRS对病灶直径>2.0 cm的pNET诊断敏感性分别为92.8%(13/14)和100%(14/14)。
讨论
本研究比较了多层螺旋CT双期增强扫描与SRS对pNET诊断的敏感性,结果显示,CT双期扫描和SRS对pNET患者总的诊断敏感性分别为92.8%(26/28)和71.4%(20/28),差异有统计学意义(P=0.031)。对功能性pNET患者的诊断敏感性分别为94.1%(16/17)和58.8%(10/17),差异有无统计学意义(P=0.218);对无功能性pNET患者的诊断敏感性分别为90.9%(10/11)和90.9%(10/11),差异有无统计学意义(P=0.740)。对无转移pNET患者的诊断敏感性分别为90.4%(19/21)和57.1%(12/21),差异无统计学意义(P=0.125);对合并转移pNET患者的诊断敏感性分别为100%(7/7)和100%(7/7)。多层螺旋CT双期增强扫描与SRS对G1级患者的诊断敏感性分别为84.6%(11/13)和53.8%(7/13),对G2级患者的诊断敏感性分别为100%(12/12)和 83.3%(10/12),对G3级患者的诊断敏感性分别为100%(3/3)和100%(3/3)。提示CT双期扫描对pNET患者的诊断敏感性高于SRS。
pNET多为富血供肿瘤,增强扫描呈明显强化,强化方式变化较大,从轻度强化到明显强化,均匀强化或不均匀强化,可呈渐进式延时强化,也可呈血管瘤样填充式强化,主要与肿瘤成分不同、有无出血及囊变坏死有关[5]。功能性pNET体积小,多呈实性,CT平扫常呈等低密度,增强扫描时动脉期呈边界清楚的明显高于正常胰腺实质的均匀强化是其特征。无功能性pNET肿瘤体积大,肿瘤内囊变、坏死、钙化多见,增强扫描实性部分明显高于正常胰腺实质强化。
SRS诊断神经内分泌肿瘤的原理是把放射性示踪剂标记的生长抑素类似物奥曲肽引入体内,与肿瘤细胞表面的SSTR特异结合,使肿瘤显像,80%以上胰腺内分泌肿瘤以表达SSTR2为主。部分pNET的SSTR显像结果为假阴性,主要原因包括:(1)肿瘤不表达SSTR,或表达SSTRl和SSTR4;(2)肿瘤虽表达SSTR2,但表达水平低下;(3)肿瘤过小,低于显像仪的分辨率而未能检出。SSTR显像几乎能探查所有直径>2 cm以及30%~75%直径<1 cm的胃泌素瘤[6]。本组病例比较了CT与SRS对pNET直径≤2.0 cm的病灶检出能力,结果显示,SRS诊断敏感性为52.6%(10/19),明显低于CT双期扫描的94.7%(18/19);而对于直径>2.0 cm的pNET病灶,SRS的检出率则为100%,提示SRS诊断pNET的敏感性与肿瘤大小有关。
Sundin等[7]研究发现,由于大部分胰岛素瘤低度表达SSTR2,所以胰岛素瘤诊断敏感性较低(<70%)。本研究SRS诊断pNET的8例漏诊中,6例为胰岛素瘤,推测这是SRS诊断pNET总敏感性低于CT双期扫描的原因之一。此外,有极少部分胰岛素瘤的强化特征为等密度强化甚至低密度强化,其中等强化者为CT检查漏诊的重要原因之一[8]。本组中CT双期扫描的2例漏诊,其中1例即为增强扫描呈等密度强化的胰岛素瘤,1例为低密度强化的无功能性pNET。国内学者赵明等[9]和李冬成等[10]的报道显示,无功能性pNET既可表现为高密度强化,也可为低密度强化。故对于CT双期扫描表现为胰腺等密度强化或低密度强化的结节,诊断需结合临床及实验室相关检查。
国内相关研究显示,不同级别肿瘤动脉期强化程度差别有统计学意义[11- 12]。本研究结果也显示,多层螺旋CT双期增强扫描对G1、G2、G3级患者的诊断敏感性分别为84.6%、100%、100%。推测其原因可能是,肿瘤病理分级越高,恶性程度越高,越易侵犯血管导致肿瘤血供减少,并血行性转移至肝脏及周围组织,从而可提高CT双期扫描诊断pNET敏感性。
对于转移性神经内分泌肿瘤,SRS也会出现受体高表达,故有国外学者认为SRS是转移性神经内分泌肿瘤最敏感的影像学检查[13]。本研究发现,合并转移的pNET,SRS的诊断敏感性较无转移pNET明显提高,说明SRS诊断胰腺转移性内分泌肿瘤优势较为突出。
本研究的局限性在于:样本量较小,G3级仅3例,故尚需要大样本多中心的验证;另外有国内学者认为,对于直径<1 cm的pNET,SRS漏诊率较高[14]。本研究中仅有4例病灶<1.0 cm,未进行具体分类比较,故对于CT双期扫描及SRS发现小pNET (<1.0 cm)的能力比较有待于进一步评估。
综上,本研究结果显示,相对于双期CT扫描,SRS对pNET的诊断敏感性较低,尤其是直径≤2.0 cm的病灶,SRS容易出现假阴性,需同时结合其他影像学检查。CT双期扫描对pNET的影像学表现具有明显特征性,且病理分级越低,与SRS相比优势越明显,更适合于作为pNET术前诊断的影像学方法。
参考文献
[1]曾蒙苏,严福华,周康荣,等. 非功能性胰内分泌肿瘤的螺旋CT表现[J]. 中华放射学杂志,2003,37(6):529- 532.
[2]中华医学会外科学分会胰腺外科学组.胰腺神经内分泌肿瘤治疗指南(2014版) [J].中华消化外科杂志,2014,13(12):919- 922.
[3]Schott M,Kloppel G,Raffel A,et a1. Neuroendocrine neoplasms of the gastrointestinal tract [J].Dtsch Arztebl Int,2011,108(18):305- 312.
[4]Patel BA. Functional morphology of cercopithecoid primate metacarpals [J]. J Hum Evol,2010,58(4):320- 337.
[5]刘宏文,赵心明,刘风霞.无功能胰岛细胞瘤的CT和MRI诊断[J]. 放射学实践,2007,22(12):1326- 1329.
[6]景红丽,李方,杜延荣,等.99Tcm-HYNIC-TOC生长抑素受体显像诊断胰腺神经内分泌肿瘤的临床应用 [J]. 胃肠病学,2008,13(4):198- 199.
[7]Sundin A,Garske U,Odefors H.Nuclear imaging of neuroendocrine tumours [J]. Best Pract Res Clin Endocrinol Metab,2007,21(1):69- 85.
[8]薛华丹,刘炜,孙昊. 多层螺旋CT与内镜超声对胰岛素瘤术前定位诊断的比较研究 [J].中国医学影像学杂志,2009,17(7):272- 275.
[9]赵明,姚小刚,黄雨农,等. 非功能性胰腺神经内分泌肿瘤的CT表现 [J]. 实用放射学杂志,2013,29(5):793- 793.
[10]李冬成,杨莹,丁燕萍,等. 胰腺神经内分泌肿瘤的CT诊断 [J].放射学实践,2014,29(12):1448- 1451.
[11]周延,刘剑羽,朱翔. 胰腺神经内分泌肿瘤多层螺旋CT双期增强扫描特征[J]. 中华放射学杂志,2013,47(3):225- 230.
[12]王静,赵延涛,赵念博,等. 胰腺神经内分泌肿瘤的MSCT表现[J]. 中国医学计算机成像杂志,2014,20(4):339- 343.
[13]Komar G,Kauhanen S,Liukko K,et al.Decreased blood flow with increased metabolic activity:a novel sign of pancreatic tumor aggressiveness [J].Clin Cancer Res,2009,15(17): 5511- 5517.
[14]李荣.胃肠胰腺神经内分泌肿瘤的诊治新进展[C].北京:中华医学会第四届全国内分泌外科学术会议论文集,2008:89- 91.
基金项目:国家自然科学基金(81371608)和卫生公益性行业科研专项项目(201402019、201402001)Supported by the National Nature Sciences Foundation of China(81371608)and the Health Industry Special Scientific Research Project of China(201402019,201402001)
通信作者:薛华丹电话:010- 69155509,电子邮件:bjdanna95@hotmail.com
中图分类号:R814.4
文献标志码:A
文章编号:1000- 503X(2016)03- 0312- 06
DOI:10.3881/j.issn.1000- 503X.2016.03.012
Corresponding author:XUE Hua-danTel:010- 69155509,E-mail:bjdanna95@hotmail.com
(收稿日期:2015- 06- 24)
Comparison of Multislice Spiral CT Dual Phase and Somatosatatin Receptor Scintigraphy in the Diagnosis of Pancreas Neuroendocrine Tumors
WANG Hui1,LI Ping2,PAN Wei-dong2,XUE Hua-dan2
1Department of Radiology,the People’s Hospital of Xinjiang Uygur Autonomous Region,Urumqi 830000,China2Department of Radiology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
ABSTRACT:ObjectiveTo compare the sensitivity of multislice spiral CT dual phase and somatosatatin receptor scintigraphy (SRS) in the diagnosis of pancreas nuroendocrine tumors (pNET). MethodsTotally 28 patients with pathologically confirmed pNET recieved both CT dual phase contrast and SRS and the results were compared. ResultsOf these 28 pNET patients,26 (92.8%) were accurately diagnosed by CT dual-phase scan and 20 (71.4%) by SRS (P=0.031).In the functioning pNET cases,the diagnosis sensitivity of CT dual phase scan and SRS was 94.1% (16/17)and 58.8% (10/17)(P=0.218). In the non-functioning pNET cases,the sensitivity was 90.9% (10/11) and 90.9% (10/11) (P=0.740).Diagnostic sensitivity of CT dual phase scan and SRS for pNET without metastasis was 90.4% (19/21) and 57.1% (12/21) (P=0.125).The sensitivity for pNET with metastasis was 100%(7/7)and 100% (7/7). Corresponding to the pathological grading,the diagnostic sensitivity of CT dual phase scanning and SRS was 84.6% (11/13) and 53.8% (7/13) for G1,100% (12/12) and 83.3% (10/12) for G2,and 100% (3/3) and 100% (3/3) for G3. The diagnostic sensitivity of CT dual phase scan and SRS for pNET with diameter less than or equal to 2.0 cm was 94.7% (18/19) and 52.6% (10/19) (P=0.008). For pNET with diameter more than 2.0 cm,the sensitivity was 92.8% (13/14) and 100% (14/14). ConclusionsCompared with SRS,dual phase CT scan is more sensitive in diagnosing pNET,especially for those in lower pathological stages. For lesions sized less than or equal to 2.0 cm,SRS should be combined with other imaging examinations to minimize false negative results.
Key words:multislice spiral CT,dual phase;somatosatatin receptor scintigraphy;pancreas nuroendocrine tumors
