辣椒素对大细胞肺癌NCI—H460细胞凋亡线粒体的影响
2016-08-01任公平李华洋王书惠佟雷
任公平 李华洋 王书惠 佟雷

摘要:目的 观察辣椒素对人大细胞肺癌NCI-H460细胞线粒体膜电位(Δψm)的影响,探讨其诱导NCI-H460细胞凋亡的线粒体机制。方法 体外培养NCI-H460细胞,采用不同终浓度辣椒素进行处理,以不加辣椒素为对照。MTT法检测NCI-H460细胞增殖反应,计算半数抑制率;分别采用流式细胞术AnnexinV-FITC/PI法、JC-1活细胞染色、免疫荧光和Western blot检测细胞凋亡、ψm、细胞色素C(Cyt c)的分布和线粒体内Cyt c的表达。结果 与对照组比较,辣椒素明显抑制NCI-H460细胞增殖,并诱导NCI-H460细胞凋亡(P<0.05,P<0.01);辣椒素显著降低NCI-H460细胞Δψm、促进Cyt c由线粒体释放至胞浆及降低线粒体内Cyt c的表达(P<0.05)。结论 辣椒素对肺癌NCI-H460细胞增殖具有抑制作用,诱导其凋亡,其机制可能是通过线粒体介导的细胞凋亡途径实现。
关键词:辣椒素;非小细胞肺癌;凋亡;线粒体膜电位;细胞色素C
DOI:10.3969/j.issn.1005-5304.2016.08.018
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)08-0069-05
肺癌是目前最常见的恶性肿瘤,也是发病率和病死率最高的恶性肿瘤。辣椒素是香草酰胺类生物碱,又名辣椒碱,是辣椒属植物红辣椒的活性成分。有研究表明,辣椒素可抑制肝纤维化和诱导食管鳞状细胞癌细胞凋亡[1-2],辣椒素可通过多种途径在体外发挥抗癌作用,如诱导人结肠癌HCT116细胞和
胰腺癌BxPC-3细胞凋亡[3-4],抑制小细胞肺癌细胞H69和H82增殖[5]。本研究前期实验表明,辣椒素可降低人大细胞肺癌NCI-H460细胞侵袭能力,同时应用Hoechst33342核染色分析也证实,辣椒素可诱导NCI-H460细胞凋亡[6]。为进一步探讨辣椒素诱导NCI-H460细胞凋亡的可能机制,本实验观察辣椒素对NCI-H460细胞线粒体膜电位(mitochondrial membrane potential,Δψm)的影响,探讨其诱导NCI-H460细胞凋亡的线粒体机制。
1 实验材料
1.1 细胞株
人大细胞肺癌NCI-H460细胞,中国科学院上海细胞库。
1.2 药物及配制
辣椒素(纯度>99%,美国Sigma公司),溶解于二甲基亚砜(DMSO),配制成储备液,-20 ℃冰箱保存,临用时以完全培养液稀释到所需浓度。
1.3 主要试剂与仪器
RPMI-1640培养基,美国HyClone;MTT、DMSO、牛血清白蛋白(BSA),美国Sigma;AnnexinV-FITC/PI试剂盒,南京凯基生物科技发展有限公司;JC-1检测试剂盒、抗细胞色素C(Cyt c)小鼠单克隆抗体、FITC标记山羊抗小鼠IgG二抗和ECL化学发光试剂,美国Santa Cruz;线粒体抽提试剂盒,德国美天旎生物技术有限公司;荧光显微镜(BX51T-32P01-FLB3),日本OLYMPUS;CO2培养箱(MCO-20AIC),日本SANYO;流式细胞仪(FACSCalibur),美国BD;酶标仪(GENios Pro),瑞士TECAN;紫外可见分光光度计(UV-2800),美国UNICO;凝胶成像系统(ChemiDox XRS),美国Bio-RAD。
2 实验方法
2.1 细胞培养
NCI-H460细胞保存在含有10%BSA RPMI-1640营养培养基,37 ℃、5%CO2及饱和湿度下培养。当NCI-H460细胞达80%融合时,用0.05%胰蛋白酶/0.02%EDTA消化。按照1×106个细胞/孔的密度接种于超低吸附6孔板中,37 ℃、5%CO2及饱和湿度下培养48 h。收集悬浮的细胞,经EDTA处理制备成单细胞悬液,然后用RPMI-1640培养液洗涤细胞。收集对数生长期细胞,备用。
2.2 MTT法检测NCI-H460细胞增殖
取对数生长期NCI-H460细胞,按照1×106个细胞/孔的密度接种于96孔板中,37 ℃、5%CO2及饱和湿度下培养过夜。次日,根据预实验结果,每孔加入0(对照组)、100、200、300、400、500、600 ?mol/L不同终浓度的辣椒素,每组设6个平行孔。将培养板置于37 ℃、5%CO2及饱和湿度下分别培养24、48 h,每孔加入MTT溶液(5 g/L)20 ?L,37 ℃继续培养4 h,终止培养,小心吸弃孔内培养上清液,然后每孔加入DMSO 150 ?L,振荡10 min,使结晶物充分溶解,于酶标仪波长570 nm处,以空白培养液调零点,测定OD值,取6孔平均值,计算抑制率[(对照组OD值-实验组OD值)÷对照组OD值×100%]。计算半数抑制率(IC50)。
2.3 流式细胞仪检测细胞凋亡
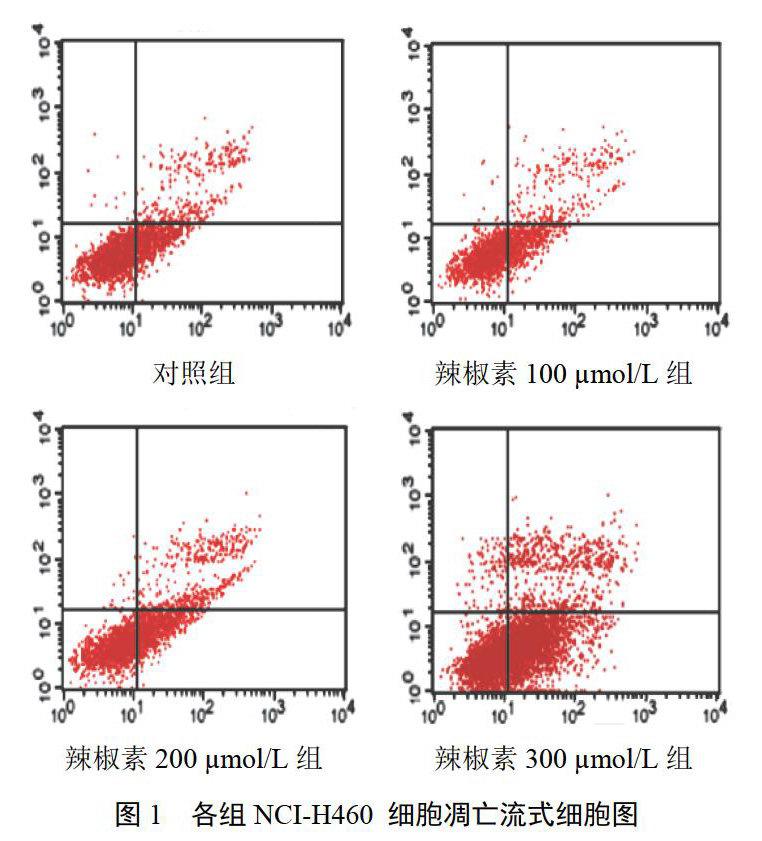
取对数生长期NCI-H460细胞,实验组细胞100、200、300 ?mol/L辣椒素处理,37 ℃、5%CO2及饱和湿度下培养24 h,对照组除未加辣椒素外,其余条件与实验组完全一致。1200 r/min离心5 min,收集细胞,1 mL PBS冲洗2次,然后加1倍上样缓冲液490 μL混匀。最后加入50 μg/mL Annexin V-FITC和PI液各5 μL,37 ℃、5%CO2及饱和湿度下培养60 min,FACSCalibur流式细胞仪检测NCI-H460细胞凋亡。每组设6个平行孔。
2.4 线粒体膜电位检测
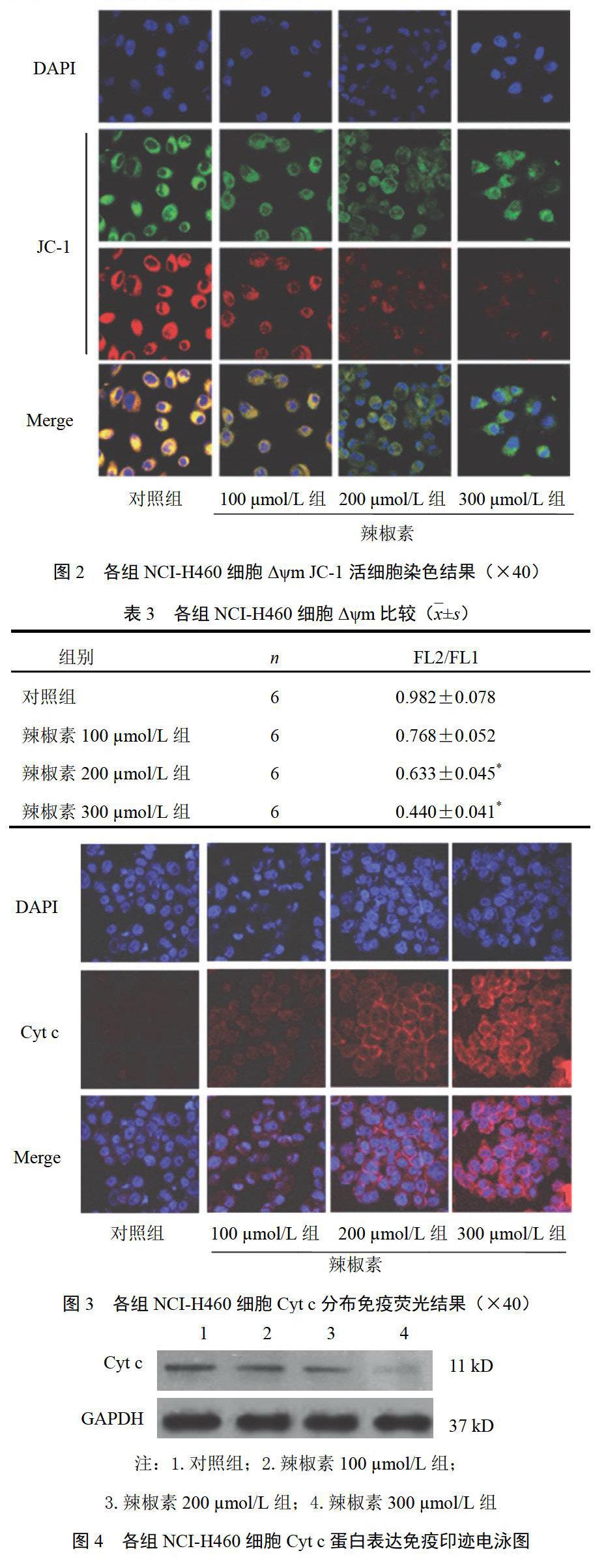
取对数生长期NCI-H460细胞,实验组细胞100、200、300 ?mol/L辣椒素处理,37 ℃、5%CO2及饱和湿度下培养24 h,对照组除未加辣椒素外,其余条件与实验组完全一致。1200 r/min离心5 min,收集细胞,1 mL PBS冲洗2次,加入2 μL JC-1液,37 ℃、5%CO2及饱和湿度下培养130 min。以LSM510 META激光共聚焦显微镜按照JC-1Δψm检测试剂盒说明书步骤测量荧光信号。按照JC-1不同形式所发射的荧光不同,以红色/绿色荧光比值(FL2/FL1)表示Δψm的变化。Image J软件计算FL2/FL1。每组测量6次。
2.5 免疫荧光检测
取对数生长期NCI-H460细胞,实验组细胞100、200、300 ?mol/L辣椒素处理,37 ℃、5%CO2及饱和湿度下培养24 h,对照组除未加辣椒素外,其余条件与实验组完全一致。待细胞爬满爬片,取出,PBS冲洗2次,3.7%低聚甲醛固定30 min,PBS冲洗2次,5%BSA室温封闭15 min,0.2%TritonX-100处理15 min,然后与抗Cyt c小鼠单克隆抗体(1∶50稀释)一起于37 ℃、5%CO2及饱和湿度下培养1 h。PBS冲洗2次,加入FITC 标记山羊抗小鼠IgG二抗(1∶400稀释),37 ℃、5%CO2及饱和湿度下培养30 min,DAPI处理10 min,LSM510 META激光共聚焦显微镜观察荧光信号。每组设6个平行孔。
2.6 Western blot检测
取对数生长期NCI-H460细胞,将实验组细胞用终浓度为100、200、300 ?mol/L辣椒素,37 ℃、5%CO2及饱和湿度下培养24 h,对照组除未加辣椒素外,其余条件与实验组完全一致。将NCI-H460细胞线粒体与胞浆分离,提取线粒体。线粒体提取过程严格按照线粒体抽提试剂盒说明操作。Bradford法测定蛋白质含量。取20 ?g蛋白质加入2×上样缓冲液,95 ℃变性5 min。随后进行7.5%SDS-PAGE凝胶电泳。电泳后,电转至0.45 ?m硝酸纤维素膜,用含5%脱脂奶粉PBST(25 mmol/L Tris pH 7.5,150 mmol/L NaCl,0.1%Tween20)封闭1 h,加入抗Cyt c小鼠单克隆抗体(1∶100稀释)4 ℃孵育过夜,PBST洗涤3次×5 min。加入FITC标记山羊抗小鼠IgG二抗(1∶800稀释)室温孵育2 h,PBST洗涤3次×5 min。按相同方法与GAPDH抗体孵育。ECL试剂显色,Bio-Rad凝胶成像系统检测线粒体内Cyt c的表达。
3 统计学方法
采用Graphpad5.0统计软件进行分析。正态计量资料数据以—x±s表示,组间比较采用t检验。P<0.05表示差异有统计学意义。
4 结果
4.1 辣椒素对NCI-H460细胞增殖的影响
不同浓度(100、200、300、400、500、600 ?mol/L)辣椒素分别作用于NCI-H460细胞24 h和48 h,随终浓度的增大和作用时间的延长,其对细胞的抑制率也明显增强,呈浓度和时间依赖性,600 ?mol/L辣椒素组细胞抑制率略有下降;200、300、400、500、600 ?mol/L辣椒素组24、48 h OD值与对照组比较,差异有统计学意义(P<0.05,P<0.01)。辣椒素作用NCI-H460细胞24、48 h的IC50分别为366.2、328.9 ?mol/L。结果见表1。
4.2 辣椒素对NCI-H460细胞凋亡的影响
辣椒素终浓度为200、300 μmol/L时,与对照组比较,NCI-H460细胞凋亡率显著增高,差异有统计学意义(P<0.05),并呈浓度依赖性;辣椒素终浓度为100 μmol/L时,与对照组比较,NCI-H460细胞凋亡率差异无统计学意义(P>0.05)。结果见图1、表2。
4.3 辣椒素对NCI-H460细胞线粒体膜电位的影响
辣椒素终浓度为200、300 μmol/L时,出现明显红绿荧光变化。与对照组比较,FL2/FL1显著减小,Δψm降低(P<0.05),并呈浓度依赖性;辣椒素终浓度为100 μmol/L时,与对照组比较,FL2/FL1差异无统计学意义(P>0.05)。结果见图2、表3。
4.4 辣椒素对NCI-H460细胞色素C分布的影响
对照组NCI-H460细胞胞浆内仅见微弱的荧光信号;辣椒素终浓度为200、300 μmol/L时,胞浆内出现明显增强的荧光信号。与对照组比较,Cyt c分布差异有统计学意义(P<0.05),并呈浓度依赖性;辣椒素终浓度为100 μmol/L时,与对照组比较,Cyt c分布差异无统计学意义(P>0.05)。结果见图3。
4.5 辣椒素对NCI-H460细胞色素C蛋白表达的影响
辣椒素终浓度为200、300 μmol/L时,与对照组比较,线粒体内Cyt c蛋白表达显著降低(P<0.05),并呈浓度依赖性;辣椒素终浓度为100 μmol/L时,与对照组比较,Cytc蛋白表达差异无统计学意义(P>0.05)。结果见图4、图5。
3.辣椒素200 ?mol/L组;4.辣椒素300 ?mol/L组
5 讨论
本研究结果发现,辣椒素对NCI-H460细胞增殖有一定抑制作用,提示辣椒素可作为抗非小细胞肺癌的潜在药物。同时本研究流式细胞术再次证实,辣椒素可诱导NCI-H460细胞凋亡。细胞凋亡是由一系列复杂的信号传导通路和基因调控的一种生理性死亡过程,对保持自身平衡十分重要,肿瘤的生长速率很难控制,这与凋亡能力的减弱和增殖能力的提升密切相关[7]。多种抗肿瘤药物如青蒿琥酯、高三尖杉酯碱等均能诱导细胞凋亡[8-9]。目前发现,细胞凋亡途径主要有线粒体途径、死亡受体途径和内质网途径,其中线粒体途径和死亡受体途径为诱导细胞凋亡的主要途径[10]。线粒体是凋亡信号转导途径中起关键调节作用的细胞器,在凋亡过程中有重要的调控作用,其Δψm是反映线粒体内膜通透性的最佳指标之一[11]。
Cyt c是一种水溶性小分子物质,位于线粒体中,是线粒体呼吸链的重要组成部分,在细胞凋亡中发挥重要作用,是最早被发现的线粒体释放的促凋亡蛋白[12]。Δψm的破坏被认为是细胞凋亡级联反应过程中最早发生的事件之一[13]。当Δψm降低后,线粒体膜肿胀、通透性增高,Cyt c从内膜脱落出来并释放到胞质中,与凋亡蛋白酶激活因子及Caspase-9前体相互作用,形成复合物,激活下游的效应Caspase,从而诱导凋亡[14]。
本研究发现,在辣椒素诱导NCI-H460细胞凋亡的过程中,也检测到Δψm的平行下降,表明辣椒素诱导NCI-H460细胞凋亡可能与Δψm有关。以上结果初步提示,辣椒素诱导NCI-H460细胞凋亡可能是通过线粒体介导的细胞凋亡途径实现的。
为了进一步证实在辣椒素诱导NCI-H460细胞凋亡过程中是否有Cyt c由线粒体释放至胞浆,本研究采用免疫荧光和Western blot分析相结合的方法检测Cyt c的分布和表达。结果发现,NCI-H460细胞胞浆Cyt c荧光强度显著增强,线粒体内Cyt c表达显著降低。以上结果提示,在辣椒素诱导NCI-H460细胞凋亡过程中确实存在Cyt c由线粒体释放至胞浆,参与诱导凋亡。
综上所述,辣椒素具有明显抑制NCI-H460细胞增殖的作用,诱导其凋亡,其诱导NCI-H460细胞凋亡机制可能是通过线粒体介导的细胞凋亡途径实现的。至于Caspase-9是否参与此过程,本研究将做进一步探讨。
参考文献:
[1] 俞富祥,朱千东,余正平,等.辣椒素抑制大鼠肝纤维化的实验研究[J].中国病理生理杂志,2014,30(1):91-95.
[2] 田芳,江亚南,张晓艳,等.辣椒素对食管鳞状细胞癌细胞凋亡和NF-кB信号通路相关蛋白表达的影响[J].郑州大学学报(医学版),2013,48(4):437-440.
[3] JIN J, LIN G, HUANG H, et al. Capsaicin mediates cell cycle arrest and apoptosis in human colon cancer cells via stabilizing and activating p53[J]. Int J Biol Sci,2014,10(3):285-295.
[4] PRAMANIK K C, BOREDDY S R, SRIVASTAVA S K. Role of mitochondrial electron transport chain complexes in capsaicin mediated oxidative stress leading to apoptosis in pancreatic cancer cells[J]. PLoS One,2011,6(5):e20151.
[5] KATHLEEN C, BROW N, TED R, et al. Capsaicin displays anti-proliferative activity against human small cell lung cancer in cell culture and nude mice models via the E2F pathway[J]. PLoS One,2010,5(4):e10243.
[6] 任公平,吕正鑫,刘宏扬,等.辣椒素对人大细胞肺癌NCI-H460细胞侵袭能力及E-钙黏蛋白、Snail表达的影响[J].中国中医药信息杂志, 2015,22(8):55-58.
[7] 邵淑丽,刘锐,隋文静,等.大蒜素诱导结肠癌HT-29细胞凋亡[J].基因组学与应用生物学,2015,34(2):227-233.
[8] 赵艳,李丽华,赵颂.青蒿琥酯抑制人头颈部鳞状细胞癌增殖及诱导凋亡的机制[J].天津医药,2015,43(9):974-978.
[9] 赵雨辰,杨明珍.高三尖杉酯碱对急性单核细胞白血病SHI-1细胞株诱导凋亡机制的研究[J].安徽医科大学学报,2014,49(8):1080-1084.
[10] 刘盛楠,邵淑丽,王维熠,等.川楝素诱导人肺癌A549细胞凋亡[J].中国细胞生物学学报,2015,37(8):1087-1094.
[11] 吴雪,陈义虎,姜春阳,等.PBDE-47对人神经母细胞瘤细胞凋亡和线粒体膜电位及细胞色素C蛋白表达的影响[J].环境与健康杂志,2012, 29(8):675-678.
[12] 周永华,范红结,许永良,等.慢性弓形虫感染对大鼠海马神经细胞凋亡周期及caspase-3与细胞色素C蛋白表达的影响[J].中国血吸虫病防治杂志,2010,22(3):264-267.
[13] 齐一鸣,黄俊琪.2型登革病毒通过线粒体途径诱导EA.hy926细胞凋亡[J].中国病理生理杂志,2013,29(3):385-389.
[14] 王立宏,武兴斌,王利,等.银杏叶提取物对非小细胞肺癌PC-9细胞增殖的影响[J].中国中医药信息杂志,2015,22(5):65-68.
