化瘀降浊汤对转化生长因子—β1/母系同源物家族信号通路相关蛋白的影响
2016-08-01尹学来宋竖旗庞然吕济源卢建新
尹学来 宋竖旗 庞然 吕济源 卢建新
摘要:目的 观察化瘀降浊汤对转化生长因子(TGF)-β1诱导HK-2细胞发生上皮间质转分化(EMT)过程TGF-β/母系同源物家族Smad通路中关键因子E-钙黏蛋白(E-cadherin)、Smad3、蜗形蛋白(Snail)的影响,探讨其保护肾功能的作用机制。方法 MTT法测定不同浓度化瘀降浊汤对TGF-β1诱导HK-2的细胞增殖抑制率,计算半数抑制率(IC50)。Western blot和RT-PCR检测E-cadherin、Smad3、Snail蛋白和基因表达,间接免疫荧光检测E-cadherin蛋白表达。结果 化瘀降浊汤在一定浓度范围内抑制TGF-β1诱导的HK-2细胞增殖,呈现出一定的量效关系,IC50为472.017 μg/mL。Western blot和RT-PCR检测结果显示,化瘀降浊汤中、高剂量组E-cadherin、Smad3、Snail蛋白和mRNA表达与诱导组比较,差异有统计学意义(P<0.05,P<0.01);免疫荧光检测结果显示,化瘀降浊汤能促进E-cadherin蛋白表达,与Western blot分析结果一致。结论 化瘀降浊汤可能通过调节HK-2细胞TGF-β/Smad信号途径中的关键蛋白达到抑制甚至逆转肾小管EMT,从而对肾小管间质纤维化起到保护作用。
关键词:HK-2细胞;上皮间质转化;化瘀降浊汤;E-钙黏蛋白;Smad3;蜗形蛋白
DOI:10.3969/j.issn.1005-5304.2016.08.015
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)08-0054-05
尿路梗阻性疾病引起的肾实质损害称为梗阻性肾病,对于泌尿外科而言,引起梗阻性肾损害主要原因为上尿路结石,梗阻性肾病发展为终末期肾病的关键病理变化为肾间质纤维化。上皮间质转分化(epithelial-mesenchymal transition,EMT)是启动和维持肾间质纤维化的关键机制[1]。转化生长因子-β(TGF-β)/母系同源物家族(Smads)信号通路是调节EMT和肾间质纤维化的关键信号通路。前期研究表明,益气活血类中药能明显改善可复性单侧输尿管部分梗阻大鼠模型的的梗阻肾侧及总肾的肾小球滤过率(GFR)水平[2]。本实验观察化瘀降浊汤对TGF-β1诱导HK-2细胞发生EMT过程中的TGF-β/Smads关键信号通路蛋白E-钙黏蛋白(E-cadherin)、Smad3、蜗形蛋白(Snail)的影响,探讨其保护肾功能的作用机制。
1 实验材料
1.1 细胞
人近端肾小管上皮细胞株HK-2细胞,北京中医药大学东直门医院柴立民教授惠赠。
1.2 药物及制备
化瘀降浊汤(黄芪30 g,丹参30 g,桃仁30 g,莪术20 g,红花10 g)饮片均购自康美药业。将上述剂量的5倍中药一半置于煎煮容器内,以10倍剂量的双蒸水浸泡30 min,煮沸2 h,过滤药渣倒出药液,将另一半中药用10倍剂量乙醇煎煮,煎沸2 h,过滤药渣倒出药液,合并2次滤液。置于旋转蒸发器内,旋转蒸发制成膏剂、然后取出,置于真空干燥箱干燥48 h,将干燥的固体研磨成粉剂,用培养液分别配制成所需的浓度,然后滤器过滤,分装至50 mL离心管中保存。
1.3 主要试剂与仪器
DMEM/F12(Invitrogen),胎牛血清(Hyclone),Anti-E-cadherin抗体、Anti-Smad3抗体、Anti-Snail抗体(abcam),Goat Anti-rabbit IgG、HRP-linked Antibody(CST),High Capacity RNA-to-cDNA Kit、E-cadherin探针、GAPDH探针、Smad3探针、Snail探针(Life Tech),免疫染色一抗稀释、免疫染色二抗稀释液、免疫染色封闭液、DAPI(碧云天),Trioton-100(索莱宝),FITC标记山羊抗兔IgG(碧云天),TaqMan Gene Expression Master Mix(Life Tech),Trizol Reagent(Invitrogen),MTT(Sigma),重组人TGF-β1(pepro tech),胰酶(杭州吉诺)。6、96孔细胞培养板(美国corning),PHS-2F酸度计(上海雷磁仪器厂),MCO-18AIC细胞培养箱(日本SANYO),DZF-6020真空干燥箱(上海-恒科技有限公司),RE52-05旋转蒸发器(上海亚荣生化仪器),SIAFRT SYNERGYHT多功能酶标仪、nanodrop超微量分光光度计(美国Thermo Scientific),2020冰点渗透压仪(美国ADVANCED),Bio-Rad电泳仪(美国Bio-Rad),Immobilon-P Transfer Membrane(美国Millipore),ChemiDoc XRS凝胶成像系统(美国Bio-Rad),Applied Biosysterns 7500 Real-Time PCR Systems(美国ABI)。
2 实验方法
2.1 药液pH值和渗透压测定
将MTT试验中最大剂量1920 μg/mL药液用酸度计及冰点渗透压仪器测定3次,取其平均值,结果显示pH值为7.385±0.015,渗透压为289.673±2.057,两者均在正常范围内。
2.2 MTT法检测HK-2细胞抑制率
参照文献[3-4],采用10 ng/mL TGF-β1诱导HK-2细胞24 h可发生EMT。因此,本实验采用的药物作用时间为24 h。取对数生长期HK-2细胞,胰酶消化液消化后用DMEM/F12培养液制成单细胞悬液,调整浓度为1×104个/mL,每孔200 μL接种于96孔板,分为8组,均加200 μL含有10 ng/mL TGF-β1的培养液,于培养箱内常规培养24 h,分为8种不同浓度化瘀降浊汤培养基,使药物终浓度为0、30、60、120、240、480、960、1920 μg/mL,每种浓度设5个平行孔,放入培养箱中培养24 h后取出,每孔加5 mg/mL的MTT溶液10 μL,继续培养4 h,吸出上清,每孔加150 μL二甲基亚砜,在摇床上慢速振荡10 min,于酶标仪波长490 nm处测定OD值,计算细胞抑制率。细胞抑制率(%)=1-(给药组OD值-调零孔OD值)÷(空白组OD值-调零孔OD值)×100%。计算化瘀降浊汤IC50的浓度。
2.3 Western blot检测HK-2细胞蛋白表达
根据MTT实验结果,将对数生长期HK-2细胞分为5组,正常组加3 mL正常培养液,其余4组加3 mL含10 ng/mL TGF-β1培养液,24 h后吸出培养基,正常组更换正常培养液,诱导组换为含10 ng/mL TGF-β1培养液,中药低剂量组换为含10 ng/mL TGF-β1+化瘀降浊汤250 μg/mL培养液,中药中剂量组换为含10 ng/mL TGF-β1+化瘀降浊汤500 μg/mL培养液,中药高剂量组换为含10 ng/mL TGF-β1+化瘀降浊汤1000 μg/mL培养液。24 h后吸出培养基,磷酸盐缓冲液(PBS)洗涤1次,无酶细胞消化液消化细胞后用RIPA提取总蛋白,BCA法蛋白定量,10%SDS-聚丙烯凝胶电泳分离,转移到聚偏二氟乙烯膜上,脱脂奶粉封闭膜1 h,加一抗(E-cadherin、Smad3、Snail稀释倍数为1∶5000),4 ℃孵育过夜,洗涤缓冲液清洗3次×10 min,加二抗(稀释倍数为1∶8000),37 ℃孵育1 h,于Bio-Rad成像仪中加ECL显影剂,Bio-Rad系统下曝光成像。应用Imag J对蛋白条带进行灰度分析。计算相对光密度(OD)值[(处理组目标蛋白OD值/处理组内参蛋白OD值)÷(空白组目标蛋白OD值/空白组内参蛋白OD值)]。
2.4 免疫荧光检测E-钙黏蛋白表达
5组细胞按上述方法在6孔板中培养24 h后吸出培养基,PBS洗涤1次,4%多聚甲醛室温固定10 min,PBS冲洗3次×5 min,0.1%TritonX-100孵育10 min,PBS冲洗3次×5 min。免疫染色封闭液室温封闭1 h,吸出封闭液不洗,加入E-cadherin一抗(浓度为1∶200),4 ℃过夜冲洗3次×10 min,加入FITC标记山羊抗兔IgG(浓度为1∶100),室温避光孵育1 h,PBS冲洗3次×10 min,DAPI室温染色5 min,吸出,PBS冲洗3次×5 min。每孔各加入100 μL PBS和抗荧光淬灭封片液1滴,于高内涵细胞成像系统下拍照成像。
2.5 RT-PCR检测HK-2细胞基因表达
5组细胞按上述方法培养24 h后吸出培养基,PBS洗涤1次,用Trizol从细胞中提取总RNA,用nanodrop测定RNA浓度,然后反转录为cDNA。用nanodrop测定cDNA浓度。变性:95 ℃、5 min;扩增:95 ℃、10 s,60 ℃、20s。50个循环;溶解:95 ℃、10 s,60 ℃、10 s;冷却:40 ℃、30 s。同步进行对照管家基因GAPDH的定量检测,采用2-ΔΔCT法计算基因表达量。
3 统计学方法
采用SPSS18.0统计软件进行分析。实验数据以—x±s表示,采用方差分析,满足正态性和方差齐性时,两两比较用LSD法,方差不齐用Dunnett's法。P<0.05表示差异有统计学意义。
4 结果
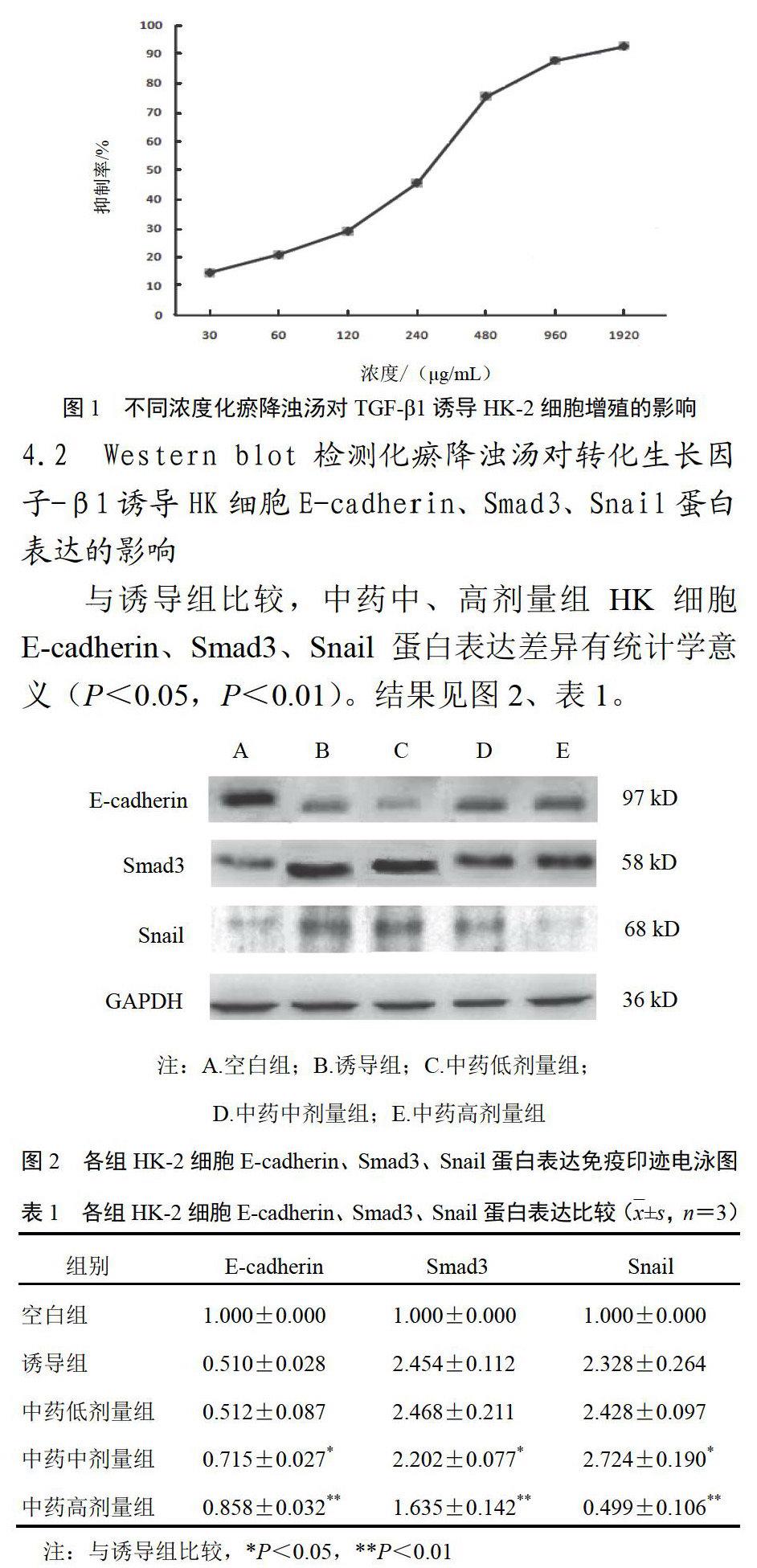
4.1 化瘀降浊汤对转化生长因子-β1诱导HK-2细胞增殖的影响
化瘀降浊汤能抑制TGF-β1诱导的HK-2细胞增殖,并随浓度的增加抑制率也相应增加,结果见图1。根据统计结果得出IC50为472.017 μg/mL,为便于计算中剂量取500 μg/mL,低剂量为250 μg/mL,高剂量为1000 μg/mL。根据实验结果分为5组。空白组不加任何药物;诱导组:10 ng/mL TGF-β1;中药低剂量组:10 ng/mL TGF-β1+250 μg/mL化瘀降浊汤;中药中剂量组:10 ng/mL TGF-β1+500 μg/mL化瘀降浊汤;中药高剂量组:10 μg/mL TGF-β1+1000 μg/mL化瘀降浊汤。
4.2 Western blot检测化瘀降浊汤对转化生长因子-β1诱导HK细胞E-cadherin、Smad3、Snail蛋白表达的影响
与诱导组比较,中药中、高剂量组HK细胞E-cadherin、Smad3、Snail蛋白表达差异有统计学意义(P<0.05,P<0.01)。结果见图2、表1。
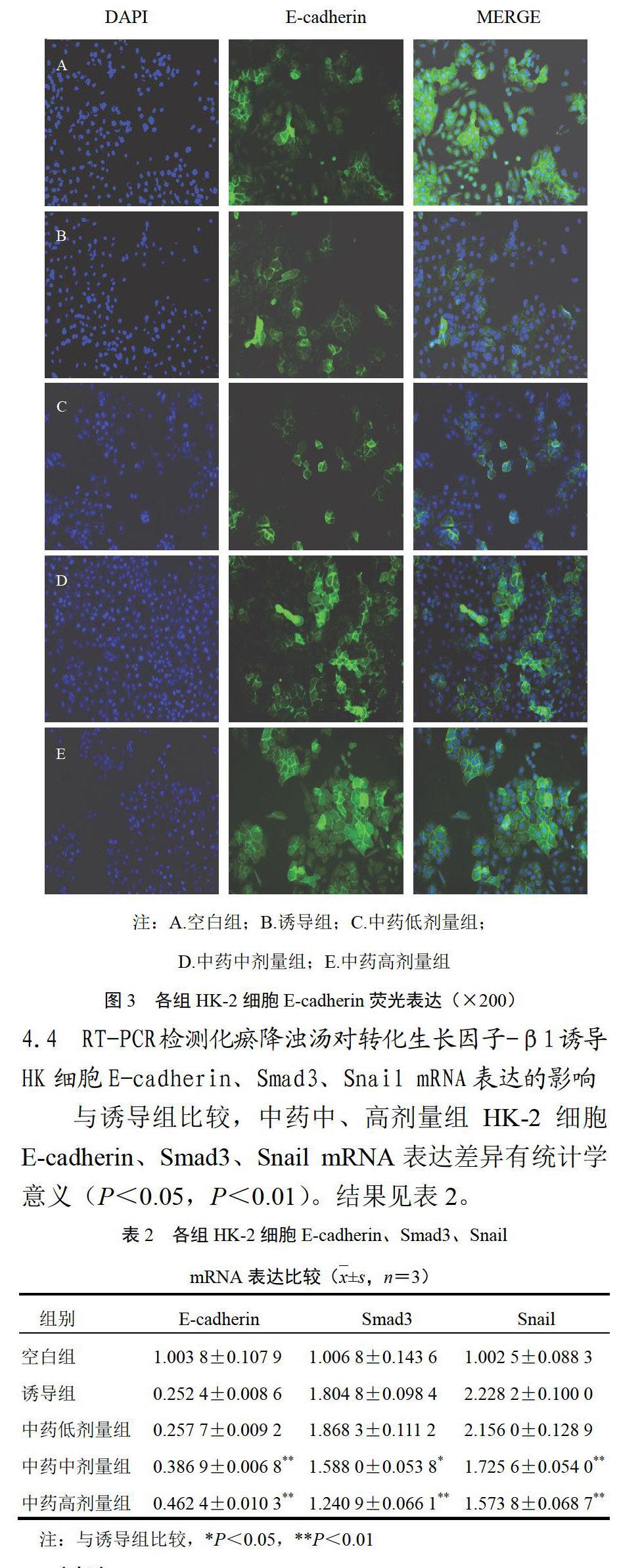
4.3 间接免疫荧光检测化瘀降浊汤对转化生长因子-β1诱导HK细胞E-cadherin、Smad3、Snail蛋白表达的影响
E-cadherin在HK-2细胞中表达较多,加入TGF-β1诱导后表达量减少,一定浓度的化瘀降浊汤作用后能够增加E-cadherin蛋白的表达,与Western blot结果一致,见图3。
4.4 RT-PCR检测化瘀降浊汤对转化生长因子-β1诱导HK细胞E-cadherin、Smad3、Snail mRNA表达的影响
与诱导组比较,中药中、高剂量组HK-2细胞E-cadherin、Smad3、Snail mRNA表达差异有统计学意义(P<0.05,P<0.01)。结果见表2。
5 讨论
对于泌尿系结石引起的机械性梗阻而言,一般只重视解除梗阻取出结石,而忽略了解除梗阻后对肾功能的进一步保护,临床上由此导致肾单位隐性丢失的情况较为常见。肾小管-间质的损伤是各种原因所致进行性肾脏病进展的决定因素,而肾间质纤维化是各种慢性肾脏疾病进展至终末期肾衰的共同特征。EMT在肾间质纤维化过程中成纤维细胞的产生起着重要作用[5]。TGF-β能诱导并维持EMT[6],而TGF-β/Smad通路是研究EMT的经典通路,由于TGF-β能增加E-cadherin相关抑制转录因子的表达,从而引起E-cadherin表达量减少。E-cadherin减少使细胞容易失去极性而与周围细胞分离,因此其丢失被视为EMT的起始。Snail是含有锌指结构的一类核转录因子,能与人类的钙黏蛋白启动子上的3种E-box结合,抑制E-cadherin转录[7]。Smad3磷酸化后进入细胞核内能够活化EMT过程中相关基因的表达,目前关于Smad3的具体机制还不清楚,但Smad3能够促进纤维化的看法是明确的。Smad3基因敲除后的小鼠能够保护肾组织通过TGF-β介导的肾间质纤维化[8]。目前有研究认为,肾小管上皮细胞早期发生的EMT可以逆转[9-10]。因此,研究中药对TGF-β/Smad通路的影响有助于了解其保护肾功能的具体微观机制。
中国中医科学院广安门医院著名中西医结合泌尿外科奠基人刘猷枋教授自20世纪60年代起开展中医药对上尿路结石及结石引起梗阻性肾病的研究。临床上采用化瘀尿石汤治疗上尿路结石。临床和实验研究表明,化瘀尿石汤治疗上尿路结石(气滞血瘀型)具有提高排石率、改善梗阻积水、减少复发率等作用;并可减少硝酸铀酞所致大鼠肾损害模型的肾小管萎缩灶数及肾间质纤维增生程度[11]。刘猷枋主任根据古代中医典籍认识、梗阻性肾病的临床表现及西医病理特点,认为该病病机总属气虚血瘀,在此病机认识基础上,宏观辨证与微观辨证相结合,确立了益气活血、降浊祛湿的治疗原则,并在化瘀尿石汤基础上酌减破气破血之品,增加了益气燥湿的力量,组成化瘀降浊汤。方中黄芪、丹参、莪术、桃仁、红花均有抑制肾小管上皮细胞转分化的作用[12-15]。
本实验结果表明,通过诱导组与空白组对比,TGF-β1能诱导HK-2细胞发生EMT,化瘀降浊汤能抑制HK-2发生EMT后的细胞增殖,呈现出一定的量效关系。Western blot、RT-PCR检测结果显示,化瘀降浊汤能增加TGF-β1诱导后的HK-2细胞E-cadherin蛋白和基因表达、减少Smad3、Snail蛋白和基因表达,三者随剂量的增加,表达强度随之发生变化,呈现出一定的量效关系,间接免疫荧光测定E-cadherin蛋白表达与Western blot结果一致。而E-cadherin、Smad3、Snail是TGF-β/Smad信号途径中的关键蛋白,表明化瘀降浊汤可能是通过调节HK-2细胞中的TGF-β/Smad信号途径中的关键蛋白达到抑制甚至逆转肾小管EMT,进而对肾小管间质纤维化起到保护作用,从而实现保护肾功能的目的。
参考文献:
[1] IWANO M, PLIETH D, DANOFF T M, et al. Evidence that fibroblasts derive from epithelium during tissue fibrosis[J]. The Jounal of Clinical Investigation,2002,110(3):341-350.
[2] 石世华,张亚强,卢建新,等.益气活血中药对大鼠梗阻肾功能保护的实验研究[J].北京中医药,2010,29(12):942-944.
[3] YANG L, MA X, CHENG T, et al. Effect of Tangnaikang on TGF-β1 induced transdifferentiation of human renal tubular epithelial HK-2 cells[J]. Journal of Traditional Chinese Medicine,2013, 33(3):388-393.
[4] 陈芳,成芳,项倩彤,等.肾小管上皮-间质细胞转分化模型的建立[J]. 安徽医科大学学报,2013,48(6):595-600.
[5] KALLURI R, NEILSON E G. Epithelial-mesenchymal transition and its implications for fibrosis[J]. Journal of Clinical Investigation,2003,112(12):1776.
[6] MIETTINEN P J, EBNER R, LOPEZ A R, et al. TGF-beta induced transdifferentiation of mammary epithelial cells to mesenchymal cells:involvement of type Ⅰ receptors[J]. The Journal of Cell Biology,1994,127(6):2021-2036.
[7] BATLLE E, SANCHO E, FRANCL C, et al. The transcription factor snail is a repressor of E-cadherin gene expression in epithelial tumour cells[J]. Nature Cell Biology,2000,2(2):84-89.
[8] KELLENBERGER T, KRAG S, DANIELSENC C, et al. Differential effects of Smad3 targeting in a murine model of chronic kidney disease[J]. Physiological Reports,2013,1(7):181.
[9] OHNUKI K, UMEZONO T, ABE M, et al. Expression of transcription factor Snai1 and tubulointerstitial fibrosis in progressive nephropathy[J]. J Nephrol,2012,25(2):233-239.
[10] ZEISBERG M, KALLURI R. The role of epithelial-to-mesenchymal transition in renal fibrosis[J]. Journal of Molecular Medicine, 2004,82(3):175-181.
[11] 石世华.大鼠输尿管部分梗阻模型的建立及益气活血中药对梗阻肾的干预作用[D].北京:中国中医科学院,2007.
[12] AHN Y M, KIM S K, LEE S H, et al. Renoprotective effect of Tanshinone IIA, an active component of Salvia miltiorrhiza, on rats with chronic kidney disease[J]. Phytotherapy Research,2010, 24(12):1886-1892.
[13] 王文文,程锦国.温莪术对大鼠肾间质纤维化的保护作用及其机制研究[J].中华中医药学刊,2014,32(1):144-146.
[14] 李小波,边壮,兰萍,等.桃仁对单侧输尿管梗阻大鼠肾小管上皮细胞转分化的影响[J].中国实验方剂学杂志,2011,17(13):189-191.
[15] YANG Y L, CHANG S Y, TENG H C, et al. Safflower extract:A novel renal fibrosis antagonist that functions by suppressing autocrine TGF-beta[J]. Journal of Ccellular Biochemistry,2008,104(3):908-919.
