MTBDRplus在初治2个月末涂阳肺结核治疗中的应用*
2016-07-31黄富礼周祖模黄何清金嘉琳
黄富礼,周祖模,刘 伟,孙 峰,黄何清,吴 刚,金嘉琳△
(1.西南医科大学附属医院感染科,四川泸州 646000;2.浙江诸暨市人民医院感染科,311800;3.杭州市疾病预防控制中心,310021;4.复旦大学附属华山医院感染科,上海200040)
MTBDRplus在初治2个月末涂阳肺结核治疗中的应用*
黄富礼1,周祖模2,刘 伟3,孙 峰4,黄何清2,吴 刚1,金嘉琳4△
(1.西南医科大学附属医院感染科,四川泸州 646000;2.浙江诸暨市人民医院感染科,311800;3.杭州市疾病预防控制中心,310021;4.复旦大学附属华山医院感染科,上海200040)
目的 运用分子线性探针技术(MTBDRplus)对2个月末涂片阳性的初治肺结核患者进行快速耐药检测及个体化治疗指导,并观察其预后。方法 选择基线及2个月末痰涂片仍为阳性的初治肺结核患者随机分两组,分别予以传统直接观察(或面视)下的短程化疗(Directly Observed Treatment +short course chemotherapy,DOTs)方案及分子药敏指导治疗,并比较预后。结果 在分子药敏指导治疗组中成功率,完全敏感的为74.4%,单耐异烟肼为87.5%,单耐利福平100.0%,耐多药结核75.0%;DOTs方案组中,成功率为单耐异烟肼25.0%,单耐利福平耐和耐多药结核均为0.0%。两组预后χ2分析显示差异有统计学意义(P=0.044)。结论 MTBDRplus应用在2个月末涂阳初治肺结核患者中可改善预后。
结核,肺;分子探针技术;预后;MTBDRplus;初治,2个月末涂阳
WHO评估了全球新发耐多药结核(multiple drug resistant tuberculosis,MDR-TB)病患者的数量,其中超过50%的患者分布在3个国家,即印度、中国和俄罗斯[1]。中国耐多药结核病在初治与复治中的发病率分别为5.7%和25.6%[2],而目前只有18.0%的初治患者和9.0%的复治患者实施标准的抗痨方案[3]。传统药敏试验耗时很长和生物安全性要求高等缺点,限制了其在临床的应用。无药敏结果的DOT(directly observed treatment)和DOTs(directly observed treatment +short course chemotherapy)结核治疗方案可能是耐多药甚至是广泛耐药结核发生的原因之一[4]。快速检测结核分支杆菌耐药性已成为2011~2015年全球结核病伙伴关系计划的重要组成部分[5]。运用分子线性探针技术(MTBDRplus)和MTBDRsl快检测MDR-TB和广泛耐药结核(extensively drug-resistant tuberculosis,XDR-TB)并指导其治疗可以显著提高复治结核患者第6个月痰培养转阴率[6]。课题组前期研究表明在2个月末凃阳的患者中,其耐药发生率及治疗失败率明显高于涂阴患者[7]。所以有必要对2个月末仍凃阳的患者进行个体化指导治疗。
1 资料与方法
1.1 一般资料 选取浙江省诸暨市人民医院2011年2月到2013年1月(包括随访的6个月时间)就诊并完成治疗疗程的430例基线涂片阳性的痰标本,经常规治疗2个月后痰涂片仍然阳性的初治患者77例,按照患者发现的顺序依次编号,根据编号的顺序及其对应的分组号进行分组。试验组与对照组,其中试验组为线性探针快速药敏检测组,根据分子药敏结果调整治疗方案,对照组为传统的DOTs方案(无药敏结果的治疗方案)。结核菌的分离培养在诸暨市人民医院临床实验室进行,结核菌的鉴定及传统药敏实验在浙江省杭州市疾病预防控制中心进行,结核菌的快速分子检测在复旦大学附属华山医院感染科实验室进行。伦理学审查在华山医院伦理审查委员会表决通过。
1.2 纳入标准 年龄18岁以上。排除标准:恶性肿瘤患者,HIV感染,吸毒史,复治患者,非结核分枝杆菌感染,肝硬化,慢性肾能衰竭和血糖控制不佳者。采集所有患者的人口学数据。
1.3 预后判定、药敏检测及治疗方案调整 治疗结果分类根据WHO结核治疗指南进行[8]。所有对照组患者菌株的传统药敏均在随访结束后统一进行检测。参照中国防痨协会1995 年制定的结核病诊断细菌学检验规程[9],以对硝基苯甲酸/噻吩-2-羧酸肼(PNB/TCH)试验进行菌群鉴定,药敏试验采用世界卫生组织推荐的比例法。结核菌DNA的提取及MTBDRplusPCR扩增,根据DNA抽提试剂盒及MTBDRplus说明书进行操作。所有检测在8 h内完成,包括rpoB基因检测及耐异烟肼热点突变基因katG和inhA。治疗方案的调整,参考WHO及中国耐药结核治疗指南进行调整[10-11]。初治患者前2个月按照2HREZ/4HR方案进行治疗,2个月末涂片阳性的患者如果入组快速分子药敏检测指导治疗组则根据检测结果调整方案其中单耐异烟肼调整为3REZLfx/6RELfx;利福平耐药调整为 3HEZLfx/9HELfx;耐多药结核调整6ZKmLfxCsPAS/12ZLfxCsPAS(R:利福平;E:乙胺丁醇;Z:吡嗪酰胺;Lfx:左氧氟沙星;Cs:环丝氨酸;PAS:对氨基水杨酸)。
1.4 统计学处理 所有分析均使用SPSS17.0统计软件进行,计数资料以率表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 细菌耐药情况 2011年2月至2013年1月,总计有430例基线痰涂片阳性患者纳入本研究,其中除去复治、迁出者、非结核分枝杆菌(nontuberculous mycobacteria,NTM)、合并肿瘤者、不愿意加入本试验者、2个月末涂片阴性者,最终有77例初治且2个月末涂阳的患者入组。按照2∶1的比例进行随机分组,其中试验组有52例患者,包括全敏感患者39例,单耐异烟肼(isoniazid,H)8例,单耐利福平(rifampin,R)1例及MDR-TB 4例;对照组25例,包括全敏患者18例,单耐H 4例,单耐R 1例及MDR-TB 2例。见图1。
HRR:耐药;s:敏感。
图1 治疗流程图
2.2 入组患者人口学特点 试验组患者中男性占76.9%,55岁及以上患者为57.7%,76.9%患者为浙江本地人,65.4%的患者有肺部空洞,86.5%患者有合并症,51.9%患者为小学及以下文化程度,59.6%的患者基线痰涂片结核菌载量大于++;对照组中男性为80.0%,55岁及以上患者为36.0%,80.0%患者为浙江本地人,68.0%患者有空洞,80.8%患者有合并症,60.0%患者为小学及以下文化程度。通过对两组患者研究变量进行χ2分析(Fisher确切概率法),研究变量包括性别、年龄、籍贯、是否有空洞、BMI值、受教育程度、是否有合并症、基线痰菌载量、耐异烟肼及耐利福平的情况,发现对照组与试验组其变量分布差异无统计学意义,见表1。
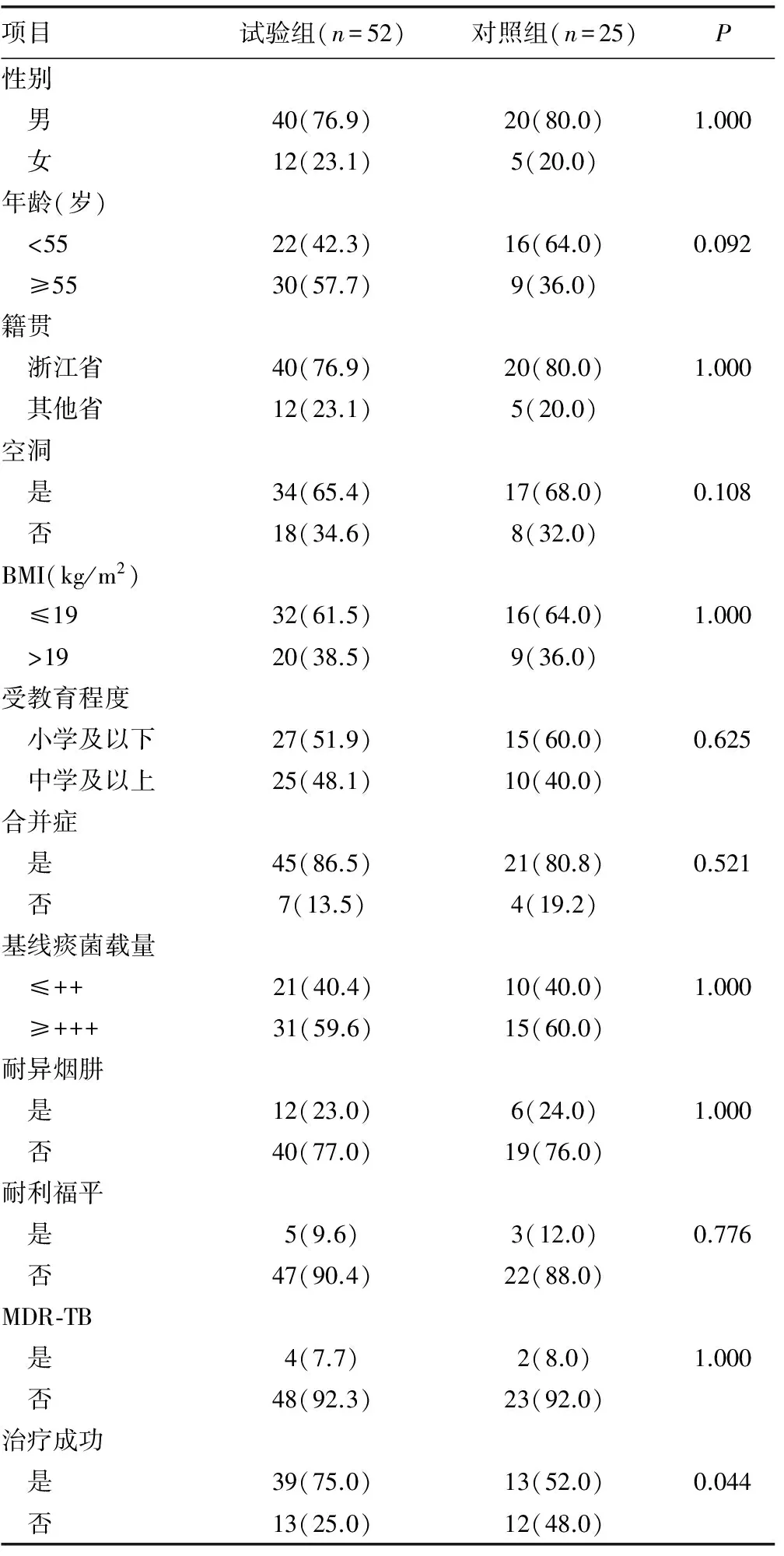
表1 两组变量分析[n(%)]
2.3 MTBDRplus结果 检测结果提示试验组与对照组发生耐药基因突变的菌株共20株,其中试验组有13例发生突变,对照组有7例发生突变。其中rpoB基因突变较少,且位点较分散。单独出现该基因突变的有2例,单独katG和(或)inhA基因突变的有12例, rpoB联合katG和(或)inhA突变6例,katG基因突变位点都集中在其MUT1位点,inhA基因突变的有2例。所有耐药基因 (rpoB、katG、inhA) 突变位点分布情况见表2、3。

表2 分子药敏指导治疗组MTBDRplus 结果
-:该基因没有发生突变或缺失;Δ:其对应的基因有缺失;ΔWT8:WT8位点的基因有缺失,表明有耐药发生;MUT:对应的位点有基因的突变,也代表有耐药发生。
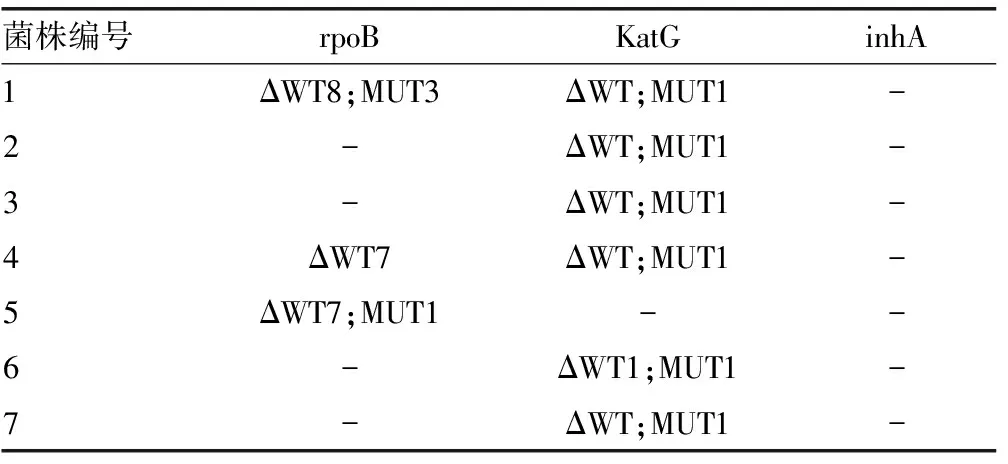
表3 传统药敏指导治疗组MTBDRplus结果
-:该基因没有发生突变或缺失;Δ:其对应的基因有缺失;ΔWT8:WT8位点的基因有缺失,表明有耐药发生;MUT:对应的位点有基因的突变,也代表有耐药发生。
2.4 治疗结果 在分子药敏指导治疗组中,治疗成功率依次为全敏感患者74.4%,单耐异烟肼87.5%(7/8),单耐利福平100.0%,MDR-TB 75.0%;在传统DOTs治疗组中,治疗成功率依次为单耐异烟肼25.0%,单耐利福平0%,MDR-TB 0%。卡方分析显示,在全部敏感患者中,分子药敏指导组与传统组比较其治疗结果没有显著差异(P=0.54),而在单耐异烟肼和(或)利福平组中其治疗结局差异有统计学意义(P=0.017),见图2。分子药敏指导治疗组与传统治疗组其预后有差异有统计学意义(P=0.044),见图3。
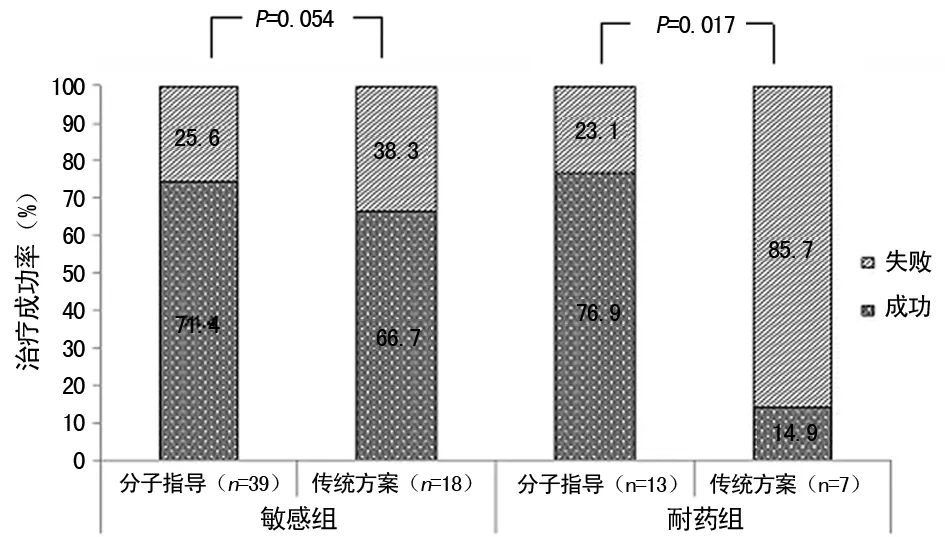
图2 分子药敏及传统DOTs方案治疗组敏感者与耐药者成功率比较

图3 分子药敏组与传统DOTs方案组总治疗成功率比较
3 讨 论
耐药结核是影响结核控制的重要因素[12-13]。初治结核标准方案中强化期为2个月,如果在2个月末未获得较好的痰涂片阴转率可能导致较差的治疗结局[14],所以本研究选择了初治2个月末痰抗酸染色仍为阳性的患者进行研究 。18个月时间内所有初治且2个月末涂阳的患者共77例,卡方分析提示两组患者研究变量分布均匀,具有可比性。其中有52例患者入组分子药敏指导治疗组,25例患者入组传统方案治疗组。分子药敏指导治疗组中有8例单耐异烟肼,1例单耐利福平,及4例MDR-TB。25例传统DOTs治疗组中有4例单耐异烟肼,2例耐多药结核。其总耐多药患者比例为7.8%(6/77),高于我国初治结核耐多药5.7%的平均发病率[2],同时单耐利福平的有两例,占2.6%。单独的rpoB基因突变较少,一般是伴随有katG或(和)inhA的突变,故WHO从2010年即推荐用快速分子药敏检测rpoB基因来早期发现MDR-TB患者。MTBDRplus结果显示, rpoB 基因突变主要集中在ΔWT7 (526-529 code)、ΔWT3/4MUT1 (531-539 code和ΔWT8MUT3 (530-533 code),位点较分散,而katG 基因突变主要集中在 Δ WT,MUT1 (codon 315),且占异烟肼总的耐药基因突变的88.9% (16/18),inhA 基因突变仅有2例患者,均为 ΔWTMUT1 (-15 code),这与利福平及异烟肼突变好发位点有关,利福平rpoB基因突变位点范围较广,而异烟肼的katG基因突变主要就集中在315密码子。 分子药敏指导治疗组成功率高于传统DOTs治疗组,χ2分析其预后差异有统计学意义(P=0.044),其中在全敏患者中,分子药敏指导组与传统组预后没有显著差异,而在单耐H和(或)R组中有统计学意义(P=0.017)。而两组内MDR-TB预后比较无统计学意义,这可能与耐药结核患者样本量偏少有关。
在分子药敏指导治疗的13例耐药患者(8例单耐异烟肼,1例单耐利福平,4例MDR-TB)中有10例患者治愈。调整方案为单耐异烟肼及利福平者改用左氧氟沙星,其中单耐异烟肼患者疗程为9个月(3REZLfx/6RELfx),单耐利福平者为12个月(3HEZLfx/9HELfx)。对于MDR-TB患者则改用6PASLfxZKmCs/12 PASLfxZCs。在这些耐药患者中,8例异烟肼单耐患者,有7例治疗成功,1例失败(在治疗过程因肺结核导致呼吸衰竭死亡),这例患者为78岁男性,因服用胃肠道药物不良反应明显,依从性不好,治疗效果不佳,在治疗第3月死亡,这与多数耐药产生及治疗失败的原因类似[15]。因为药物不良反应导致患者不能坚持服药,依从性相对较差,从而又诱发新的耐药,最终导致治疗失败。1例利福平单耐患者为38岁男性,尽管肺部有空洞,但更改治疗方案后治疗成功。4例MDR-TB患者中,平均年龄为32.5岁,最大55岁,最小18岁,其中3例治疗成功,1例失败。传统药敏治疗组中,2例MDR-TB患者及1例单耐利福平的患者均治疗失败。
MTBDRplus能快速检测出耐药结核,用于指导初治肺结核治疗可以改善2个月末涂片仍阳性的患者预后。
本研究的不足之处为仅选择2个月末仍涂阳且为初治患者作为入组条件,大多数初治患者经正规抗结核治疗2个月后痰菌一般会阴转,同时因为在初治患者中耐药结核发生率相对较低,所以入组样本量较少,而能调整治疗方案的患者相对更少。
[1]Zumla A,George A,Sharma V,et al.The WHO 2014 global tuberculosis report--further to go[J].The Lancet Global Health,2015,3(1):e10-e12.
[2]Zhao Y,Xu S,Wang L,et al.National survey of drug-resistant tuberculosis in China[J].N Engl J Med,2012,366(23):2161-2170.
[3]Xue He G,Van Den Hof S,Van Der Werf MJ,et al.Inappropriate tuberculosis treatment regimens in Chinese tuberculosis hospitals[J].Clin Infect Dis,2011,52(7):e153-e156.
[4]Pillay M,Sturm AW.Evolution of the extensively drug-resistant F15/LAM4/KZN strain of Mycobacterium tuberculosis in KwaZulu-Natal,South Africa[J].Clin Infect Dis,2007,45(11):1409-1414.
[5]WHO.The global plan to stop TB 2011-2015:transforming the fight towards elimination of tuberculosis[OL].http://www.stoptb.org/assets/documents/global/plan/TB_GlobalPlanToStopTB2011-2015.pdf.
[6]Vasylieva I,Samoilova A,Larionova E,et al.Impact of rapid diagnostics of M.tuberculosis drug resistance by GenoType MTBDRplusGenoType MTBDRsl (Hain Lifescience GmbH,Germany) on efficacy of treatment of MDR/XDR TB patients[C]//American Thoracic Society 2012 International Conference, May 18-23, 2012·San Francisco, California. 2012.
[7]Huang FL,Jin JL,Chen S,et al.MTBDRplusresults correlate with treatment outcome in previously treated tuberculosis patients[J].Int J Tuberc Lung Dis,2015,19(3):319-325.
[8]World Health Organization.Treatment of tuberculosis:guidelines-4th ed[Z],2009.
[9]中国防痨协会.结核病诊断细菌学检验规程[J].中国防痨杂志,1996,18(3):127-134.
[10]肖和平.耐药结核化学治疗指南[M].北京:人民卫生出版社,2011:30-45.
[11]Falzon D,Jaramillo E,Schünemann HJ,et al.WHO guidelines for the programmatic management of drug-resistant tuberculosis:2011 update[J].Eur Respir J,2011,38(3):516-528.
[12]Kliiman K,Altraja A.Predictors of poor treatment outcome in multi- and extensively drug-resistant pulmonary TB[J].Eur Respir J,2009,33(5):1085-1094.
[13]Leimane V,Dravniece G,Riekstina V,et al.Treatment outcome of multidrug/extensively drug-resistant tuberculosis in Latvia,2000-2004[J].Eur Respir J,2010,36(3):584-593.
[14]Kurbatova EV,Cegielski JP,Lienhardt C,et al.Sputum culture conversion as a prognostic marker for end-of-treatment outcome in patients with multidrug-resistant tuberculosis:a secondary analysis of data from two observational cohort studies[J].Lancet Respir Med,2015,3(3):201-209.
[15]Yang X,Yuan Y,Pang Y,et al.The burden of MDR/XDR tuberculosis in coastal plains population of China[J].PLoS One,2015,10(2):e0117361.
The application of MTBDRplusin treatment new tuberculosis for smear positive at the end of two months*
HuangFuli1,ZhouZumo2,LiuWei3,SunFeng4,HuangHeqing2,WuGang1,JinJialin4△
(1.AffiliatedHospitalofSouthwestMedicalUniversity,Luzhou,Sichuan646000,China; 2.ZhujiPeople′sHospital,Zhuji,Zhejiang311800,China;3.DiseaseControlandPreventionCenter,Hangzhou,Zhejiang310021,China;4,HuashanHospital,FudanUniversity,Shanghai,200040,China)
Objective Individualize treatment new tuberculosis patients whose smear positive at the end of two months after treatment by MTBDRplusand describe the treatment outcomes among patients in Zhejiang province.Methods We prospectively enrolled sputum smear positive at the end of two months after treatments.For two groups,one group
World Health Organization recommended initial treatment regimen[without DST(Drug sensitivity test) results],the other treatment according to the results of molecular line-probe assay(GenoType MTBDRplus).Treatment responses were monitored using sputum smear,culture and chest radiography.Results The success rate of totally sensitive patients were 74.4%,87.5% single resistant to isoniazid,rifampin resistant single 100% and MDR-TB 75% in MTBDRplusmolecular susceptibility guidance treatment group;in the conventional treatment group,the success rate of treatment were 25% single resistant to isoniazid,rifampin resistant 0% single and MDR-TB 0%.Chi square analysis showed that,molecular susceptibility guide therapy group and traditional therapy group and its prognosis is statistically significant (P=0.044).Conclusion Molecular line-probe assay(MTBDRplus)improved the initial treatment of smear positive at the end of two months after treatment tuberculosis patients prognosis.
tuberculosis,pulmonary;molecular probe techniques;prognosis; MTBDRplus;new treatment,smear positive at the end of two months
10.3969/j.issn.1671-8348.2016.34.013
四川省泸州市科技局资助项目[2014-s-45(7/12)];西南医科大学附属第一医院博士基金(14047)。 作者简介:黄富礼(1976-),主治医师,博士,主要从事耐药结核及不明原因发热的诊治。△
,E-mail:jinjialin@fudan.edu.cn。
R453.9
A
1671-8348(2016)34-4791-04
2016-04-18
2016-06-06)
