银杏叶提取物对MPTP诱导帕金森小鼠保护作用的研究
2016-07-29李金凤徐桂梅张辰子代路路邝少松
李金凤,徐桂梅,张辰子,费 帆,杨 林,代路路,孙 侠,邝少松
(1.广东省医学实验动物中心,广东 佛山 528248;2.增城市妇幼保健院,广东 增城 511300)
银杏叶提取物对MPTP诱导帕金森小鼠保护作用的研究
李金凤1,徐桂梅2,张辰子1,费帆1,杨林1,代路路1,孙侠1,邝少松1
(1.广东省医学实验动物中心,广东 佛山528248;2.增城市妇幼保健院,广东 增城511300)
【摘要】目的观察银杏叶提取物(ginkgo biloba extract,GBE)对1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导不同年龄段的帕金森(parkinson’s disease,PD)小鼠的防治作用。方法将8周龄及32周龄各60只C57BL/6小鼠随机分为阴性组,模型组,GBE给药高、中、低剂量组及阳性组,采用腹腔注射MPTP法制备PD动物模型,采用银杏叶提取物进行灌胃治疗。运用爬杆、悬挂和游泳实验检测小鼠肢体运动功能,采用分光光度法测定小鼠脑组织超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量,采用免疫组化法观察小鼠大脑黑质酪氨酸羟化酶(TH)及纹状体多巴胺转运蛋白(DAT)阳性细胞数目的变化。结果(1)与阴性对照组比较,8周龄模型组小鼠运动功能得分、大脑GSH-Px活性、黑质TH阳性细胞及纹状体DAT阳性细胞平均光密度值均显著下降,脑组织MDA含量显著升高,说明PD模型复制成功。与模型组比较,银杏叶提取物给药组8周龄小鼠运动功能得分、SOD与GSH-Px活性、黑质TH阳性细胞平均光密度值均显著提高,MDA含量显著下降。(2)与阴性对照组比较,32周龄模型组小鼠运动功能得分、黑质TH阳性细胞以及纹状体DAT阳性细胞平均光密度值均显著下降,SOD与GSH-Px活性降低,脑组织MDA含量升高,说明模型复制成功。与模型组比较,银杏叶提取物给药组32周龄小鼠运动功能得分、SOD活性、黑质TH及纹状体DAT阳性细胞平均光密度值均显著提高,脑组织MDA含量显著下降。结论银杏叶提取物对MPTP诱导的不同年龄段PD小鼠有一定的防治作用。
【关键词】银杏叶提取物;帕金森病;MPTP;氧化应激;神经元
帕金森病(parkinson’s disease,PD)是一种慢性神经系统退行性疾病,以中脑黑质多巴胺能神经元选择性丢失为特征,进而导致纹状体多巴胺水平降低,引发一系列典型症状如震颤、肌肉强直和运动障碍等[1]。银杏叶提取物 (ginkgo biloba extract,GBE)主要有效成分为黄酮类和萜类内酯化合物,药理研究表明它具有很好的神经保护作用[2-3]。本实验以MPTP制备不同年龄段的PD小鼠模型,观察银杏叶提取物对模型小鼠学习记忆能力、抗氧化作用、黑质TH阳性神经元和纹状体DAT阳性神经纤维变化的影响,探讨银杏叶提取物对MPTP诱导的不同年龄段的帕金森模型小鼠神经元保护的作用机制,为开发具有抗PD作用的天然药物提供科学依据。
1材料和方法
1.1实验动物
SPF级C57BL/6雄性小鼠,8周龄60只,体重18~22 g,32~36周龄60只,体重27~33g,由广东省医学实验动物中心提供【SCXK(粤) 2013-0002】,饲养在广东省医学实验动物中心SPF级动物实验室【SYXK(粤)2013-0002】。实验开始时,把8周龄及32周龄各60只小鼠随机分为阴性组,模型组,银杏叶提取物给药高、中、低剂量组,阳性对照组6个组,每个年龄每组各10只。每日观察动物一般状态表现并记录动物行为变化,每周记录小鼠的体重。
1.2仪器与试剂
生物组织自动染色机(孝感宏业医用仪器有限公司);石蜡切片机(德国Leica公司);荧光病理图像分析系统(日本Olympus公司);全波长酶标仪(美国Thermfisher公司);台式高速离心机(德国Eppendorf股份有限公司);银杏叶提取物滴剂(德国威玛舒培博士药厂);美多芭(多巴丝肼片)(上海罗氏制药有限公司);1-甲基-4-苯基-1,2,3,6-四氢吡啶MPTP(广州春岚生物制品有限公司);多聚甲醛(天津市福晨化学试剂厂);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)试剂盒(南京建成生物工程有限公司);其余试剂均为国产市售分析纯。
1.3预处理及治疗给药方法
银杏叶给药组给予GBE灌胃治疗,给药浓度分别为高剂量组60 mg/kg、中剂量组40 mg/kg、低剂量组20 mg/kg[3-4]。阳性药物对照组小鼠灌胃给予美多芭,给药浓度为75 mg/kg[5],模型组与阴性对照组小鼠灌胃生理盐水。各组均按照0.1 mL/10g体重给药,1次/d,连续12 d。从灌胃治疗第8天起进行造模给药,各组均于MPTP造模给药后30 min内完成灌胃治疗。
1.4造模给药方法
采用腹腔注射MPTP的方法制备动物模型。GBE给药组、阳性药物对照组及模型组给予MPTP(30 mg/kg)[6]腹腔注射,注射量为0.1 mL/10g,1次/d连续7 d,制备PD小鼠模型,阴性组给予生理盐水腹腔注射。
1.5行为学检查
1.5.1爬杆试验
将一直径为25 cm的软木小球固定于一根长50 cm粗1 cm的木杆顶端,木杆上缠上纱布以防打滑,然后将被测小鼠放到小球上,并记录小鼠从小球上下来、小鼠爬完杆子上半部分、小鼠爬完杆子下半部分各段所用时间,然后按以下标准记分:3 s内完成上述某一动作的记3分;6 s内完成的记2分;超过6 s的记1分。每只小鼠测5次,每次检测间隔3 min,记录每只小鼠总得分情况,并作统计学分析。
1.5.2悬挂实验
将小鼠悬挂于一水平电线上,如小鼠用两后爪抓住电线则记3分,如用一后爪抓住电线则记2分,如果小鼠两后爪均抓不住电线则记1分,每只小鼠测5次,每次检测间隔3 min,最后记录每只小鼠总得分情况,并作统计学分析。
1.5.3游泳试验
将受试小鼠放入一个20×30×20 cm规格的水箱中,水温为32~35℃,评分标准如下:在受试时间2 min内能连续不断游泳者记3分,大部分时间游泳仅偶尔漂浮者记2.5分,漂浮时间占整个受试时间50%以上者记2分,偶尔游泳者记1.5分,偶尔用后肢游动并漂浮在一边者记1分。每只小鼠测3次,每次检验间隔3 min,最后计算总得分情况,并作统计学分析。
1.6氧化应激指标检测
行为检测后,采用脱颈法迅速断头取脑,玻璃匀浆器制成10%脑组织匀浆,-80℃保存备用。实验时用Bradford法定量蛋白,按试剂盒说明检测脑组织中SOD、GSH-Px活性及MDA含量。
1.7免疫组织化学检测
行为学检测后各组小鼠断头处死,迅速取出大脑,一半迅速放入4%多聚甲醛中固定,常规制备石蜡切片,用于免疫组织化学染色;一半仔细分离皮层和海马,-80℃保存,用于免疫组织化学检测黑质TH阳性神经元和纹状体DAT阳性神经纤维的变化。用低倍和高倍镜观察切片,阳性细胞为镜下组织细胞结构清晰、细胞内有棕黄色沉着、染色明显高于背景的细胞,用OLYMPUS BX41显微镜拍照。用HMIAS-2000高清晰度彩色医学图文分析系统分析TH、DAT的平均光密度值。
1.8 统计方法
2结果
2.1小鼠行为学表现
小鼠注射MPTP后立刻出现全身震颤、竖毛、尾僵直、步态不稳、活动能力减弱等症状,8周龄小鼠持续20~30 min后逐渐减轻,32周龄小鼠持续50~60 min后逐渐减轻,两组年龄段的小鼠24 h后基本恢复正常。随着给药次数的增加,上述各种急性反应表现基本无太大变化,但24 h后32周龄小鼠活动能力减弱、四肢僵硬、反应迟缓的表现越来越明显。
2.2小鼠肢体运动功能测定结果
如表2所示,与阴性对照组比较,两个年龄段的模型组小鼠爬杆、悬挂和游泳实验得分均显著降低(P<0.05),提示造模成功。在爬杆实验中,8周龄GBE给药组与阳性对照组、32周龄GBE低剂量组与阳性对照组小鼠的肢体协调能力均明显提高(P<0.05,P<0.01);在悬挂实验中,两个年龄段的GBE高剂组小鼠的悬挂能力均明显增强(P<0.05,P<0.01);在游泳实验中,8周龄GBE低剂量组与阳性对照组小鼠游泳得分显著提高(P<0.01),32周龄GBE低剂量组、GBE中剂量组及阳性对照小鼠游泳得分显著提高(P<0.05)。
2.3小鼠脑组织SOD、GSH-Px活性和MDA含量测定结果
如表3所示,与阴性对照组比较,8周龄模型组小鼠的GSH-Px活性显著降低(P<0.01),MDA含量明显升高(P<0.05)。与模型组比较,8周龄GBE低剂量组小鼠GSH-Px活性显著升高(P<0.05),MDA含量降低,但没有统计学意义;8周龄GBE中剂量组、阳性对照组小鼠SOD、GSH-Px活性均显著升高(P<0.05,P<0.01),而MDA含量明显降低(P<0.05,P<0.01)。32周龄GBE中剂量组小鼠SOD、GPSH-Px活性有不同程度的提升,MDA含量明显降低(P<0.01);32周龄GBE高剂量组小鼠SOD活性显著提高(P<0.05),MDA含量明显降低(P<0.01)。
2.4小鼠大脑黑质TH、纹状体DAT的表达,
2.4.1黑质TH的表达结果
如表4所示,与阴性对照组比较,两个年龄段模型组小鼠大脑黑质TH平均光密度值均显著降低(P<0.01),TH阳性细胞数显著减少(图1B、图1H)。与模型组比较,8周龄GBE给药组、阳性对照组小鼠大脑黑质TH平均光密度值均显著升高(P<0.05,P<0.01),TH阳性细胞数目显著增加(图1C-1F);32周龄GBE高剂量组小鼠大脑黑质TH平均光密度值显著升高(P<0.01),TH阳性细胞数显著增加(图1L),32周龄GBE低剂量组、GBE中剂量组及阳性对照组TH光密度值有所增加,但无统计学意义,TH阳性细胞数较模型组多(图1I-1K)。
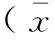
±s)
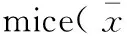
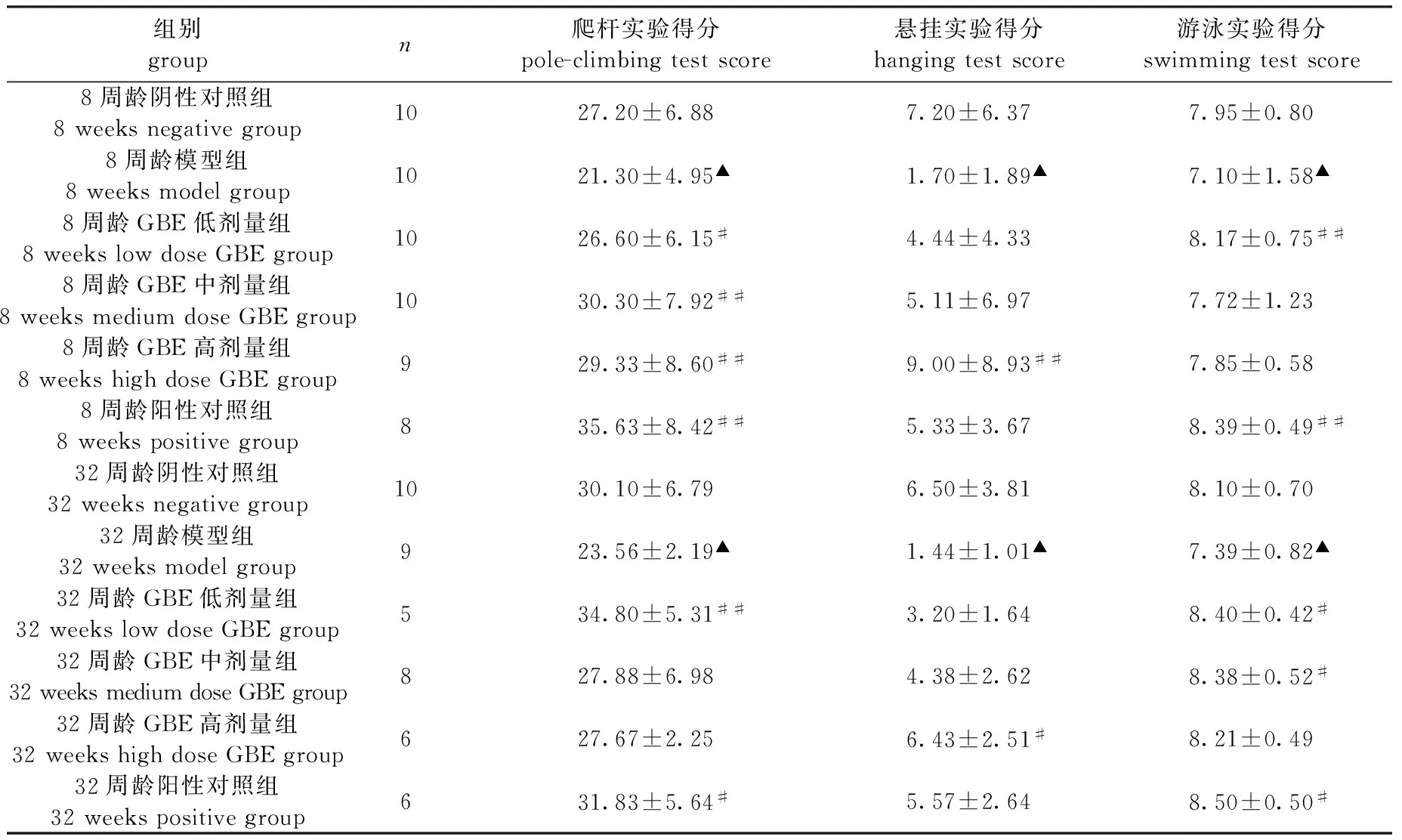
组别groupn爬杆实验得分pole-climbingtestscore悬挂实验得分hangingtestscore游泳实验得分swimmingtestscore8周龄阴性对照组8weeksnegativegroup1027.20±6.887.20±6.377.95±0.808周龄模型组8weeksmodelgroup1021.30±4.95▲1.70±1.89▲7.10±1.58▲8周龄GBE低剂量组8weekslowdoseGBEgroup1026.60±6.15#4.44±4.338.17±0.75##8周龄GBE中剂量组8weeksmediumdoseGBEgroup1030.30±7.92##5.11±6.977.72±1.238周龄GBE高剂量组8weekshighdoseGBEgroup929.33±8.60##9.00±8.93##7.85±0.588周龄阳性对照组8weekspositivegroup835.63±8.42##5.33±3.678.39±0.49##32周龄阴性对照组32weeksnegativegroup1030.10±6.796.50±3.818.10±0.7032周龄模型组32weeksmodelgroup923.56±2.19▲1.44±1.01▲7.39±0.82▲32周龄GBE低剂量组32weekslowdoseGBEgroup534.80±5.31##3.20±1.648.40±0.42#32周龄GBE中剂量组32weeksmediumdoseGBEgroup827.88±6.984.38±2.628.38±0.52#32周龄GBE高剂量组32weekshighdoseGBEgroup627.67±2.256.43±2.51#8.21±0.4932周龄阳性对照组32weekspositivegroup631.83±5.64#5.57±2.648.50±0.50#
注:模型对照组与阴性对照组比较,▲P<0.05;GBE给药组或阳性对照组与模型组比较,#P<0.05,##P<0.01。
Note: MPTP group vs the control group,▲P<0.05; GBE group or positive control group vs MPTP group,#P<0.05,##P<0.01.

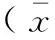
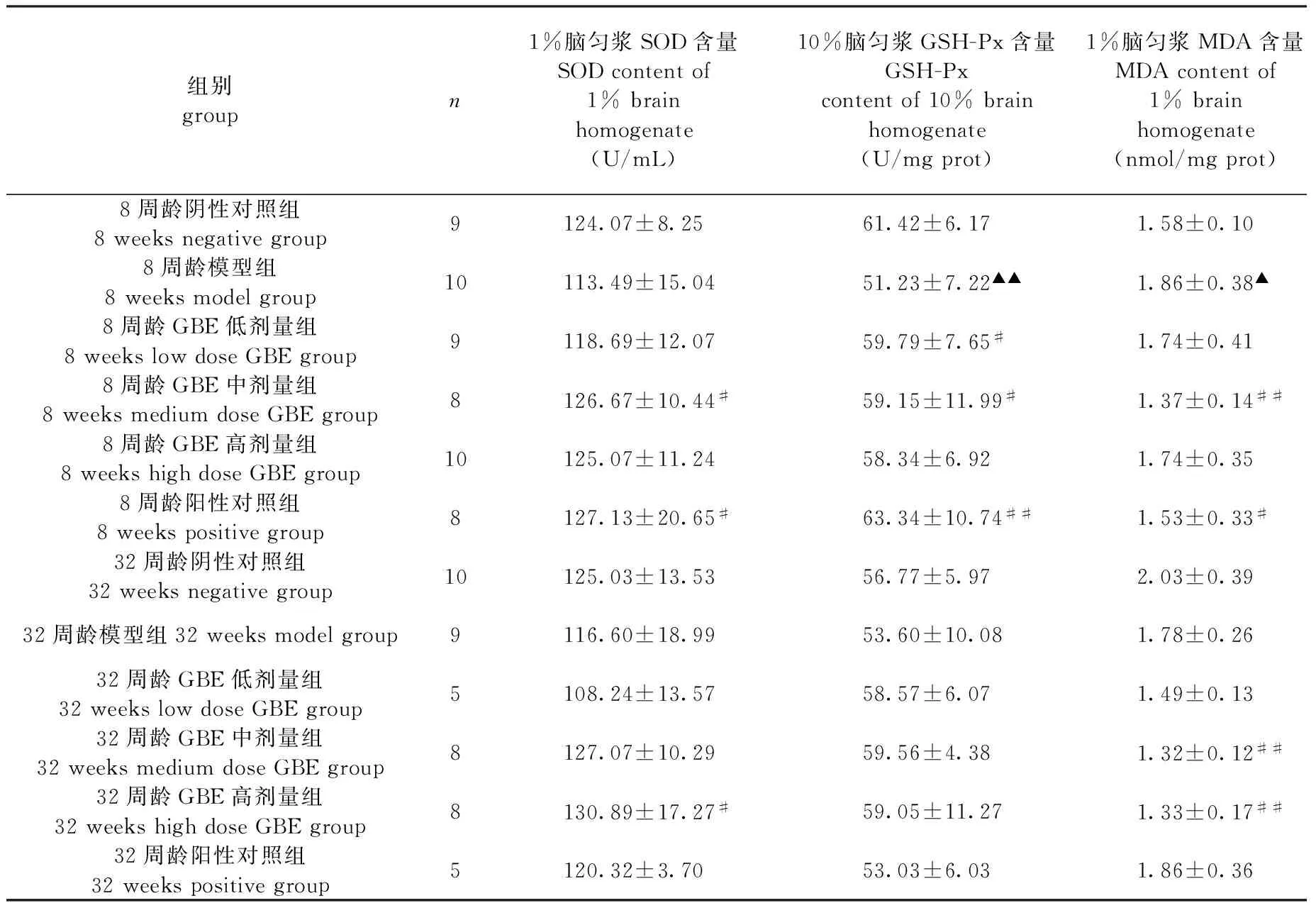
组别groupn1%脑匀浆SOD含量SODcontentof1%brainhomogenate(U/mL)10%脑匀浆GSH-Px含量GSH-Pxcontentof10%brainhomogenate(U/mgprot)1%脑匀浆MDA含量MDAcontentof1%brainhomogenate(nmol/mgprot)8周龄阴性对照组8weeksnegativegroup9124.07±8.2561.42±6.171.58±0.108周龄模型组8weeksmodelgroup10113.49±15.0451.23±7.22▲▲1.86±0.38▲8周龄GBE低剂量组8weekslowdoseGBEgroup9118.69±12.0759.79±7.65#1.74±0.418周龄GBE中剂量组8weeksmediumdoseGBEgroup8126.67±10.44#59.15±11.99#1.37±0.14##8周龄GBE高剂量组8weekshighdoseGBEgroup10125.07±11.2458.34±6.921.74±0.358周龄阳性对照组8weekspositivegroup8127.13±20.65#63.34±10.74##1.53±0.33#32周龄阴性对照组32weeksnegativegroup10125.03±13.5356.77±5.972.03±0.3932周龄模型组32weeksmodelgroup9116.60±18.9953.60±10.081.78±0.2632周龄GBE低剂量组32weekslowdoseGBEgroup5108.24±13.5758.57±6.071.49±0.1332周龄GBE中剂量组32weeksmediumdoseGBEgroup8127.07±10.2959.56±4.381.32±0.12##32周龄GBE高剂量组32weekshighdoseGBEgroup8130.89±17.27#59.05±11.271.33±0.17##32周龄阳性对照组32weekspositivegroup5120.32±3.7053.03±6.031.86±0.36
注:模型对照组与阴性对照组比较,▲P<0.05,▲▲P<0.01;GBE给药组或阳性对照组与模型组比较,#P<0.05,##P<0.01。
Note: MPTP group vs the control group,▲P<0.05,▲▲P<0.01;GBE group or positive control group vs MPTP group,#P<0.05,##P<0.01.
2.4.2纹状体DAT的表达结果
如表4所示,与阴性对照组比较,两个年龄段模型组小鼠大脑纹状体尾壳核DAT平均光密度值均显著降低(P<0.05,P<0.01),DAT阳性细胞显著减少(图2B、图2H)。与模型组比较,8周龄GBE给要组与阳性对照组小鼠大脑纹状体尾壳核DAT平均光密度值没有统计学意义,DAT阳性细胞数增加不明显(图2C-2F);32周龄GBE高剂量组小鼠大脑纹状体尾壳核DAT平均光密度值显著升高(P<0.05),DAT阳性细胞数显著增加(图2L),DAT阳性细胞数增加不明显(图2I-2K)。
3讨论
PD是发病率仅次于阿尔茨海默病(alzheimer’s disease,AD)的好发于中老年人第二大神经退行性疾病,临床常见症状有运动迟缓、静止性震颤、肌强直和姿势步态障碍。 MPTP是人工合成毒品的副产物,MPP+是其活性代谢产物,其可以选择性抑制线粒体复合物Ⅰ,诱导氧化应激,导致细胞死亡[7]。MPTP诱导的C57BL/6小鼠是目前学术界广泛运用并得到公认的研究PD的经典模型[8]。由于不同周龄的C57BL/6小鼠对于MPTP的敏感程度有明显的差异[9],为使实验结果更具参考价值,本实验选用了不同年龄段的小鼠作为研究对象。通过爬杆、悬挂和游泳实验分别检测8周龄和32周龄PD小鼠的运动协调功能,研究发现银杏叶提取物(GBE)能够显著增强不同年龄段PD小鼠的肢体协调能力,推测其对PD的症状具有改善作用。

组别groupn黑质TH平均光密度值THmeanopticaldensityinsubstantialnigraparscompacta纹状体尾壳核DAT平均光密度值DATmeanopticaldensityinstriatum8周龄阴性对照组8weeksnegativegroup100.588±0.0540.199±0.0688周龄模型组8weeksmodelgroup100.372±0.024▲▲0.081±0.007▲8周龄GBE低剂量组8weekslowdoseGBEgroup90.517±0.056##0.081±0.0048周龄GBE中剂量组8weeksmediumdoseGBEgroup80.527±0.068#0.084±0.0168周龄GBE高剂量组8weekshighdoseGBEgroup90.528±0.069##0.087±0.0178周龄阳性对照组8weekspositivegroup90.526±0.066##0.086±0.01932周龄阴性对照组32weeksnegativegroup100.559±0.0430.195±0.04232周龄模型组32weeksmodelgroup90.379±0.026▲▲0.082±0.015▲▲32周龄GBE低剂量组32weekslowdoseGBEgroup50.493±0.0390.081±0.01932周龄GBE中剂量组32weeksmediumdoseGBEgroup80.495±0.0640.113±0.03032周龄GBE高剂量组32weekshighdoseGBEgroup80.535±0.053##0.158±0.037#32周龄阳性对照组32weekspositivegroup60.468±0.0870.109±0.033
注:模型对照组与阴性对照组比较,▲P<0.05,▲▲P<0.01;GBE给药组或阳性对照组与模型组比较,#P<0.05,##P<0.01。
Note: MPTP group vs the control group,▲P<0.05,▲▲P<0.01; GBE group or positive control group vs MPTP group,#P<0.05,##P<0.01.
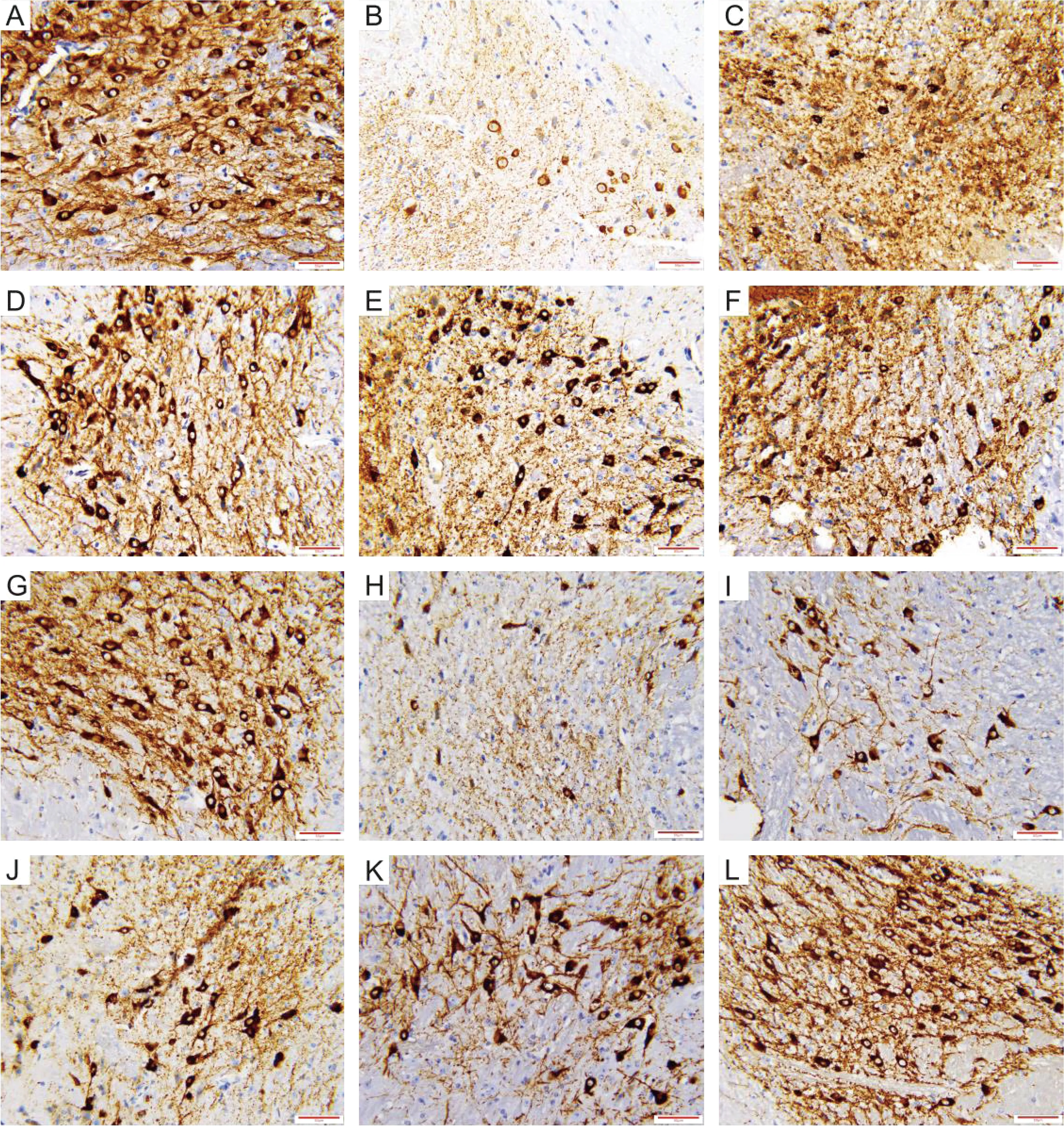
注:A:8周龄阴性对照组;B:8周龄模型组;C:8周龄阳性对照组;D:8周龄GBE低剂量组;E:8周龄GBE中剂量组;F:8周龄GBE高剂量组; G:32周龄阴性对照组;H:32周龄模型组;I:32周龄阳性对照组;J:32周龄GBE低剂量组;K:32周龄GBE中剂量组;L:32周龄GBE高剂量组。 图1 PD小鼠大脑黑质TH表达水平(标尺=50 μm)Note:A:8 weeks negative group;B:8 weeks model group;C:8 weeks positive group;D:8 weeks low dose GBE group;E:8 weeks medium dose GBE group;F:8 weeks high dose GBE group; G:32 weeks negative group;H:32 weeks model group;I:32 weeks positive group;J:32 weeks low dose GBE group;K:32 weeks medium dose GBE group;L:32 weeks high dose GBE group.Fig.1 TH expression in substantial nigra pars compacta of PD mice(Bar=50 μm)

注:A:8周龄阴性对照组;B:8周龄模型组;C:8周龄阳性对照组;D:8周龄GBE低剂量组;E:8周龄GBE中剂量组;F:8周龄GBE高剂量组; G:32周龄阴性对照组;H:32周龄模型组;I:32周龄阳性对照组;J:32周龄GBE低剂量组;K:32周龄GBE中剂量组;L:32周龄GBE高剂量组。 图2 PD小鼠大脑纹状体DAT表达水平(标尺=50 μm)Note:A:8 weeks negative group;B:8 weeks model group;C:8 weeks positive group;D:8 weeks low dose GBE group;E:8 weeks medium dose GBE group;F:8 weeks high dose GBE group; G:32 weeks negative group;H:32 weeks model group;I:32 weeks positive group;J:32 weeks low dose GBE group;K:32 weeks medium dose GBE group;L:32 weeks high dose GBE group.Fig.2 DAT expression in striatum of PD mice(Bar=50 μm)
已有研究表明,氧自由基与PD发病密切相关[10],SOD及GSH-Px在清除自由基方面具有重要作用,其活性的降低会加剧自由基对神经的毒性作用[11]。MDA含量是反应氧自由基水平的重要指标,可间接反映细胞损伤的程度。本研究中显示,银杏叶提取物(GBE)给药组小鼠的SOD、GSH-Px活性较模型组小鼠有不同程度的提高,MDA水平下降,提示GBE可能通过增加脑组织抗氧化酶的含量来提高机体的抗氧化能力,保护脂质免受病理性过氧化损伤,显著改善MPTP诱导的帕金森病的氧化应激状态。MDA测定结果显示,相对于8周龄小鼠,GBE对32周龄小鼠的抗氧化能力改善更为显著。
酪氨酸羟化酶(tyrosine hydroxylase,TH)是儿茶酚胺类神经递质及多巴胺、去甲肾上腺素、肾上腺素生物合成过程所需的限速酶。大脑多巴胺能神经元可以从细胞外摄取酪氨酸,在胞浆内经TH催化形成左旋多巴,再经芳香族氨基酸脱羧酶催化形成多巴胺(dopamine,DA)。DA是一种儿茶酚胺类神经传导物质,是用来帮助细胞传送脉冲的化学物质,主要负责大脑的愉悦和奖赏,将兴奋及开心的信息传递,在处理身体的学习、记忆、注意力、运动、新陈代谢中发挥重要作用。TH是DA能神经元的特有酶,染色阳性标志细胞存活,其TH阳性神经元数可直观反映脑内DA含量[12]。本实验两个年龄段PD小鼠的TH免疫阳性染色结果均显示,阴性对照组小鼠TH阳性细胞丰富,细胞胞体着色均匀,突起丰富,PD模型组小鼠TH阳性细胞数量呈明显的丢失,银杏叶提取物给药组多巴胺能神经细胞没有明显的丢失,随着给药浓度的升高,阳性细胞数呈递增趋势,提示银杏叶提取物减轻了MPTP对多巴胺能神经元的毒性作用,TH阳性细胞平均光密度值结果显示,银杏叶提取物对8周龄小鼠的治疗效果更明显。
DAT 是位于 DA 能神经元突触前膜的一种膜蛋白分子,属于 Na+/Cl-依赖性转运蛋白,PD 患者脑内 DAT 水平的降低与 DA 能神经元减少呈正相关[13]。DAT能够通过重摄取机制把DA重吸收进细胞,以确保DA不会不受限制的过多产生,DAT 的水平是DA能神经元最为特异的标记物,已成为诊断早期 PD的敏感指标[11]。本实验结果显示,模型组小鼠脑组织纹状体内DAT平均光密度值显著降低,DAT阳性细胞数明显减少,而给予不同浓度的银杏叶提取物治疗后,其减少得到不同程度的抑制,并呈剂量依赖性,说明银杏叶提取物能在一定程度上减轻MPTP对小鼠脑组织的病理损伤,DAT阳性细胞平均光密度值结果显示,银杏叶提取物对32周龄小鼠的治疗效果更明显。
本实验中,银杏叶提取物(GBE)显著改善了 PD 小鼠的行为协调能力,显著增强了PD小鼠抗氧化应激能力,明显抑制了 MPTP 诱导的 TH 阳性细胞和 DAT 阳性细胞的减少,对 PD 有一定的神经保护作用。
参考文献:
[1]Liu SM,Li XZ,Huo Y,etal. Protective effect of extract of Acanthopanax senticosus harms on dopaminergic neurons in Parkinson s disease mice[J].Phytomedicine,2012,19( 7) :631-638.
[2]巴晓红,刘英.银杏叶提取物及银杏总内酯对帕金森病大鼠黑质神经元损伤的保护作用[J].中国临床康复,2006,10(11):39-41.
[3]杨赣军,张建平,李庆耀. 银杏叶提取物对帕金森病模型小鼠多巴胺能神经元保护作用研究[J]. 四川解剖学杂志,2009,17(1):36-37.
[4]孙红梅,张琳,关涛,等.银杏叶提取物促进帕金森病模型小鼠室管膜下区神经干细胞增殖作用的研究[J].世界中西医结合杂志,2008,3(9):518-520.
[5]余凌虹, 魏怀玲, 鲍秀琦,等. 番荔枝酰胺衍生物FLZ对LPS联合MPTP诱发小鼠慢性帕金森病的治疗作用[J]. 药学学报. 2013,48(10):1557-1562.
[6]刘树民,张琳,于海龙.MPTP对小鼠帕金森病造模条件探讨[J]. 中国实验动物学报.2007, 15(2):146-149.
[7]Przedborski S,Tieu K,Perier C,etal.MPTP as a Mitochondrial Neurotoxic Model of Parkinson's Disease[J]. Journal of Bioenergetics and Biomembranes,2004,36:375-379.
[8]Blesa J,Phani S,Jackson-Lewis V,etal..Classic and new animal models of Parkinson's disease[J]. Journal of Biomedicine & Biotechnology,2012,2012:845618.
[9]舒丹,何金彩,陈江帆.不同周龄组的C57BL小鼠多巴胺神经元对MPTP敏感性的对比及其机制探讨[J].实用医学杂志,2007,23(6):807-809.
[10]冯卫红,刘耕陶.帕金森病与氧自由基[J].中国药理学通报,2000,16(5):481-484.
[11]陈生弟,乐卫东,陈先文,周海燕.帕金森病[M].北京:人民卫生出版社,2006:59-73.
[12]YUAN H, SARRE S, EBINGER G,etal. Histological, behavioural and neurochemical evaluation fo medil forebrain bundle and striatal 6-OHDA lesions as rat models of Parkinson’s diseases[J]. J Neurosci Methods,2005,144(1):35-45.
[13]Gonzalo E. The dopamine transporter proteome[J]. Journal of Neurochem,2006,97:3-10.
〔修回日期〕2015-10-21
[基金项目]广东省中医药局课题项目(20122199);广东省科技计划项目(2013B060300033)。
[作者简介]李金凤(1986-)女,硕士,实习研究员,研究方向:实验动物与动物实验模型。 [通讯作者]邝少松(1973-)女,硕士,高级兽医师,研究方向:实验动物药理、毒理学研究。E-mail: kuangss@126.com。
【中图分类号】R-332
【文献标识码】A
【文章编号】1671-7856(2016) 01-0046-07
doi:10.3969.j.issn.1671.7856. 2016.001.009
Protective effect of ginkgo biloba extract on mouse with parkinson’s disease induced by MPTP
LI Jin-feng1, XU Gui-mei2,ZHANG Chen-zi1, FEI Fan1, YANG Lin1, DAI Lu-lu1, SUN Xia1, KUANG Shao-song1
(1.Guangdong Medical Laboratory Animal Center, Guangdong Foshan 528248,China;2. Zengcheng maternal and Child Health Hospital,Guangdong Zengcheng 511300,China)
【Abstract】ObjectiveTo investigate the therapeutical effect of Ginkgo Biloba extract (GBE) on different ages of parkinsono Biloba e (PD) mice that induced by MPTP. MethodsSixty adult mice (8 weeks) and sixty older mice (32 weeks) were randomly divided into 6 groups: negative group, model group, positive group, high, medium and low dose GBE group. PD animal model were built through injecting with MPTP and then treated with different drugs accordingly. The limb motor function of mice were tested by using pole-climbing, hanging and swimming test. The activities of superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and the content of malondial dehyde (MDA) in the brain tissue were measure using spectro photography. The number of positive neurons expressing tyrosine hydroxylase (TH) in substantial nigra pars compacta and dopamine transporters (DAT) in striatum were detected by using the method of immunohistochemistry. Results1. The motor function score, the activity of GSH-Px, and the mean optical density of TH and DAT in brain tissues of model group of 8 weeks significantly decreased compared with negative group, while the content of MDA was significantly raised, showing the model of PD was successfully established. The function score, the activities of SOD and GSH-Px, the mean optical density of TH and DAT in brain tissues of the GBE treatment group significantly raised compared with the model group, while the content of MDA was significantly decreased. 2. The motor function score, the activity of GSH-Px, and the mean optical density of TH and DAT in brain tissues of model group of 32 weeks significantly decreased compared with negative group, while the content of MDA was significantly raised, showing the model of PD was successfully established. The function score, the activities of SOD and GSH-Px, the mean optical density of TH and DAT in brain tissues of the GBE treatment group significantly raised compared with the model group, while the content of MDA was significantly decreased. ConclusionsThe preventive medication of GBE shows a protective effect on mice of different ages with PD induced by MPTP.
【Key words】Ginkgo biloba extract; Parkinson's disease; MPTP; Oxidative stress; Neuron
