胆汁酸代谢的负反馈调节:对肝脏代谢和疾病的影响
2016-07-27周双男刘鸿凌
周双男 刘鸿凌
·热点论坛·
胆汁酸代谢的负反馈调节:对肝脏代谢和疾病的影响
周双男刘鸿凌
100039解放军第三○二医院移植内科
最近一项研究显示,肝脏farnesoid X受体(FXR)介导的转录抑制子,即V-Maf鸟类肌筋膜纤维肉瘤癌基因同系G(MAFG),可直接抑制胆汁酸合成相关基因,并且调节胆汁酸的成份,可能对肝脏代谢和疾病存在重大影响[1]。
胆汁酸是脂溶性维生素、脂肪、固醇类在肠道内吸收,以及药物在肝脏代谢的生理调节剂,同时也是激活FXR和膜G蛋白偶联受体(TGR5)来调节肝脏代谢的信号分子[2]。FXR和TGR5受体激动剂在肠胃系统中具有抗炎作用,并且对胆汁酸受体具有活化作用,从而可能防止非酒精性脂肪肝、糖尿病等疾病发生。经典胆汁酸合成途径在人类肝脏中占主导地位,由CYP 7A1发起,合成胆酸(CA)和鹅去氧胆酸(CDCA) 两种初级胆汁酸,见图1。CYP 8B1是CA合成必需酶。CYP 27A1催化3碳-类固醇形成C24胆汁酸。旁路途径由CYP27A1发起,CYP 7B1伴随,两者负责胆固醇氧化,肝细胞的氧化胆固醇则转化为胆汁酸。小鼠肝脏中 CDCA转化为α-鼠胆酸(MCAs)和β-鼠胆酸以及合成胆汁酸这两种途径作用相等。胆汁酸在肠道内被重吸收,肠道菌群会把一些初级胆汁酸改变为次级胆汁酸,后者经肠肝循环再次进入肝脏,抑制CYP 7A1 和 CYP 8B1的基因转录和胆汁酸合成。
为了研究肝脏转录抑制, 对FXR激动剂引起小鼠肝脏变化的数据进行分析,发现FXR可诱导并直接抑制胆汁酸合成[1]。并对多种FXR诱导的转录抑制物进行研究,确定MAFG是抑制胆汁酸合成基因的一个可能因素。喂养FXR激动剂和胆酸的野生型小鼠体内MAFG表达明显增加,而FXR-/-小鼠却无其变化,确定了Mafg基因中可能存在FXR结合位点。小鼠肝脏中腺病毒介导的MAFG过度表达、胆酸池中CYP 8B1和胆酸(不包括CYP 7A1)表达减弱,提示MAFG可调节胆汁酸成份(见图1)。肝脏中mRNA表达路径分析也证实:CYP8B1、CYP 27A1、CYP 7B1以及胆汁酸合成途径中的其他基因是MAFG的主要靶点,已在Cyp8B1基因启动子上确定一个MAFG有效结合位点。此外,Mafg表达RNA沉默的基因敲减可解除胆汁酸合成中的多重基因抑制并能增加胆酸水平。有关杂合子Mafg缺乏小鼠的研究进一步证实MAFG在胆汁酸合成中作用。
目前认为FXR可抑制胆汁酸合成中CYP7A1、CYP8B1、CYP27A1和CYP7B1,并且诱导胆汁酸结合中的胆汁酸/辅酶A合成酶以及胆汁酸转运中的胆汁酸/氨基酸转移酶。该研究增加了直接抑制基因(FXR/MAFG 途径1,见图1)的FXR依赖机制反馈调节胆汁酸的难度。在肝脏内,FXR诱导小二聚体伴侣(SHP),SHP可间接抑制CYP7A1和CYP8B1基因转录(途径2,见图1)。肝脏FXR/SHP途径可以被高水平胆汁酸激活,从而抑制胆汁酸合成[2]。在肠道内,FXR激动剂诱导成纤维细胞生长因子15(FGF15或 人类为FGF19),FGF15可激活肝脏FGF受体4/β- Klotho信号通路来抑制CYP7A1和CYP8B1的表达[3](途径3,见图1)。曾有相类似的十二指肠灌注胆汁酸抑制CYP7A1基因转录的研究,这说明胆汁酸负反馈调节中肠内因素可能为必要条件[4]。胆汁酸和FXR激动剂可诱导人肝细胞FGF19,但不能诱导小鼠肝细胞FGF15。有报道胆汁淤积患者(不包括非胆汁淤积和放置胆汁引流的胆汁淤积患者)肝脏FGF19水平随着CYP7A1表达水平减少而增加[4,5]。胆汁酸的多重负反馈调节机制可保证胆汁酸动态平衡和控制胆汁酸毒性。应该强调的是,除了胆汁酸池容量,胆汁酸成份和疏水性在其合成和脂类代谢调节中也起重要作用。虽然疏水性比CDCA低,但CA在膳食胆固醇和脂肪吸收以及胆囊内胆固醇和卵磷脂的混合微粒形成较其他胆汁酸更为有效。动物脂肪可增加总胆汁酸和去氧胆酸含量,并且快速增加肠道菌群中的耐受胆汁的微生物数量,从而引发炎症性肠病[6,7]。另一方面,Cyp8b1-/-小鼠则不易发生结石饮食诱发的高胆固醇血症和动脉粥样硬化。CYP8B1决定了12α-与非12α-羟化胆汁酸的比率和池内胆汁酸的疏水性。与非糖尿病患者相比较,在2型糖尿病患者中的血清胆汁酸浓度和12α-与非12α-羟化胆汁酸的比率有所增加[8]。
总之,该研究明确了FXR介导的负性转录因子(MAFG),可通过抑制CA合成中CYP 8B1,来改变小鼠胆汁酸成份,但不改变其容量。肝脏FXR/SHP、肠内FXR/FGF15以及成纤维细胞生长因子受体-4(FGFR4)等机制可能分别调节胆汁淤积或正常生理状态下的胆汁酸合成率。新发现的FXR/MAGF途径可能调节胆汁酸成份。胆汁酸成份和疏水性的改变已被证明与非酒精性脂肪性肝病、胆汁淤积性肝病和炎症性肠病的发病有关[2]。MAFG抑制靶基因表达的机制尚不明确。MAFG缺陷小鼠的表型还没有研究。目前预测, Mafg缺陷小鼠可能增加肠内的胆汁酸和膳食胆固醇与脂肪的吸收,从而发生高脂饮食引起的胆石症、脂肪性肝病、糖尿病以及动脉粥样硬化。另一方面, FXR激动剂可通过诱导MAFG,来抑制小鼠CYP8B1表达、胆酸合成以及减少高胆固醇血症和胆石形成。应用FXR激动剂能否减少非酒精性脂肪肝患者胆石症、糖尿病和动脉粥样硬化发生的研究值得期待。胆汁酸合成及脂代谢调节中MAFG的生理学作用还不明确,尚需详细研究。
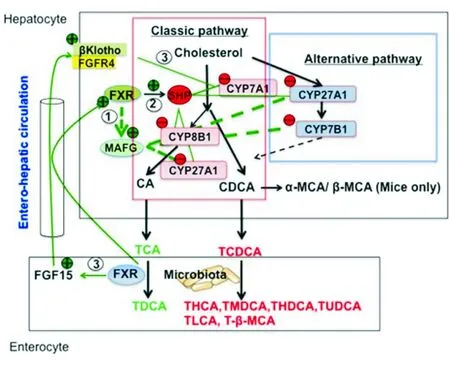
图1 胆汁酸合成途径与胆汁酸负反馈调节机制
经典途径由CYP7A1发起,合成CA和CDCA, CA合成需CYP 8B1,线粒体CYP27A1催化类固醇侧链氧化裂解。旁路途径中CYP27A1侧链裂解先于CYP7B1,进而合成氧化固醇(羟固醇)。小鼠中CDCA转换为α-鼠胆酸(MCAs)和 β-MCAs,大多数胆汁酸与牛磺酸(T)是共轭的,分泌至胆道,储存于胆囊。进餐后胆汁酸分泌至肠道进行营养吸收和转运。肠道中细菌作用后形成DCA和 LCA。经典途径中FXR/MAFG信号直接抑制CYP8B1和CYP27A1。FXR诱导SHP抑制CYP7A1/CYP8B1基因的反式激活(途径2)。肠道中FXR诱导FGF15,激活膜FGFR4/β-Klotho信号抑制CYP7A1/CYP8B1基因转录(途径3)。
缩写词:脱氧猪胆酸(HCA);石胆酸(LCA);脱氧鼠胆酸(MDCA);熊去氧胆酸(UDCA)。
(主要信息来源:Hepatology2015年第62卷第4期)
参考文献
[1]de Aguiar Vallim TQ, Tarling EJ, Ahn H, et al. MAFG is a transcriptional repressor of bile acid synthesis and metabolism. Cell Metab, 2015, 21:298-310.
[2]Li T, Chiang JY. Bile acid signaling in metabolic disease and drug ther-apy. Pharmacol Rev, 2014, 66:948-983.
[3]Inagaki T, Choi M, Moschetta A, et al. Fibroblast growth factor 15 functions as an enterohepatic signal to regulate bile acid homeostasis. Cell Metab, 2005, 2: 217-225.
[4]Pandak WM, Heuman DM, Hylemon PB, et al. Failure of intravenous infusion of taurocholate to down-regulate choles-terol 7 alpha-hydroxylase in rats with biliary fistulas. Gastroenterology, 1995, 108: 533-544.
[5]Schaap FG, van der Gaag NA, Gouma DJ, et al. High expression of the bile salt-homeostatic hormone fibroblast growth factor 19 in the liver of patients with extrahepatic cholestasis. Hepatology, 2009, 49:1228-1235.
[6]David LA, Maurice CF, Carmody RN, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature, 2014, 505:559-563.
[7]Sayin SI, Wahlstrom A, Felin J, et al. Gut microbiota regulates bile acid metabolism by reducing the levels of tauro-beta-muricholic acid, a naturally occurring FXR antagonist. Cell Metab, 2013, 17:225-235.
[8]Haeusler RA, Astiarraga B, Camastra S, et al. Human insulin resistance is associated with increased plasma levels of 12alpha-hydroxylated bile acids. Diabetes, 2013, 62: 4184-4191.
(本文编辑:张苗)
基金项目:解放军第三○二医院创新项目(YNKT2014008)
通信作者:刘鸿凌,Email: lhl1725@sina.com
(收稿日期:2016-02-19)
