肝螺杆菌感染对BALB/c小鼠免疫应答干扰的初步研究
2016-07-27冯洁张泉1谢建云2魏晓锋2高诚2
冯洁,张泉1,谢建云2,魏晓锋2,高诚2
(1.扬州大学兽医学院,江苏扬州 225009;2.上海实验动物研究中心,上海 201203)
肝螺杆菌感染对BALB/c小鼠免疫应答干扰的初步研究
冯洁1,2,张泉1,谢建云2,魏晓锋2,高诚2
(1.扬州大学兽医学院,江苏扬州 225009;2.上海实验动物研究中心,上海 201203)
【摘要】目的 探讨肝螺杆菌(Helicobacter hepaticus,H.hepaticus)感染对小鼠骨髓源树突状细胞(DC)表面分子形态和机体免疫应答的干扰。方法 以H.hepaticus(ATCC 51450)灌饲SPF级BALB/c雄性小鼠,于末次接种后5个月体外分离培养骨髓DC,经粒细胞-单核细胞集落刺激因子(GM-CSF)、白细胞介素-4(IL-4),刺激DC增殖、分化,流式细胞仪分析DC细胞表面分子CD11c、CD40、CD80、MHCII的表达率。此基础上,用新城疫病毒(NDV)ZJ1株人工接种实验组和对照组小鼠,每周测定NDV血清抗体效价,比较抗体产生的差异。结果 实验组MHC II 和CD40分子的表达率高于对照组。NDV抗体水平第1周实验组略低于对照组;第2~5周内实验组小鼠的抗体水平均高于对照组,差异有显著性;第6周两组小鼠血清抗体均呈下降趋势,差异无显著性。结论 H.hepaticus感染对小鼠骨髓DC成熟有促进作用,能提高MHC II和CD40表达水平,可促进BALB/c小鼠产生抗NDV的抗体水平。
【关键词】肝螺杆菌;树突状细胞;新城疫病毒;抗体
肝螺杆菌(Helicobacter hepaticus,H.hepaticus)属于革兰阴性菌,呈螺杆或弯曲状,生长要求苛刻,最早发现于发生肝细胞癌和慢性活动性肝炎的A/J Cr小鼠肝脏(Fox等,1992)[1]。H.hepaticus可长期定殖于啮齿类动物的肝脏和盲肠,引起慢性肝炎、肝癌、结肠炎和盲肠炎,病变的严重程度与动物的品系、年龄、性别等因素有关[2-4],使用携带H.hepaticus的实验动物进行科学研究时,可能会干扰实验结果。
树突状细胞(dendritic cell,DC)是重要的抗原提呈细胞(APC),成熟DC具有强大的抗原呈递功能并刺激T细胞活化,介导机体免疫应答[5]。本研究通过对BALB/c小鼠人工感染H.hepaticus,分离骨髓源DC细胞,经诱导后以流式细胞术检测其表面分子的表达水平。在此基础上,用新城疫病毒(NDV)ZJ1株接种小鼠,测定血清中NDV抗体效价水平,从而探讨H.hepaticus感染对于小鼠骨髓源DC表面分子形态的影响以及对小鼠免疫功能的干扰。
1 材料与方法
1.1 菌株
H.hepaticus标准菌株(ATCC51450),购自美国国家标准菌种保藏中心。标准菌株接种于哥伦比亚选择性血琼脂培养基,立即置于放有微需氧产气袋的密闭厌氧罐中,37℃培养至第7天,收集细菌。
1.2 病毒
灭活禽新城疫病毒(NDV)ZJ1株,由扬州大学畜禽传染病教研室惠赠。
1.3 实验动物
SPF级BALB/c小鼠50只,4~6周龄,雄性,体重22~24 g,由扬州大学比较医学中心提供【SCXK(苏)2012-0004】。所有动物均在扬州大学比较医学中心动物房进行饲养【SYXK(苏)2012-0029】。
1.4 仪器和试剂
哥伦比亚血琼脂基础培养基、脑心浸液、脱纤维裂解马血SR48、选择性抗生素SR147和微需氧产气袋(英国Oxoid公司),RPMI 1640(美国Hyclone公司),胎牛血清(美国Gibco公司),青链霉素(山东鲁抗医药股份有限公司),小鼠重组GM-CSF、IL-4(美国Peprotech公司),CD11c、CD40、CD80、MHCII单抗(美国eBiosciences公司),其他相关试剂均为国产分析纯。
Mini Spin离心机(德国Eppendorf公司),超净工作台(江苏苏州净化设备厂),细胞培养6孔板(美国Corning公司),CO2恒温培养箱(德国Heraeus公司),流式细胞仪FACSAria(美国Becton-Dickinson公司)。
每个病理学知识点的发现到证实跃为理论,都伴随着曲折有趣的科研历程,折射出医学前辈的科学智慧,融合教学法在病理实习课中,大胆实施以问题为中心,以学生为主人的教学方式,注重培养学生主支、独立、探索、多渠道的获取知识,这本身就激发学生对医学知识无限的探索欲望,使学生科研增加,而融合教学法,培养学生创新的思维模式有肋于挑战旧观念,提出新问题,从而激发学生们的科研兴趣[10]。
1.5 方法
1.5.1 模型建立
SPF级雄性BALB/c小鼠50只,经H.hepaticus特异性16S rRNA基因扩增证实无H.hepaticus感染。随机分为实验组和对照组,每组各25只,分别饲养于隔离器。禁食12 h后,实验组灌饲H.hepaticus菌液0.2 mL(1×108CFU/mL),对照组灌饲等量PBS,连续三次,每次间隔48 h。
1.5.2 小鼠骨髓DC的诱导培养
实验组小鼠感染H.hepaticus后第5个月,根据文献[6-8],每组各取8只小鼠脱颈处死,无菌取股骨和胫骨,用RPMI 1640培养基冲出骨髓细胞,400目滤网过滤两次后收集细胞悬液,离心弃上清,加入0.8%Tris-NH4Cl破解红细胞,离心、洗涤,以每孔2 ×106个细胞接种于6孔板,每孔加入终浓度为50 ng/mL小鼠重组IL-4和GM-CSF置37℃、5%CO2培养箱诱导培养。48 h后半量换液,加入新的含20 ng/mL小鼠重组IL-4和50 ng/mL小鼠重组 GMCSF的10%FCS RPMI 1640,继续培养,每培养48 h半量换液,至第10天弃悬浮细胞,收集半贴壁的树突状细胞(所有溶液均用无热原水配置)。对照组作同等处理。
1.5.3 DC表面分子的流式细胞术分析
收集的细胞1000 r/min离心8 min弃上清,PBS洗一遍后将细胞悬浮于100 μL PBS中,两组细胞分别加入大鼠抗小鼠CD11c、CD40、CD80和MHCII类分子荧光标记抗体,置4℃避光标记30 min,1000 r/min离心8 min,弃上清,再用PBS洗两次将细胞悬浮于100 μL PBS中,流式细胞仪检测DC细胞表面分子的表达率。
1.5.4 小鼠人工接种
感染H.hepaticus后第5个月每组选取15只小鼠进行腹腔注射,每只注射0.2 mL灭活NDV。分别于接种NDV后第1、2、3、4、5、6周经颌下静脉丛采血分离血清,以血凝抑制法(HI)检测血清中抗NDV的抗体效价。
2 结果
2.1 DC的诱导培养
培养基中加入小鼠重组GM-CSF、IL-4,光学显微镜下观察,培养24 h内树突状细胞悬浮生长,24 h后可见许多小而圆的半贴壁细胞,培养2~3 d后培养孔底部观察到细胞集落,且细胞集落随着培养时间的延长变多。培养至第7天,细胞呈悬浮生长且集落增多,高倍镜下可见细胞集落增多,细胞周围呈树突状突起(图1)。
2.2 DC表面分子表达分析
流式细胞仪检测细胞表面分子表达率如图2所示,实验组和对照组CD11c表面分子的表达率分别为:87.8%、85.6%;CD40表面分子实验组和对照组表达率分别为57.6%、38.8%;CD80表面分子实验组和对照组表达率分别为89.8%、88.7%;MHCII表面分子实验组和对照组表达率分别为3.6%、0.2%。可见肝螺杆菌感染能够促进DC表面分子CD40和MHCII类分子表达。
2.3 BALB/c小鼠接种NDV后的抗体水平检测
由表1和图3可知,实验组接种NDV后第1到第5周内血清抗体效价均逐渐升高,第6周时呈下降趋势;对照组接种NDV后第1、2周血清抗体水平持平,未出现上升,2到5周逐渐上升,第6周呈下降趋势。除第1周实验组小鼠抗体水平略低于对照组外,2至6周内实验组抗体水平均高于对照组。可见肝螺杆菌感染能够提高BALB/c小鼠对NDV的抗体水平。

注:A.分离培养3 d(×200);B.分离培养5 d(×400)。图1 树突状细胞形态Note.A.3 days after isolation(×200);B.5 days after isolation(×400).Fig.1 Morphological observation of the murine dendritic cells

表1 接种NDV后不同时间内小鼠的血清抗体效价(n=15)Tab.1 Serum antibody titer of the mice after inoculation with NDV at different times
3 讨论
啮齿动物螺杆菌在全球范围内普遍流行,已被公认为是啮齿类实验动物重要的致病菌,发达国家或国际知名实验动物供应商已将其纳入实验大小鼠病原体监测列表,而H.hepaticus尚未列入我国实验动物国家标准,国内实验室使用啮齿动物进行实验时通常不对该菌进行检测,使得感染难以被发现。对于机体免疫正常的小鼠H.hepaticus多为隐性感染,通常无明显的病理变化,H.hepaticus可引起机体细胞免疫和体液免疫,引起迅速而有力的I型免疫应答,产生IgG和IgM抗体,伴随抗H.hepaticus抗体产生、胆酸浓度改变、血清谷丙转氨酶水平升高,并引起多种细胞因子浓度升高[9]。使用携带H.hepaticus的实验动物进行药理学、免疫学等科学研究时,可能会对实验产生干扰,从而混淆实验结果。
DC是一种专职抗原提呈细胞,能够激活T、B细胞(特别是T细胞)的特异性免疫反应及免疫耐受。DC的分化发育主要经历四个阶段:造血干细胞→DC前体细胞→未成熟的DC细胞→成熟的DC细胞[5]。在外来抗原的刺激下,成熟 DC表面的MHCII分子与T细胞受体结合,传导抗原特异性刺激信号,同时,共刺激分子刺激T细胞活化,在机体特异性免疫应答调节中起着重要的作用[10]。我们从感染H.hepaticus 5个月的BALB/c小鼠和未感染H.hepaticu的对照组小鼠骨髓中分出DC细胞进行体外诱导培养,可在10 d左右扩增出大量DC细胞。采用流式细胞术对两组细胞DC表面的共刺激分子(CD11c、CD40、CD80和MHCII)的表面分子的表达率进行检测,结果表明,MHCII和CD40分子在实验组的表达率要高于对照组的表达率。由此推测,H. hepaticus感染可能会对小鼠骨髓中DC的成熟起促进作用,且能提高MHC II和CD40分子的表达水平,提示或许对抗体的产生水平有一定的促进作用。
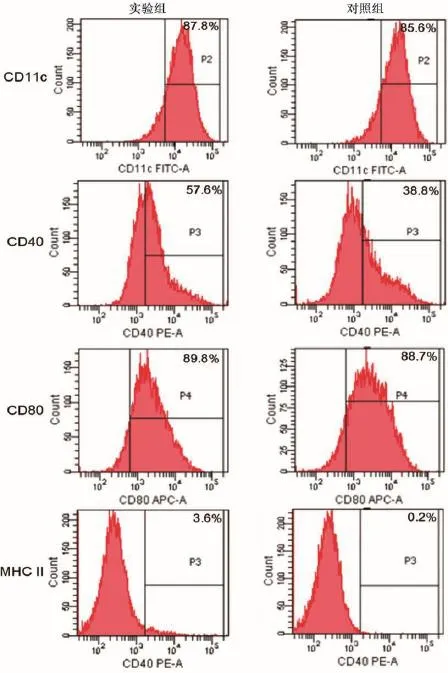
图2 实验组与对照组小鼠DC表面分子表达率Fig.2 Expression rate of DC cell surface molecules in the experimental and control groups of mice
有研究表明[11],用单纯疱疹病毒Ⅰ型(HSV-1)分别接种感染H.hepaticus 1个月和未感染H.hepaticus的C57BL/6小鼠,1周后感染H.hepaticus小鼠的DC表面分子CD40、CD80、CD86和MHCII分子水平较对照组显著降低,说明H.hepaticus感染抑制了DC表型成熟,这与本文结果有一定的差异。我们分析可能的原因在于本文仅单纯性研究感染H. hepaticus对BALB/c小鼠骨髓来源DC表面分子表达率的影响,而文献报道的结果则可能是H.hepaticus和HSV-1共同作用导致。另外也可能与动物品系、DC细胞来源及感染的时间等因素有关,还有待进一步深入研究。此外,本实验还用NDV ZJ1株分别接种已感染H.hepaticus和未感染H.hepaticus的BALB/c小鼠,结果显示,在不同时间段,H.hepaticus感染可以促进BALB/c小鼠产生抗NDV的抗体水平,这可能与H. hepaticus感染可刺激DC细胞表面CD40和MHC II类分子表达水平有一定的关系。综上所述,H.hepaticus感染会对免疫学实验产生干扰而影响实验数据的准确性。因此在进行动物实验尤其是免疫学相关实验时,应尽量选择不携带H.hepaticus的动物,以排除其对实验的干扰。

图3 接种NDV抗原后不同时间小鼠的血清抗体水平的比较Fig.3 Comparison of antibody titer of the mice after inoculation with NDV antigenat at different times
参考文献
[1] Fox JG,Dewhirst FE,Tully JG,et al.Helicobacter hepaticus sp.nov.,a microaerophilic bacterium isolated from livers and intestinal mucosal scrapings from mice[J].Clin Microbiol,1994,32:1238-1245.
[2] Ward JM,Fox JG,Anver MR,et al.Chronic active hepatitis and associated liver tumors in mice caused by a persistent bacterial infection with a novel Helicobacter species[J].J Natl Cancer Inst. 1994,86(16):1222-1227.
[3] Cahill RJ,Foltz CJ,Fox JG,et al.Inflammatory bowel disease:an immunity-mediated condition triggered by bacterial infection with Helicobacter hepaticus[J].Infect Immun.1997,65:3126 -3131.
[4] Hailey JR,Haseman JK,Bucher JR,et al.Impact of Helicobacter hepaticus infection in B6C3F1 mice from 12 National Toxicology Program 2-year carcinogenesis studies[J].Toxicol Pathol. 1998,26:602-611.
[5] Jonuleit H,Schmitt E,Schuler G,et al.Induction of interleukin 10-producing,nonproliferating CD4(+)T cell with regulatory properties by repetitive stimulation with allogeneic immature human dendritic cells[J].J Exp Med,2000,192(9):1213-1222.
[6] Inba K,Inaba M,Romanin N,et al.Generation of large numbers of dendritic cells from mouse bone-marrow culture supplemented with granulocyte/macrophage colony-stimulating factor [J].J Exp Med,1992,176:1693-1702.
[7] Cao X,Zhang W,He L,et al.Lymphotactin gene-modified bone marrow dendritic cells act as more potent adjuvants for peptide delivery to induce specific antitumor immunity[J].J Immunol,1998,161:6238-6244.
[8] Lutz MB,Kukutsch N,Ogilvie AL,et al.An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow[J].Immunol Methods,1999,223(1):77-92.
[9] Chahlavi A,Rabkin S,Todo T,et al.Effect of prior exposure to herpes simplex virus 1 on viral vector mediated tumor therapy in immunocompetent mice[J].Gene Ther,1999,6:1751-1758.
[10] Smaroula D,Julius MC,Robert L.Function of CD80 and CD86 on monocyte and stem cell derived dendritic cells[J].Exp Mol Pathol,2003,75:217.
[11] Gulani J,Norbury CC,Bonneau RH,et al.The effect of Helicobecter hepaticus infection on immune responses specific to herpes simplex virus type 1 and characteristics of dendritic cells[J]. Comp Med.2009,59(6):534-544.
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)03-0304-05
Doi:10.3969/j.issn.1005-4847.2016.03.017
Corresponding author:GAO Cheng,E-mail:gaochengdgb@126.com
[基金项目]上海市科技创新行动计划(14140900600,11140901000);上海市科委研发平台专项(15DZ2292400)。
[作者简介]冯洁(1981-),女,副研究员,E-mail:moyifj@163.com
[通讯作者]高诚,研究员,E-mail:gaochengdgb@126.com
[收稿日期]2016-02-22
Preliminary observation on the interference effect of Helicobacter hepaticus infection on the immune response in BALB/c mice
FENG Jie1,2,ZHANG Quan1,XIE Jian-yun2,WEI Xiao-feng2,GAO Cheng2
(1.School of Veterinary Medicine,Yangzhou University,Yangzhou 225009,China;2.Shanghai Laboratory Animal Research Center,Shanghai 201203)
【Abstract】Objective To determine the interference effect of H.hepaticus infection on the functional characteristics of dendritic cell(DC)surface molecules and immune response in mice.Methods Male BALB/c mice were inoculated with H.hepaticus(ATCC 51450).Murine bone marrow-derived dendritic cells(DC)were isolated and co-cultured which were stimulated by GM-CSF and IL-4 at the fifth month after the last inoculation.Then the DCs were subjected to FACS analysis for surface markers(CD11c,CD40,CD80 and MHCII)detection.On this basis,virus suspension of Newcastle disease virus(NDV)ZJ1 strain was inoculated into the mice.Serum was collected for detection of the NDV antibody titer in serum weekly to explore the difference of antibody titer between the two groups.Results The expression rates of CD40 and MHCII on the mouse DCs in experimental group were higher than that in the control group.The NDV antibody titer of experimental group was slightly lower than that in the control group in the first week.During the 2nd to 5th weeks,the titer was higher than that in the control group,with a very significant difference.In the 6th week,the titer of both the two groups tended to fall.Conclusions H.hepaticus infection can promote bone marrow DC maturation in mice,stimulate the expression rates of MHC II and CD40,and enhance the NDV antibody levels.
【Key words】Helicobacter hepaticus;Dendritic cells;Newcastle disease virus,NDV;Antibody;Immune response;Mice
