二甲基亚砜、二甲基酰胺、甲醇、乙醇四种溶剂对Hela细胞培养干预效应研究*
2016-07-26陕西中医药大学医学技术学院咸阳712046
陕西中医药大学医学技术学院 (咸阳712046)
杨晓航 李 舒 刘文奇 许小凡△ 张 红△ 刘 力△▲
二甲基亚砜、二甲基酰胺、甲醇、乙醇四种溶剂对Hela细胞培养干预效应研究*
陕西中医药大学医学技术学院 (咸阳712046)
杨晓航李舒刘文奇许小凡△张红△刘力△▲
摘要目的:观察二甲基亚砜(DMSO)、二甲基甲酰胺(DMF)、甲醇、乙醇四种常用有机溶剂对Hela细胞生存率的影响,为开展体外细胞干预实验研究选择溶剂种类和浓度提供参考。方法:采用MTT法检测四种溶剂各9个浓度下Hela细胞的存活率;在此基础上采用AnnexinⅤ-FITC/PI双标记流式细胞术,观察8种不同浓度的乙醇对Hela细胞凋亡的影响。结果:四种有机溶剂不同浓度时对Hela细胞生存率产生不同影响,DMSO最佳浓度为0.5%;DMF最佳浓度0.1%,甲醇的最佳浓度0.1%~0.5%;Hela细胞的存活率和凋亡结果均表明乙醇作为有机溶媒的最佳浓度0.25%。结论:DMSO、DMF、甲醇、乙醇四种溶剂对Hela细胞活性和生存率存在负向影响,程度从小到大依次为乙醇、DMSO、DMF、甲醇,用于体外细胞培养的浓度最大均不可超过0.5%;乙醇是体外细胞培养中较为理想的溶剂,但浓度不可超过0.25%,刺激时间不可超过12h。
主题词Hela细胞二甲亚砜甲酰胺类甲醇乙醇细胞培养技术干预性研究
Hela细胞是体外细胞干预实验中常用的细胞株,在化学离子探针、分子作用靶向、血清药理学等研究领域使用广泛[1-4]。大量体外细胞培养的干预效应研究都涉及了有机溶剂的使用,但有机溶剂的使用多根据溶质需要确定浓度且差异较大[5-7]。目前未见针对使用有机溶剂的浓度差异对活细胞计数的干预效应研究[8-10]。现有实验中细胞活性或计数的研究结果,理论上均为溶质成分(分子)与有机溶剂形成溶液体系的叠加效应,忽略了有机溶剂对细胞的干预效应,从而引起实验结果的误差。本研究拟通过观察二甲基亚砜(DMSO)、二甲基酰胺(DMF)、甲醇、乙醇四种有机溶剂对Hela细胞存活率的影响,为体外细胞实验中有机溶媒的选择和矫正相关研究结果的误差提供实验依据。
材料与方法
1实验材料宫颈癌细胞株Hela细胞,购于西安交通大学第一附属医院转化医学中心;缓冲液(PBS)配成0.01mmol/L,RPMI1640培养液购于美国Solarbio公司, 胎牛血清、胰酶购于北京全式金生物技术有限公司 ,酶标仪为美国Bio-TEK公司产品。DMSO购于美国Sigma公司(纯度>99.9%)、DMF购于广东光华科技股份有限公司(纯度>99.5%)、甲醇购于天津富宇精细化工有限公司(纯度>99.5%)、乙醇购于天津市达森化工产品有限公司(纯度>99.7%),3-(4,5-二甲基噻唑-2)-2,5-二甲基四氮唑溴盐(MTT)购于美国Sigma公司。
2细胞培养宫颈癌细胞用RPMi1640培养液(10%胎牛血清、100U/ml青霉素、100μg/ml链霉素、10mmol/L HEPES),在37℃、5%CO2培养箱中培养至对数生长期,观察细胞贴壁状况良好,即可使用。
3MTT法检测细胞存活率细胞经过胰酶消化后计数。调整细胞密度至1×105个/ml,分别接种于4个96孔板,每孔100μl,培养24h后分别设空白对照组、DMSO组、DMF组、甲醇组和乙醇组。空白对照组只加细胞和等体积培养基,不加有机溶剂,复孔8个;实验组分别加入DMSO、DMF、甲醇、乙醇这四种有机溶剂的9个不同浓度,分别为0.01%、0.05%、0.1%、0.25%、0.5%、1%、5%、10%、20%,浓度单位均为体积比,每组浓度设8个复孔,孵育24h后加入MTT 50μl(终浓度是5mg/ml),孵育4h,小心吸取上清后,每孔继续加入DMSO 150μl,孵育10min,充分震荡,放入酶标仪,在490nm处测吸光度(OD值),重复3次。得到的实验数据,通过下面公式计算细胞相对存活率R。
R(%)=×100%
4细胞形态的观察倒置显微镜20倍、40倍物镜下观察并记录细胞的形态变化。
5AnnexinⅤ-FiTC/Pi双标的流式细胞术观察8种不同浓度的乙醇对Hela细胞凋亡的影响。Hela细胞经过胰酶消化后计数。调整细胞密度至1×106个/ml,接种于6孔板,每孔2ml,培养24h后分为6h实验组、12h实验组、24h实验组。每组实验组中均包含空白对照组和8种不同乙醇浓度组。空白对照组共两个复孔,只加细胞和等体积培养基,不加有机溶剂;实验组各组分别加入8种不同浓度的乙醇,浓度分别为:0.01%、0.05%、0.1%、0.25%、0.5%、1%、5%、10%;每组两个复孔,放入细胞培养箱进行培养,分别在6h、12h、24h时取出细胞,制成细胞悬液,经细胞晒网滤过之后,按试剂盒说明加入AnnexinⅤ-FiTC和Pi双染,流式细胞仪检测。重复3次,得到实验数据。

结果
1DMSO对Hela细胞存活率的影响在浓度为0.5%以内,DMSO对Hela 细胞存活率无明显影响。DMSO浓度在0.01%~0.05%时,细胞生存率与培养基对照组均无差异。但是,当浓度超出0.5%时,随着浓度的增加,存活率显著下降。以5%浓度组同0.5%浓度组相比较,细胞存活率明显下降(P<0.05)。浓度对于0.5%的各组细胞生存率明显下降,且随着浓度的升高,存活率逐渐下降,见表1。

表1 DMSO不同浓度组Hela细胞OD均值与存活率
注:与空白对照组比较,*P<0.05;**P>0.05
2DMF对Hela细胞存活率的影响DMF的浓度为0.01%组、0.05%组、0.1%组、0.25%组、0.5%组分别与培养基对照组比较差异均无统计学意义(P>0.05),存活率与培养基对照组比无差异;DMF浓度为1%组、5%组、10%组、20%组分别与培养基对照组比较差异具有极显著统计学意义(P<0.01),Hela细胞的存活率与培养基对照组比较有统计学差异,以0.5%浓度组同1%浓度组相较,细胞存活率有明显下降(P<0.05),见表2。
3甲醇对Hela细胞存活率的影响甲醇浓度为0.01%组、0.05%组与空白对照组比较,差异有统计学意义(P<0.05),Hela细胞的存活率与培养基对照组比较有统计学差异(P<0.05),且小于培养基对照组;0.1%组和0.5%组分别与培养基对照组比较,存活率无明显统计学差异(P>0.05);0.25%组与培养基对照组比较,存活率有统计学差异(P<0.05),且大于培养基对照组;1%组、5%组、10%组和20%组分别与培养基对照组比较,存活率有极显著性统计学差异(P<0.01),且随着浓度的升高存活率逐渐下降,见表3。
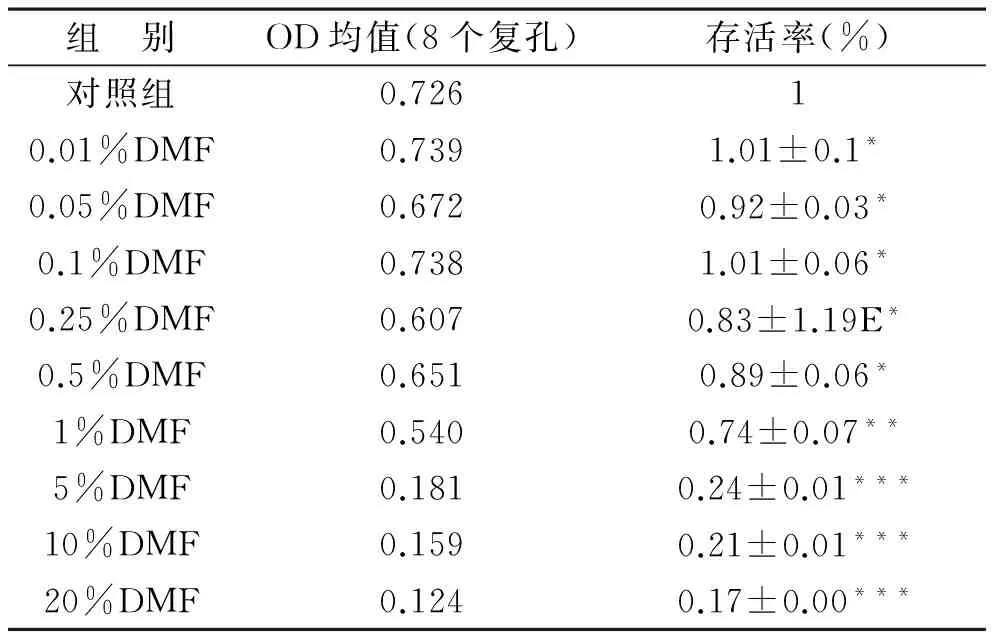
表2 DMF不同浓度组Hela细胞OD均值与存活率
注:与空白对照组比较,*P>0.05;与0.5%组比较,**P<0.05;与空白对照组比较,***P<0.01
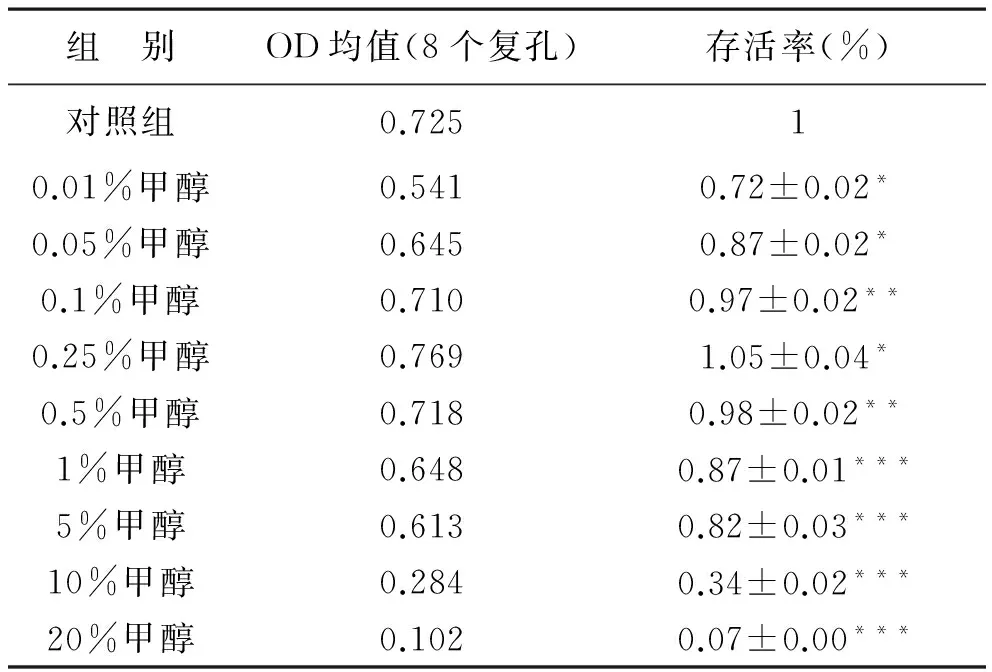
表3 甲醇不同浓度组Hela细胞OD均值与存活率
注:与空白对照组比较,*P<0.05, **P>0.05,***P<0.01
4乙醇对Hela细胞存活率的影响乙醇9种不同浓度各组分别与培养基对照组比较,差异有极显著统计学意义(P<0.01),浓度从0.01%~0.25%,随着浓度的升高,存活率逐渐升高。0.5%组、1%组、5%组、20%组,随着浓度的增加,Hela细胞的存活率逐渐降低,而10%浓度组与5%浓度组相较,10%组Hela细胞的存活率高。以0.5%组同0.25%组相较,Hela细胞的存活率有显著下降差异有极显著统计学意义(P<0.01)。提示乙醇浓度超过0.25%时,Hela细胞的存活率明显降低,见表4。
5相同浓度梯度下DMSO、DMF、甲醇、乙醇对Hela细胞存活率影响的比较当浓度同在0.25%以内时,乙醇分别与甲醇、DMSO、DMF相比较,Hela细胞的存活率有统计学差异(P<0.05),乙醇中Hela细胞的存活率高于其他三种溶剂。提示0.25%浓度以内,首选乙醇作为有机溶媒。当有机溶媒浓度超0.5%,随着浓度的增大,Hela细胞的存活率逐渐下降,与空白对照组相比,差异均有统计学意义(P<0.05)。提示,DMSO、DMF、甲醇、乙醇四种有机溶剂在参与到Hela细胞培养的离体实验中时,浓度均不可高于0.5%(图1)。

表4 乙醇不同浓度组Hela细胞OD均值与存活率
注:与空白对照组比较,*P<0.01;与0.5%组比较,**P< 0.01

图1 相同浓度梯度下四种溶剂对Hela细胞存活率影响
6Hela细胞在四种溶剂中形态变化的比较对照组(图2A)细胞核清晰可见、完整、型好,细胞个体紧实、边界清楚、贴壁良好、紧紧相连。与空白对照组相比,DMSO组细胞随着浓度的增加,细胞肿胀,细胞核明显肿胀、变形、固化,边界清晰可见无连接(图2B、C、D);DMF组细胞中可见,细胞体积肿胀,细胞核变大、固化(图2E、F、G);甲醇组细胞随着浓度增大,细胞核逐渐肿胀变大,相较于其他三种溶剂其细胞核折叠程度明显增加(图2H、I、J);乙醇组细胞随着浓度增大体积逐渐肿大,固化,边界清晰,无连接,细胞核肿大与保质边界清晰可见(图2K、L、M)。各组Hela细胞形态变化与MTT检测结果一致。
7不同时间段相同浓度梯度下乙醇对Hela细胞存活率影响当乙醇浓度为0.25%时,以刺激6h后Hela细胞的存活率与刺激12h后Hela细胞的存活率相比较,差异无统计学意义(P>0.05),提示乙醇刺激Hela细胞6h和12h,Hela细胞的存活率无差别。
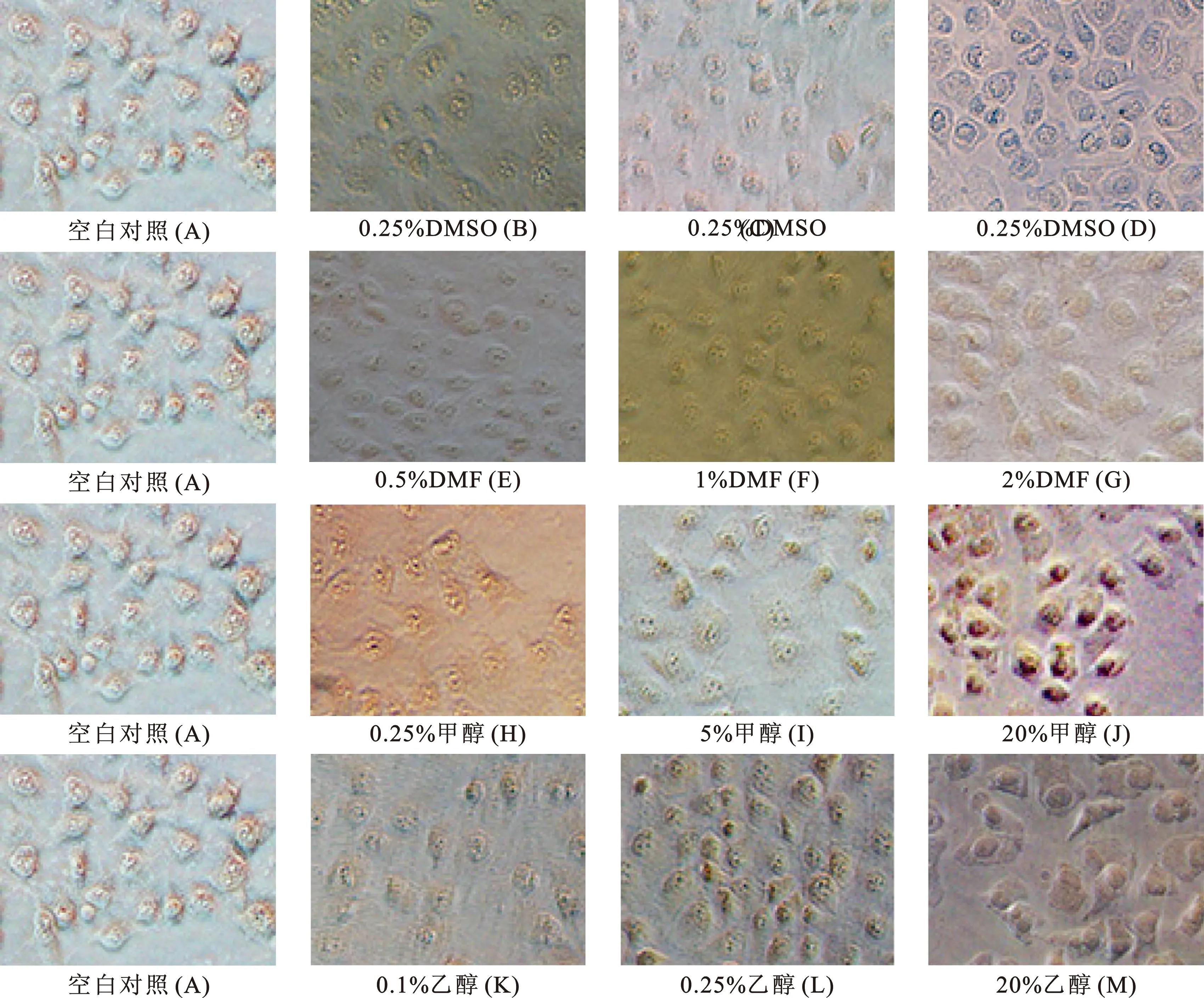
图2 四种溶剂不同浓度对Hela细胞形态的影响
同样比较Hela被乙醇刺激6h与24h,12h与24h,差异无统计学意义(P>0.05),提示当乙醇浓度为0.25%时,刺激时间在24h内,Hela细胞的存活率无差别。同理比较乙醇浓度为0.5%时,Hela细胞被刺激6h与24h比较,差异具有统计学意义(P<0.05),提示乙醇浓度为0.5%时,Hela细胞被刺激6h与24h后的存活率有差别。当Hela细胞被乙醇刺激同为12h时,以浓度为1%组同5%组相比较,差异具有极显著统计学意义(P<0.01),提示同被乙醇刺激12h后,Hela细胞的存活率1%组与5%组有显著性差别,5%组Hela细胞的存活率明显低于1%组。当Hela细胞被乙醇刺激同为6h时,同样以浓度为1%组同5%组相比较,差异具有统计学意义(P<0.05),提示1%组与5%组Hela细胞的存活率有差别。结果显示,Hela细胞离体实验中,乙醇作为有机溶媒时,浓度不可超过0.5%,与MTT检测结果基本一致,刺激时间控制在12h为最佳(图3)。
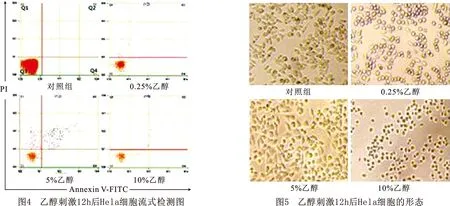
8乙醇对Hela细胞刺激12h流式细胞仪检测结果及细胞形态乙醇刺激12hHela细胞流式细胞仪检测结果显示:对照组Hela细胞群99.99%集中在Q3象限;0.25%乙醇组有少部分细胞分散到其他3个象限,同时Q3象限细胞数量明显减少;5%乙醇组可以看到明显的有多部分细胞分散到Q1和Q2象限,Q3象限相较0.25%组有减少;10%乙醇组细胞数量明显减少,分散在4个象限的细胞也明显稀疏(图4)。乙醇刺激12hHela细胞显微镜下显示:对照组细胞均匀分布,细胞形态完好,呈梭状或不规则形状,贴壁。0.25%乙醇组细胞有部分呈圆形,不贴壁,透亮度增大,另一部分呈梭形。5%乙醇组可以看见细胞少部分贴壁,肿胀,同样透亮度增大。10%乙醇组细胞已没有细胞形态,皱缩呈黑色团状,周围有光晕,细胞数量也明显减少(图5)。镜下观察与流式检测结果基本一致。

图3 不同时间段相同浓度梯度下,乙醇对Hela细胞存活率的影响
讨论
细胞体外培养计数及存活率检测是细胞研究的基本技术指标, DMSO、DMF、甲醇和乙醇是开展细胞研究最常用的四种有机溶剂。虽然目前已开展了四种有机溶剂对不同细胞株的毒性和干预效应研究,但缺乏在同一细胞和培养环境四种溶剂的比较研究[11-13],造成在有机溶剂选择时缺乏实验依据。本研究结果证实了四种有机溶剂对Hela细胞活性和生存率存在负向干预效应,其影响程度从小到大依次为乙醇,DMSO、DMF、甲醇。同时研究结果表明在细胞培养中应用四种溶剂的体积比浓度上限为0.5%,否则会一定程度上导致Hela细胞的死亡,影响细胞计数及存活率。
研究结果显示乙醇是体外细胞培养中较为理想的溶剂,但浓度不可超过0.25%,时间不可超过12h。研究还发现乙醇刺激24h后,浓度小于1%时,Hela细胞的数量和存活率均较6h、12h高,且与浓度呈正相关,提示较低浓度的乙醇可以刺激细胞增殖。结合MTT的实验原理[14]推测导致上述结果的原因可能为:低浓度的乙醇激活了琥珀酸脱氢酶,使三羧酸循环加快,从而使得OD值升高。同时低浓度的乙醇可以刺激Hela细胞的增殖,线粒体增多。但琥珀酸脱氢酶是否被激活以及其激活途径本实验尚未涉及,有待进一步研究。
研究还发现甲醇溶剂培养的Hela细胞核明显折叠,细胞肿胀没有其他三种溶剂中的细胞明显。推断可能甲醇可能通过对细胞核的影响引起了细胞凋亡。因此建议在实验中,如溶质分子可能进入细胞核时,应慎重考虑使用甲醇。
细胞内外的物质交换、细胞内的生物化学反应影响着细胞的生存、结构和功能,胞内存在的多种信号转导途径之间又存在着复杂的交叉对话机制[15],细胞的生存率、形态变化、染色质凝缩、空泡出现等事件受到来自细胞内外诸多因素的影响和调控[16-17]。离子探针、化学药物、中药药效成分等在体外与细胞共培养过程中使用的有机溶剂虽然用量较少,可理论上都会对细胞的活性和计数产生一定影响,甚至影响研究结果。
本次研究结果明确了四种常见有机溶剂在不同浓度时对离体培养细胞计数和形态的干预效应,对开展离体细胞培养时有机溶剂类型和浓度的选择有一定指导意义,但溶剂浓度差异与细胞存活率和形态差异形成的机制仍待进一步阐明。
参考文献
[1]秦玉芝, 钟晓红, 陈功锡, 等.有机溶剂对宫颈癌 Hela 细胞增殖的影响[J]. 中药材, 2011, 34(4): 563-566.
[2]Yuan L, Lin W, Chen B,etal. Development of FRET-based ratiometric fluorescent Cu2+chemodosimeters and the applications for living cell imaging[J]. Organic Letters, 2011, 14(2): 432-435.
[3]Liu SR, Wu SP. New water-soluble highly selective fluorescent chemosensor for Fe (Ⅲ) ions and ITS application to living cell imaging[J]. Sensors and Actuators B Chemical, 2012,171- 172(8):1110-1116.
[4]张军,张耀明,王正辉.等. 草苁蓉多糖提取物诱导人喉癌Hep2细胞凋亡的实验研究[J]. 陕西医学杂志, 2014, 43(8): 947-949.
[5] Fakih S, Podinovskaia M, Kong X,etal. Monitoring intracellular labILe iron pools: A novel fluorescent iron (Ⅲ) sensor as a potential non‐invasive diagnosis tool[J]. Journal of Pharmaceutical Sciences, 2009, 98(6): 2212-2226.
[6] Shamsipur M, Sadeghi M, Garau A,etal. An efficient and selective flourescent chemical sensor based on 5-(8-hydroxy-2-quinolinylmethyl)-2, 8-dithia-5-aza-2, 6-pyridinophane as a new fluoroionophore for determination of iron (Ⅲ) ions. A novel probe for iron speciation[J]. Analytica chimica acta, 2013, 761: 169-177.
[7]刘玉和, 于春艳, 王皓, 等. Vk3 对宫颈癌 Hela 细胞 mTOR 信号转导蛋白基因表达的影响[J]. 吉林大学学报: 医学版, 2009, 35(2): 267-270.
[8] 韩莉, 周永芹, 韩钰. 蜈蚣提取物诱导宫颈癌 HeLa 细胞凋亡及其机制的研究 [J]. 时珍国医国药, 2007, 18(9): 2109-2111.
[9] 苏文敬, 黄磊, 敖启林, 等. 那可丁对宫颈癌 HeLa 细胞的抑制作用及机制探讨[J]. 华中科技大学学报: 医学版, 2011, 40(3): 287-290.
[10] 龚青, 石丁波, 蔡卫斌, 等. 藏红花素诱导宫颈癌 HeLa 细胞凋亡及其作用机制[J]. 中华肿瘤防治杂志, 2009, 16(019): 1445-1447.
[11]孙佩君,刘建烽,冯三畏,等.二甲基甲酰胺对V79 细胞的毒性作用环境与职业医学[J]. 2013,30(4):268-270.
[12]王近中,辛佩珠.乙醇对生物膜功能和细胞结构的影响[J].中国公共卫生学报, 1992, 4(3): 170.
[13]孙晓飞,宋大贺,刘淑艳.等.甲醇对HepG-2细胞毒理作用的初步研究[J]. 现代畜牧兽医, 2015,(12):7-11.
[14]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,2007:200-201.
[15]庞敏, 屈佩, 高春蕾, 等. 虾夷扇贝毒素对 Hela 细胞凋亡的诱导及胞内钙离子浓度的影响[J]. 水产学报, 2011, 35(11): 1729-1735.
[16]杜健军. IIB 族离子荧光探针的研究与细胞成像的应用[D].大连:大连理工大学, 2009:1-7.
[17]高超, 刘颖, 蔡晓敏, 等. 白花蛇舌草抑制 Hela 细胞肿瘤活性的体外实验研究[J]. 徐州医学院学报, 2007, 27(9): 571-574.
(收稿:2016-02-11)
【中图分类号】R392.1
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.07.02
The optimum concentration of four kinds of organic solvents such as DMSO,DMF,methyl alcohol,ethyl alcohol as solvents effect on Hela cell in vitro experiments
Department of Medical Technology of Shaanxi University of Chinese Medicine(Xianyang 712046)
Yang XiaohangLi ShuLiu Wenqiet al
ABSTRACTObjective :To research the best concentration of four kinds of organic solvents DMSO 、DMF 、methyl alcohol、ethyl alcohol effect on Hela cell through measure the optical density value (OD value) of the four solvents under various survival rate. Provide guidance for select solvention microprobe and traditional Chinese medicine experiment. Methods: Using determined by MTT reagent combined enzyme standard meter method to concentrations of 9 Hela survival rate. Using 8 different concentrations of ethanol and 3 time periods in Hela cells with AnnexinⅤ-FiTC/Pi marked, and then characteristics on the apoptosis of Hela cells by flow cytometry method. Result: The best concentration of ethyl alcohol could not more than 0.25%;The bestconcentration of DMSO could not more than 0.5%;The best concentration of DMF could not more than 0.1%;The best concentration of methyl alcohol was between 0.1% and 0.5% . Conclusion: Ethyl alcohol is the best one of these 4 organic solvents which used in experiment of Hela cell in vitro. You’d better use the concentration less than 0.25%;stimulate time can not more than 12 hours. if there is something wrong with the solubitity, the order of these 4 organic solvents is ethyl alcohol, DMSO 、DMF and methyl alcohol. Take care ,the concentration must be less than 0.5%.
KEY WORDSHela cellsDimethyl sulfoxideFormamidesMethanolEthanolCell culture techniquesIntervention studies
*国家自然科学基金资助项目(81173156)
陕西省教育厅科学研究计划项目(14JK1188)
△陕西中医药大学医学科研实验中心
▲陕西省中医药研究院
