硅铁合金中硅的测定方法改进
2016-07-26唐晓飞辽宁广播电视大学海城学院海城114200
唐晓飞辽宁广播电视大学海城学院 (海城114200)
硅铁合金中硅的测定方法改进
唐晓飞
辽宁广播电视大学海城学院(海城114200)
摘要采用氟硅酸钾法测定硅铁合金中的硅。试样用KOH和KNO3混合熔剂在镍坩埚中熔融,选取了最好的熔融条件,熔融温度420℃,熔融时间11 min。消除了铝钛的共沉淀干扰,避免了用NaOH和Na2O2熔样时的起火爆炸现象。同时也减少了对镍坩埚的损害,坩埚的寿命提高了10倍。采用自制的抽滤装置,抽滤速度快,滤纸不会穿漏,残余酸易洗涤、中和,无漏滤现象。
关键词硅铁合金;熔融;硅;氟硅酸钾滴定法中图分类号:TN931
文献标识码:A
文章编号:1003-3319(2016)01-00023-03
硅铁合金是由元素硅和铁组成的复合合金,是一种较为理想的脱氧剂、脱硫剂。测定其合金元素硅的方法,一般有两种:容量法[1]和重量法。容量法,通常采用NaOH和Na2O2分解样品,试剂消耗多、镍坩埚损坏严重。同时由于用NaOH和Na2O2熔样时,因硅铁合金中硅能与NaOH反应生成硅酸钠和氢气,则在熔样时会产生起火爆炸现象,使分析失败[2]。重量法分析步骤繁琐,分析周期长,而且使用氢氟酸会给人体和环境带来伤害和污染。本工作采用氟硅酸钾容量法测定硅铁合金中的硅。用KOH和KNO3混合熔剂在镍坩埚中熔融,选取了最好的熔融条件,避免了试样在溶样过程中的溅出和镍坩埚的腐蚀,同时沉淀容易洗净。实验表明,该法操作简便快速,分析结果准确可靠,已应用于日常分析检验。
1 实验部分
1.1主要试剂
硝酸钾-乙醇洗液(5%);盐酸:ρ约1.19 g/mL;氢氧化钾(AR);氟化钾(15%);硝酸:ρ约1.42 g/mL;氯化钾(AR);硝酸钾(AR);中性水:经煮沸后除去CO2的蒸馏水,加草酚蓝指示剂10滴,用氢氧化钠滴定;氢氧化钠标准溶液(0.1mol/L):称取4.0g氢氧化钠溶解于1000mL无二氧化碳的水中(将水注人烧瓶中,煮沸10min,立即用装有钠石灰管的胶塞塞紧,冷却即得)[3],摇匀,保存在聚乙烯瓶中,密闭放置;氢氧化钠标准溶液标定:称取于105-110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾0.7500g于250mL烧杯中,加无二氧化碳的水溶解,加2滴酚酞指示剂液(10g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30s,同时做空白试验[4]。
1.2实验方法
称取硅铁合金试样0.05g于镍坩埚中,加2.5g氢氧化钾混匀,再在表面盖1g硝酸钾,置于400℃高温炉中熔融10min。用热水浸取熔融物于塑料烧杯中,加入硝酸20mL,过氧化氢2mL,冷却至室温。在不断搅拌下缓缓加入氟化钾溶液15mL,放置10min。用双层中速滤纸(用普通滤纸剪成约Φ40mm)铺在带有塑料过滤器的抽滤瓶上抽滤,用硝酸钾-乙醇溶液洗烧杯及沉淀各2次。将沉淀及滤纸移入原烧杯中,加硝酸钾-乙醇溶液10mL,加溴百里酚蓝指示剂5滴,滴加氢氧化钠标准溶液中和沉淀和滤纸上的残余酸,直至溶液呈蓝色不消失。然后加入约150mL煮沸的中性水,立即以氢氧化钠标准溶液滴定至溶液恰好变蓝色为终点,记录滴定体积。随同试样做空白试验。按下式计算硅的质量分数:
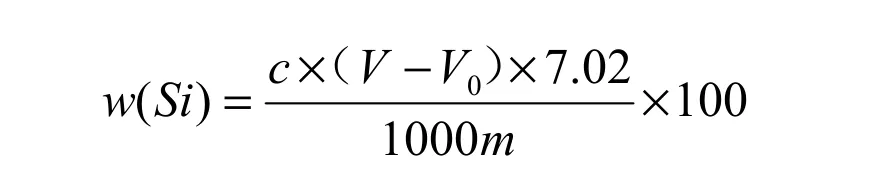
式中:w(Si)—硅的质量分数,%;
c—氢氧化钠标准溶液的浓度,mol/L;
V—滴定消耗氢氧化钠标准溶液的体积,mL;
V0—滴定空白溶液消耗氢氧化钠标准溶液的体积,mL;
m—试样质量,g;

2 结果与讨论
2.1熔剂的选择和用量
经过试验,一般碱性熔剂如氢氧化钾、氢氧化钠、过氧化钠等都能使其分解。试验发现具有强氧化性的熔剂过氧化钠能使硅铁分解,但使用过氧化钠对坩埚腐蚀严重,易泄漏,且大量的镍进入干扰测定。氢氧化钠和氢氧化钾也能使其分解,但氢氧化钠中的钠平子易生成氟铝酸钠沉淀,水解后释放出氢氟酸,使结果偏高。为此选择氢氧化钾,氢氧化钾进入试液,经硝酸酸化即为氟硅酸的沉淀剂,有利于氟硅酸钾沉淀的形成,氢氧化钾为熔剂有利于减少铝、钛的干扰[5]。同时,经过试验,发现加入KNO3,可以降低熔点,降低反应的剧烈程度,防止飞溅,更有利于试样的熔融。故选用KOH-KNO3混合熔剂于镍坩埚中熔融。
2.2试样分解条件
称取0.05g硅铁合金标样(Si含量65.02),按照分析方法进行实验。由于KOH熔点为360℃,故选择实验温度分别是300℃、350℃、400℃、450℃、500℃,熔融10min,测得数据见表1。

表1 熔融温度选择实验结果
通过实验发现,熔融温度低时,测定结果偏低。温度过高,腐蚀镍坩埚,且反应剧烈易飞溅,所以选择400℃。在此温度下,按照实验方法进行熔融时间的选择,从实验结果(表2)可见,熔融10min-15min均产生比较满意的结果,本着时间短,坩埚腐蚀小,且节约能源的原则,故选择10min。

表2 熔融时间选择实验结果
2.3试样浸取酸度
盐酸能够增加K2FSi6沉淀的溶解度,而K2FSi6在硝酸中的溶解度较盐酸中大得多。硫酸易生成难溶的硫酸盐,为了提高检测的准确度,减少铝的干扰,采用硝酸介质更为有利。实践证明,溶液的酸度应保持在3rnol/L左右,过低时易形成其它盐氟化物沉淀而干扰测定,但酸量过多会给沉淀的洗涤与中和残余酸的操作带来麻烦,亦无必要。所用的硝酸应一次加入,预防析出硅胶,使测定结果偏低。
2.4干扰及其消除
硅的测定干扰元素主要为铝、钛,其它干扰元素如铌、钽、锆、铍等,一般试样中含量甚微,故未予考虑。铝、钛等对测定均有干扰,原因是它们能与氟平子形成络合物共沉淀,尤其是铝、钛干扰严重。本方法中由于硅铁合金中铝、钛含量较低,故采取加过氧化氢配位的方式来消除干扰[6]。
2.5沉淀过滤与洗涤
氟硅酸钾滴定法采用抽滤的办法,则时常会发生漏滤现象。采用塑料漏斗过滤,速度慢且易发生水解,另外由于滤纸面积大,吸附残余酸多,不易洗涤和中和。本文将普通抽滤瓶进行改装,将玻璃砂芯漏斗部分用塑料代替,只需用四分之一张滤纸(滤纸直径约为40mm),抽滤速度快,滤纸不会穿漏,吸附的残余酸量很少,易于洗涤和中和。硅容易水解,为防止沉淀水解,操作应尽量缩短时间,当试样较多时,应分批进行沉淀,且沉淀放置时间15-30min,沉淀温度应控制在30℃以下。温度过高时,将导致K2FSi6沉淀预先水解,而使测定结果偏低。

表3 实际样品实验结果(n=6)
2.6样品分析结果及对比
按照上述实验方法,选取3个实际样品和3个硅铁合金标准样品进行实验,结果表明本方法没有系统加加,方法准确可靠。同时与标准方法相比,无显著性加异,精密度和准确度满足分析要求。
2.7准确度及回收率
用实验确定的条件及分析方法,在3个硅铁合金标准样品中加入光谱纯二氧化硅,测定其加标回收率,结果见表4。结果表明,标准样品测定值与认定值之加小于文献规定的允许加[7]。回收率在98.32%~101.1%,准确度满足分析要求。
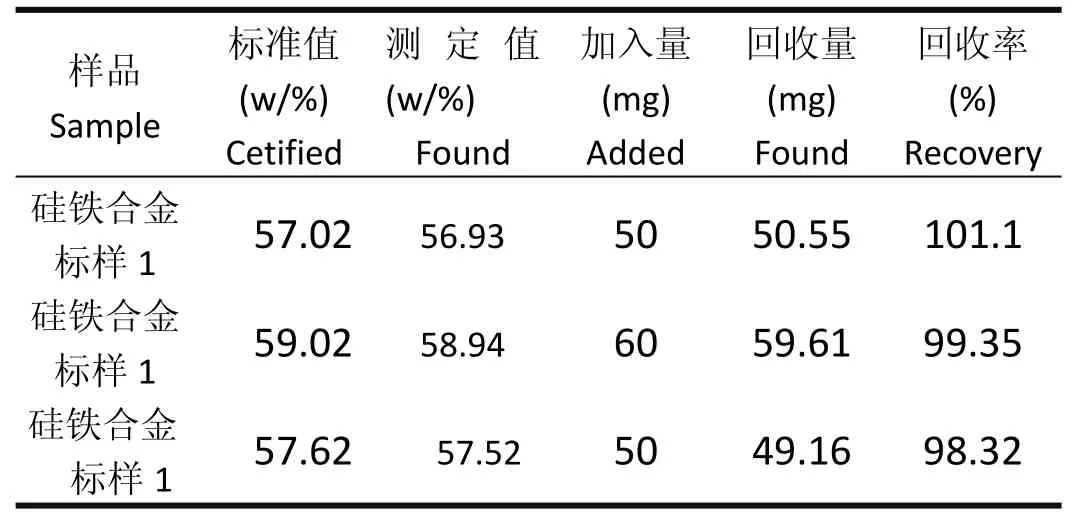
表4 样品回收率
3 结论
经过大量生产检验证明,本方法选择性高、快速、准确。同时用国家标准方法测定进行对比,结果表明本方法没有系统加加,方法准确可靠。相对标准偏加在0.13%~0.25%,回收率实验结果为98.32%~101.1%。与国标方法相比,无论是测定试样还是测定标样均无显著性加异,精密度和准确度完全满足分析要求。
参考文献
[1]冶金工业部标准研究院编.钢铁及铁合金化学分析方法标准汇编(上)[M].北京:中国标准出版社,1997.
[2]梁松成.硅铁中硅的快速测定[J].冶金分析(Metallurgical Analysis),2004,24(1):61-62.
[3]李启华,余锦,樊朝英.工厂化验员速查手册[M].北京:化学工业出版社,2005:196.
[4]郝玉林,刘冬霓,等.化学试剂标准滴定溶液的制备[M].北京:中华人民共和国国家质量监督检验检疫总局出版社,2002:105.
[5]李京.碱熔-氟硅酸钾滴定法测定铁合金中硅[J].冶金分析(Metallurgical Analysis),2004,24(3):72-74.
[6]马宝利,蒋惠亮,施立勇.滴定法硅含量的检测[J].分析试验室,2008,27(12):188-189.
[7]鞍钢钢铁研究所.实用冶金分析[M].鞍山:辽宁科学技术出版社,1990:1524.
(责任编辑:文婷)
