融合免疫佐剂Lipo多肽与包膜蛋白EDIII区的登革病毒四价疫苗的构建及免疫效应研究
2016-07-26任守凤曹国梅梁韶晖刘文权潘长旺
任守凤,曹国梅,谭 峰,梁韶晖,刘文权,潘长旺
融合免疫佐剂Lipo多肽与包膜蛋白EDIII区的登革病毒四价疫苗的构建及免疫效应研究
任守凤,曹国梅,谭峰,梁韶晖,刘文权,潘长旺
温州医科大学基础医学院人体寄生虫学教研室,温州325035
摘要:目的构建编码免疫佐剂Lipo多肽与登革病毒1-4型包膜蛋白EDIII区的重组甲病毒载体,并在小鼠体内研究其免疫效应,为研制新型的登革病毒四价疫苗奠定基础。方法先通过GS linker将编码免疫佐剂Lipo多肽的基因序列与编码登革病毒1-4型包膜蛋白EDIII区的基因序列进行串联获得LipoEDIII;然后将LipoEDIII基因插入甲病毒载体DREP的多克隆位点,构建重组甲病毒载体DREP-LipoEDIII;将DREP-LipoEDIII转染293细胞,Western blot检测融合蛋白的表达;随后将DREP-LipoEDIII免疫ICR小鼠,不加任何佐剂,再加强免疫2次后,通过ELISA检测血清中的抗体效价和细胞因子的分泌情况来评价其免疫效应。结果成功构建了含有“融合免疫佐剂Lipo多肽与包膜蛋白EDIII区”的重组甲病毒质粒DREP-LipoEDIII。DREP-LipoEDIII免疫小鼠后可以诱导产生特异性抗体,抗体效价为1∶160。抗原刺激小鼠脾淋巴细胞可以产生IFN-r 、IL-4、IL-10细胞因子,实验组的浓度明显高于对照组。结论在不需要加入任何外源佐剂的情况下,本研究构建的融合免疫佐剂Lipo多肽的登革四价疫苗能够诱导小鼠产生特异性的体液和细胞免疫应答,且以细胞免疫应答为主,为今后新型登革病毒四价疫苗的研究奠定了基础。
关键词:登革病毒;包膜蛋白;甲病毒载体;四价疫苗
登革病毒(Dengue,DEN)属于黄病毒科、黄病毒属,包括4种血清型,均可以经蚊媒传播引起人类登革热[1]。初次感染登革病毒后所产生的抗体只能对相应血清型的病毒产生保护作用,当再次感染其它型别的病毒时,会由于抗体依赖性病毒感染增强作用(ADE)而加重病情,引起登革出血热/登革休克综合征[2]。所以一种理想的登革热疫苗应能够同时诱导生成对四种血清型产生中和作用的持久抗体[3]。
登革病毒是一种单股正链RNA 病毒[4]。基因组含单一开放读码框架,可以编码3种结构蛋白和7种非结构蛋白。其中登革病毒E基因DⅢ区(EDIII)具有多种型及亚型特异性的中和表位和宿主细胞受体结合位点,而且E蛋白位于病毒颗粒的脂质双层膜中,含有多种B 细胞表位和T细胞表位,是登革病毒的主要保护性抗原,是制备登革病毒亚单位疫苗的首选[5-7]。但是重组的EDIII抗原存在免疫原性差异,不能有效的诱导免疫保护作用。而脂质体蛋白Lipo(liposome)被认为是一种能够有效提升免疫原性的佐剂[8]。研究证实,将Lipo多肽分别与DENV2和DENV4的EDIII融合表达后的重组蛋白能有效诱导特异性中和抗体的产生,并能降低产生ADE效应的风险[7-8]。因此,本研究拟利用连接肽(GS Linker),将Lipo多肽与DENV1-4型的EDIII基因片段连接在一起,构建四价EDⅢ融合基因的重组甲病毒载体疫苗,然后将构建成功的四价重组质粒免疫小鼠,研究重组质粒的免疫原性及作为亚单位疫苗诱导小鼠产生体液免疫和细胞免疫反应的能力,为登革病毒质粒疫苗的研究奠定基础[9-10]。
1材料与方法
1.1材料
1.1.1质粒和菌株甲病毒载体DREP为本实验室保存。目的基因LipoEDIII由南京金斯瑞公司合成。大肠杆菌DH5a为本实验室保存。
1.1.2细胞293细胞为本实验室保存。
1.1.3实验动物 ICR鼠(6~8周龄,雌性,清洁级)购自温州医科大学动物中心。
1.1.4主要仪器和试剂BcuI、SmaI和T4DNA连接酶等均购自Fermantas公司,辣根过氧化物酶(HRP)标记的山羊抗小鼠二抗购自Fermantas公司, DNA 凝胶回收试剂盒、去内毒素质粒提取试剂盒为Omega公司产品。LipofectaminTM2000购自Invitrogen 公司。酶标仪购自美国Bio-Rad公司,ECM830电转移购自BTX公司。
1.1.5引物设计根据本实验室已经合成的DEN1-4病毒株基因组E基因DIII区基因序列设计引物引入限制性内切酶位点BcuI和SmaI用于后续重组质粒DREP-LipoEDIII的构建。引物设计:上游引物:5′-TCCCCCGGGCTCGAGATGAA
GAAA- 3′(划线部分是BcuI的酶切位点);下游引物:5′-CGGACTAGTCTATCTAGAATGATGATGA-3′(划线部分是SmaI的酶切位点)。
1.2方法
1.2.1构建重组质粒DREP-LipoEDIII用PCR扩增获得含有目的基因LipoEDIII的一段序列,并用限制性内切酶BcuI和SmaI进行消化获得目的基因LipoEDIII,目的基因大小约为1 500 bp.将其与经过限制性内切酶BcuI和SmaI消化的质粒DREP用T4连接酶进行连接,将连接产物转化到大肠杆菌DH5a感受态细胞中,用含抗生素卡那霉素的固体培养基筛选得到阳性单克隆菌株,将筛选得到的阳性菌株送去测序,用DNAStar软件对测序结果进行分析。
1.2.2质粒DNA的大量制备采用E.Z.N.A.公司的Endo-free质粒提取试剂盒(omega)提取质粒DNA,包括空质粒DREP,含登革1-4型病毒EDIII基因的重组质粒DREP-LipoEDIII。具体操作步骤参照试剂盒说明书。质粒用PBS磷酸盐缓冲液溶解,并采用紫外分光光度仪测定A260和A280值,以确定质粒的纯度和浓度。
1.2.3重组质粒的检测将重组质粒DREP-LipoEDII转染到293细胞中并用Western Blot的方法检测目的基因LipoEDIII在293细胞中的表达:转染前将293细胞接种于6孔培养板中,并加1 mL不含抗生素的完全培养基,以保证转染时细胞汇合达90%~95%。按照LipofectaminTM2000操作说明,将重组质粒DREP-LipoEDIII和空质粒DREP分别转染到293细胞中,空质粒DREP做对照组,37 ℃ 5%CO2培养箱中培养48 h后收集细胞,用Western Blot的方法检测目的基因LipoEDIII在293细胞中的表达。
1.2.4免疫方案将ICR小鼠随机分成3组,每组8只,第1-3组分别注射PBS磷酸盐缓冲液、空质粒DREP、重组质粒DREP-LipoEDIII。每种质粒DNA每只鼠均注射50 μg/次,免疫途径采用腿部肌肉注射。注射后立即对注射部位进行电刺激(EP),电刺激的参数为:75 V、25 ms、 6次,每次间隔200 ms。免疫分3次进行,在初次免疫之后的第2周和第4周各加强免疫1次,免疫剂量与初次免疫一致。分别于初次免疫后第0、2、4和6周通过剪尾取血,在第10周时通过眼眶取血,取血后分离血清用于抗体效价的检测。
1.2.5体液免疫检测ELIAS法检测抗体效价,用本实验室制备纯化的登革病毒四价重组蛋白TetEDIII包被ELIAS板,用倍比稀释的小鼠血清为一抗,HRP-羊抗鼠IgG为二抗,TMB显色液进行显色,抗体效价通过酶标仪测定的450 nm波长的OD值获得,抗体效价通过一抗的稀释比表示。
1.2.6细胞因子检测1)脾淋巴细胞悬液的制备:将小鼠眼眶取血后颈椎脱臼处死,无菌条件下剖开小鼠腹腔取脾,将脾脏放入1 mlL 1640细胞培养液中清洗,将清洗过的脾脏置于400目滤网上,用5 mL注射器内芯轻轻研磨,不断向组织上滴加RPMI1640细胞培养液,直至组织内绝大部分细胞被分离,将细胞悬液小心加于含有淋巴细胞分离液的15 mL离心管中,细胞悬液要加于淋巴细胞分离液的液面之上。18 ℃-22 ℃,400 g离心20 min。离心后,用吸管小心洗出分离液上层(包含淋巴细胞的细胞层)0.5 cm以上的上清部分,弃去。用吸管小心吸取分离液层及淋巴细胞层至于另一新离心管内。然后加10 mL PBS缓冲液混匀,250 g离心10 min,弃上清,用吸管以5 mL PBS缓冲液重悬所得细胞,250 g离心10分钟弃上清,加1 mL含有10%胎牛血清的RPMI1640培养液重悬细胞并计数,将脾细胞浓度用含10%胎牛血清的 RPMI 1640培养液调整到107/mL。2)细胞因子的检测:将脾淋巴细胞悬液稀释到1×106/mL加到96孔板(100 μL/孔),然后加入登革病毒四价重组蛋白(5 μg/mL)抗原刺激脾淋巴细胞产生细胞因子,用刀豆素(ConA 5 μg/mL)做阳性对照,37 ℃培养48 h后收集培养上清,-80 ℃保存备用,测定细胞因子的浓度。
2结果
2.1重组质粒DREP-LipoEDIII构建将空质粒DREP的结构基因CE1E2用目的基因LipoEDIII替换构建重组质粒DREP-LipoEDIII。
2.2LipoEDIII基因的PCR扩增及克隆酶切鉴定
PCR产物电泳检测结果显示1条大约1 500 bp的DNA片段,与拟扩增基因片段的大小相符,见图2A。重组质粒DREP-LipoEDIII经过酶BcuI和酶SmaI双酶切后,也可得到一条大小约为1 500 bp的DNA片段,见图2B。结果表明重组质粒DREP-LipoEDIII构建成功。
2.3重组质粒DREP-LipoEDII的转染和蛋白表达

图1 重组质粒DREP-LipoEDIII构建示意图
Fig.1Schematic diagram of the recombinant plasmid DREP-LipoEDIII

A: PCR扩增LipoEDIII基因;M: DL2502 DNA标志物;1:阴性对照;2,3:目的基因LipoEDIII
B:重组质粒DREP-LipoEDIII双酶切鉴定;M: DL2503 DNA 标志物 1:DREP-LipoEDIII/BcuI-SmaI
A: PCR amplification of LipoEDIII gene; M: DL2502 DNA marker; 1: Negative control; 2, 3: LipoEDIII gene;
B: Identification of recombinant plasmid DREP-LipoEDIII by restriction enzyme;
M: DL2503 DNA marker; 1: DREP-LipoEDIIIdigested by BcuI and SmaI.
图2LipoEDIII基因的扩增和鉴定
Fig.2Amplification and identification of LipoEDIII gene
检测按照LipofectaminTM2000操作说明,将重组质粒DREP-LipoEDIII和空质粒DREP分别转染到293细胞中,48 h后收集细胞,通过Western blot检测重组质粒在293细胞中的表达。LipoEDIII重组蛋白大小约为48 Kd,Western Blot结果显示构建的重组质粒DREP-LipoEDIII能够在293细胞中成功表达,且表达的蛋白能被质粒免疫的小鼠血清所识别,如图3A所示。同时,利用通过大肠杆菌表达系统制备的登革病毒四价EDIII重组蛋白TetEDIII也能被质粒免疫的小鼠血清所识别,如图3B所示。
2.4抗体的产生水平及动态观察不同时间对注射了重组质粒DREP-LipoEDIII,空质粒DREP及注射PBS磷酸盐缓冲液的各8只小鼠取血,分离血清,用间接ELIAS法检测抗体产生水平。结果显示注射了重组质粒的小鼠抗体效价随时间延长而不断升高,第3次免疫后达高峰并能维持一段时间,抗体效价为1∶160,如图4。
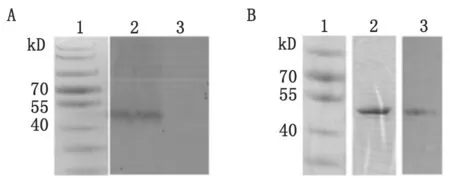
A.Western Blot检测重组质粒DREP-LipoEDIII在293细胞中的表达,一抗为DREP-LipoEDIII质粒免疫小鼠的血清;1:蛋白分子量标准; 2:转染重组质粒DREP-LipoEDIII的293细胞的样品; 3:转染空质粒DREP的293细胞的样品
B.DREP-LipoEDIII质粒免疫小鼠的血清对登革病毒四价EDIII重组蛋白TetEDIII的识别;1:蛋白分子量标准; 2:通过大肠杆菌表达系统制备并纯化的TetEDIII蛋白;3:Western Blot检测重组质粒免疫小鼠血清对纯化的TetEDIII蛋白的识别,一抗为DREP-LipoEDIII质粒免疫小鼠的血清
A: The expression identification of recombinant plasmids DREP-LipoEDIII in 293 cells; 1: Protein molecular weight marker; 2: Cell samples transfected with plasmid DREP-LipoEDIII; 3. Cell samples transfected with plasmid DREP.
B: The recognition of recombinant TetEDIII derived fromE.coliexpression system by using the serum of DREP-LipoEDIII immunized mouse; 1: Protein molecular weight marker; 2: Purified TetEDIII protein by SDS-PAGE; 3: Western Blot identification of TetEDIII protein by the serum of DREP-LipoEDIII immunized mouse.
图3LipoEDIII蛋白的表达和鉴定
Fig.3Expression and identification of Lipo EDIII protein

重组质粒DREP-LipoEDIII诱导小鼠产生抗体于第2次加强免疫是抗体效价明显升高达1∶80,第3次加强免疫之后达高峰,抗体效价为1∶160并维持一段时间。
图4重组质粒DREP-LipoEDIII免疫小鼠抗体效价检测
Fig.4Changes of antibody titers in mice immunized with recombinant plasmid DREP-LipoEDIII
2.5细胞因子检测脾淋巴细胞培养48 h后收集上清测定细胞因子IFN-r,IL-4和IL-10。 其中,与空质粒DREP免疫组和PBS免疫组相比,重组质粒DREP-LipoEDIII免疫组均能诱导较高水平的IFN-r,IL-4和IL-10,分别为57 pg/mL, 22 pg/mL和120 pg/mL,如图5A,5B,5C所示, 说明重组质粒DREP-LipoEDIII可诱导小鼠产生较强的细胞免疫应答,包括Th1和Th2反应。

重组质粒DREP-LipoEDIII免疫组,空质粒DREP免疫组和PBS免疫组小鼠脾淋巴细胞分别用重组蛋白LipoEDIII,刀豆素(ConA)和细胞培养液刺激后,检测细胞因子IFN-r(A),IL-4(B),IL-10(C)的分泌情况
The mice spleen lymphocytes of recombinant plasmid DREP-LipoEDIII group, plasmid DREP group and PBS group were stimulated respectively by dengue LipoEDIII recombinant protein, ConA and media to detect IFN-r, IL-4, and IL-10.
图5免疫小鼠细胞因子检测
Fig.5Cytokine detection of immunized mouse
3讨论
到目前为止,尚未研制出安全有效的登革疫苗来预防此疾病的发生[11-12]。DNA疫苗是近年出现的一种新型疫苗,现已成为病毒疫苗研究的热点[13]。由于DNA疫苗诱导的免疫应答往往不够理想,所以通过优化免疫方案来提高质粒DNA的免疫原性就成为目前DNA疫苗的研究热点。本研究首先通过融合免疫佐剂脂质体蛋白提高质粒DNA的免疫原性,其次,通过电刺激的方法提高质粒DNA的吸收效率从而提升质粒DNA的免疫原性[14]。
在DNA免疫中,研究者大多采用肌肉注射的方法进行免疫,由于肌细胞吸收DNA的效率较低,所以免疫应答往往不够理想。目前,电击技术在体外已被广泛应用,主要用于将DNA导入真核细胞和细菌中,它主要是将短的电脉冲作用于靶细胞,穿透细胞膜,以便有利于细胞吸收DNA。在最近的研究中发现,体内组织如果加上电场也可以显著提高DNA的吸收效率[15-16]。因此,我们每次注射质粒DNA后,立刻对注射部位进行电刺激,以提高肌细胞对质粒DNA的摄入效率,从而增强质粒DNA的免疫原性。
本研究使用的是甲病毒载体DREP,甲病毒是一类RNA病毒,能够在宿主细胞的胞质内大量复制[17]。甲病毒载体是用外源基因替换结构蛋白基因的载体,仍具有甲病毒的宿主感染谱广泛、能够自我复制、诱导被转染细胞发生凋亡等众多生物学特性,同时能够大量表达外源基因,激发机体产生高效的免疫反应,并不易与宿主基因组整合。因此,质粒DNA进入细胞后能够自我复制,提高DNA的表达效率[18]。
与混合的重组疫苗相比,单一的多价疫苗具有成本低等优点。因此,本研究采用将登革病毒1-4型的EDIII基因连接在一起,构建四价登革病毒疫苗,从而更好的发挥免疫保护作用[19]。
本研究所构建的融合免疫佐剂Lipo多肽与包膜蛋白EDIII区的登革病毒四价疫苗在小鼠体内具有较好的免疫原性,可以诱导小鼠产生体液免疫和细胞免疫,不仅诱导Th1反应而且还诱导Th2反应,为新型登革病毒疫苗的研究奠定了基础。
参考文献:
[1]Qadir MI, Abbas K, Tahir M, et al. Dengue fever: natural management[J]. Pak J Pharm Sci, 2015, 28(2): 647-655.
[2]Chiang C, Pan C, Hsieh C, et al. Lipidated dengue-2 envelope protein domain III independently stimulates long-lasting neutralizing antibodies and reduces the risk of antibody-dependent enhancement[J]. PLoS Negl Trop Dis, 2013, 7(9): e2432.
[3]Kirkpatrick BD, Durbin AP, Pierce KK, et al. Robust and balanced immune responses to all 4 dengue virus serotypes following administration of a single dose of a live attenuated tetravalent dengue vaccine to healthy, flavivirus-naive adults[J]. J Infect Dis, 2015, pii: jiv082.
[4]Ahmed NH, Broor S. Dengue fever outbreak in delhi, north India: a clinico-epidemiological study[J]. Indian J Community Med, 2015, 40(2):135-138.
[5]White LJ, Sariol CA, Mattocks MD, et al. An alphavirus vector-based tetravalent dengue vaccine induces a rapid and protective immune response in macaques that differs qualitatively from immunity induced by live virus infection[J]. J Virol, 2013, 87(6): 3409-3424.
[6]Fahimi H, Allahyari H, Hassan ZM, et al. Dengue virus type-3 envelope protein domain III; expression and immunogenicity[J]. Iran J Basic Med Sci, 2014, 17(11): 836-843.
[7]Mota J, Acosta M, Argotte R, et al. Induction of protective antibodies against dengue virus by tetravalent DNA immunization of mice with domain III of the envelope protein[J]. Vaccine, 2005, 23(26): 3469-3476.
[8]Chianga C, Hsieha C, Chena M, et al. Recombinant lipidated dengue-4 envelope protein domain III elicitsprotective immunity[J]. Vaccine, 2014, 32(12): 1346-1353.
[9]Prompetchara E, KetloyC, Keelapang P. Induction of neutralizing antibody response against four dengue viruses in mice by intramuscular electroporation of tetravalent DNA vaccines[J] PLoS One, 2014, 9(6): e92643.
[10]Zhang ZS, Weng YW, Huang HL, et al. Neutralizing antibodies respond to a bivalent dengue DNA vaccine or/and a recombinant bivalent antigen[J]. Mol Med Rep, 2015, 11(2): 1009-1016.
[11]Domingo C, Alves MJ, de Ory F, et al. International external quality control assessment for the serological diagnosis of dengue infections[J]. BMC Infect Dis, 2015, 15(1): 167-174.
[12]Wei J, Chen H, An J. Recent progress in dengue vaccine development[J]. Virol Sin, 2014, 29(6): 353-363.
[13]Ghosh A, Dar L. Dengue vaccines: challenges, development, current status and prospects[J]. Indian J Med Microbiol, 2015, 33(1): 3-15.
[14]Johansson DX, Ljungberg K, Kakoulidou M, et al. Intradermal electroporation of naked replicon RNA elicits strong immune responses[J]. PLoS One, 2012, 7(1): e29732.
[15]Chen H, Wen B, Deng Y, et al. Enhanced effect of DNA immunization plus in vivo electroporation with a combination of hepatitis B virus core-preS1 and S-preS1 plasmids[J]. Clin Vaccine Immunol, 2011, 18(11): 1789-1795.
[16]Zhao Y, Zheng Z, Cohen CJ, et al. High-efficiency transfection of primary human and mouse T lymphocytes using RNA electroporation[J]. NIH Public Access, 2006, 13(1): 151-159.
[17]Knudsen ML, Ljungberg K, Tatoud R, et al. Alphavirus replicon DNA expressing HIV antigens is an excellent prime for boosting with recombinant modified vaccinia Ankara (MVA) or with HIV gp140 protein antigen[J]. PLoS One, 2015, 10(2): e0117042.
[18]Zhou P, Nie K. The research progress of Alphavirus vector[J]. Chin J Bilogicals, 2006, 19(4): 430-434. (in Chinese)
周鹏,聂奎.甲病毒载体研究进展[J].中国生物制品学杂志,2006,19(4):430-434.
[19]Apt D, Raviprakash K, Brinkman A, et al. Tetravalent neutralizing antibody response against four dengue serotypes by a single chimeric dengue envelope antigen[J]. Vaccine, 2006, 24(3): 335-344.
DOI:10.3969/j.issn.1002-2694.2016.02.004
通讯作者:刘文权,Email:liuwq101@wzmc.edu.cn
Corresponding author:Liu Wen-quan, Email: liuwq101@wzmc.edu.cn
中图分类号:R373
文献标识码:A
文章编号:1002-2694(2016)02-0119-05
收稿日期:2015-05-18;修回日期:2015-11-23
Construction of fusion immunoadjuvants Lipo peptides and envelope protein EDIII dengue virus tetravalent vaccine and its immune effect
REN Shou-feng,CAO Guo-mei,TAN Feng,LIANG Shao-hui,LIU Wen-quan,PAN Chang-wang
(Department of Human Parasitology, School of Basic Medical Science, Wenzhou Medical College, Wenzhou 325035, China)
Abstract:We constructed a recombinant tetravalent DENV alphavirus vaccine coding of immunoadjuvants Lipo peptides and dengue virus type 1-4 envelope protein EDIII zone and studied its immune response in mice. Firstly, the gene sequence encoding immunoadjuvants Lipo and the gene sequence encoding dengue virus type 1-4 envelope protein EDIII zone was connected by GS linker to obtain LipoEDIII. Then, the gene LipoEDIII was inserted into the multiple cloning site of the alphavirus vector DREP to construct the recombinant alphavirus vector DREP-LipoEDIII. Furthermore, the 293 cells were transfected with the recombinant alphavirus vector DREP-LipoEDIII, the fusion protein expression was detected by Western blot. At last, the ICR mice were immunized with DREP-LipoEDIII without any adjuvant. The antibody titers in serum and the secretion of cytokines were detected by ELISA after the twice booster to evaluate the immune response. The mice immunized with DREP-LipoEDIII could induce specific antibodies and the antibody titer was 1∶160. The mouse spleen lymphocytes stimulated by antigen could produce cytokine including IFN-r, IL-4, IL-10, which were significantly higher in the experimental group. Our studies indicates that the tetravalent DENV alphavirus vaccine containing the fusion Lipo peptides can induce specific humoral and cellular immune responses in mice without adding any exogenous adjuvant, which laid the foundation for the research of novel tetravalent dengue virus vaccine in the future.
Keywords:dengue virus; envelope protein; alphavirus vector; tetravalent vaccine
浙江省自然科学基金项目(No.LY13C080001)资助
Supported by the Natural Science Project of Zhejiang Province (No. LY13C080001)
