不同马铃薯品种(系)对增强UV-B辐射的形态响应*
2016-07-25牛金文肖继坪郭华春云南农业大学农学与生物技术学院昆明650201
李 俊 牛金文 杨 芳 肖继坪 郭华春(云南农业大学农学与生物技术学院 昆明 650201)
不同马铃薯品种(系)对增强UV-B辐射的形态响应*
李 俊 牛金文 杨 芳 肖继坪 郭华春**
(云南农业大学农学与生物技术学院 昆明 650201)
摘 要UV-B辐射对植物的形态建成有着重要的作用, 并且随着地表UV-B辐射的加剧也必将对作物产生影响。本研究通过测定株高、节距、叶面积和根冠比等几个重要的形态指标, 分析在增强UV-B辐射条件下马铃薯不同品种的形态响应差异, 为综合评价UV-B辐射对马铃薯的影响和耐受性品种选育奠定基础。试验以4个普通和3个彩色马铃薯品种(系)为材料, 采用自然光照(CK)和2个增强的UV-B辐射[2.5 kJ·m-2·d-1(T1)、5.0 kJ·m-2·d-1(T2)]进行处理, 分别于处理15 d、30 d和45 d时测定株高、节距、叶面积和比叶重, 收获时测定根冠比。最后得出几个形态指标的响应指数(RI), 并以累积胁迫响应指数(CSRI)对试验品种的耐受性做出评价。结果显示:在增强UV-B辐射处理后, 多数品种呈现株高降低、节距缩短、叶面积减小、比叶重增加的一致性变化趋势, 且随着处理强度的增加和时间延长, 处理与对照间的差异愈加显著。各品种对UV-B辐射的形态响应存在显著差异, 普通品种的株高、节距、叶面积受UV-B辐射抑制较为明显, 地上部分的生物量减幅较大, 如‘合作88’地上部分(鲜重)RI值在T1、T2处理下分别为-60.28、-70.44, ‘丽薯6号’则为-58.61、-66.44; 彩色品种受到的影响较小, ‘转心乌’地上部分RI值分别为107.75、21.4, ‘21-1’为41.49、-45.72。随着地上生物量增长受到显著抑制, 地下部分特别是根系也受到明显的影响, 普通与彩色品种间根系RI值的变化规律与地上部分一致。由于地上部分生物量的减幅更显著, 各品种(系)的根冠比均比对照增大(T2)。T1、T2处理下5个品种的CSRI值显示‘合作88’(-133.35、-240.85)与‘丽薯6号’(-104.09、-160.2)在增强的UV-B辐射处理下形态特征受到了显著的抑制; 彩色品种(系)‘转心乌’(275.97、51.26)、‘21-1’(96.8、-142.17)比普通品种‘合作88’、‘丽薯6号’受到的影响相对较小, 显示具有一定的UV-B辐射耐受性。
关键词UV-B辐射 马铃薯 形态响应 彩色品种 非彩色品种
马铃薯(Solanlum tuberosum L.)与小麦(Triticum aestivum L.)、水稻(Oryza sativa L.)、玉米(Zea mays L.)统称为四大粮食作物, 是世界各地食物结构中重要的碳水化合物来源。其块茎含有的蛋白、维生素C、膳食纤维及彩色品种的花色苷对人体健康有重要意义, 是世界上重要的栽培作物之一[1]。如今, 全球气候的恶化导致温室效应加剧、臭氧层变薄等, 这些环境因子的显著变化对地球生物产生的影响已引起人们密切关注[2-4]。其中, 臭氧层的衰减导致到达地表的紫外辐射显著增加, 280~320 nm波段的UV-B辐射对植物形成了较强的胁迫作用[5], 因此, 研究UV-B辐射增强的环境因子变化对作物产生的综合效应具有重要意义。UV-B辐射对作物的影响早已引起人们关注, 可引起作物形态、生理、信号转导和基因表达等多个方面发生变化[6-8]。近年来的研究使人们认为UV-B辐射不仅是一个胁迫因子, 可能更多地作为一个信号分子参与植物的形态建成、生理代谢、细胞程序性凋亡等[9], 并影响到细胞结构与分裂[10]。对外部形态来说, UV-B辐射破坏了生长素的极性运输, 茎的伸长受到抑制, 叶片卷曲, 厚度增加, 顶端优势丧失[11]。在不同强度的增强UV-B辐射处理后, 各种植物均表现出明显的症状。如木本植物株高和地径生长受到抑制[12-15], 豇豆(Vigna unguiculata L. Walp.)在增强UV-B辐射处理后, 植株高度及花的长度均降低[16]; 三色苋(Amaranthus tricolor L.)的株高、叶面积和相对生长速率等生长指标均下降[17]。此外, UV-B辐射对于植物的水分代谢也具有显著影响, 通过抑制植物地上部分光合产物合成以及光合产物向根系的运输分配, 影响根系发育,对根系活力产生不利影响[18]。
在世界主要栽培作物中, 以小麦、水稻、玉米等谷类作物为UV-B辐射研究对象的最多, 这些主要作物在增强辐射处理下, 生长发育均受到明显抑制[19-21]。现已知水稻对UV-B辐射的响应存在明显的基因型差异, 而这种响应差异是可遗传的数量性状[22]。多个不同品种的小麦在低剂量的UV-B辐射下株高受到抑制, 高剂量的UV-B辐射则抑制了株高和鲜重等生长的大部分参数指标, 而且这种响应存在明显的种间差异[23]。
目前, 以马铃薯为主的薯类作物相关研究较少[24],大田条件下长期UV-B辐射增强对马铃薯植株产生的形态效应未见详细报道。早期曾有学者将马铃薯归入耐受UV-B辐射的作物[25], 但在模拟50%臭氧层衰减的UV-B辐射量处理试验中, 发现6个马铃薯品种间具有显著的敏感特异性[26]。而短时间增强UV-B辐射即可引起马铃薯形态上的响应, 如在8 d UV-B照射后马铃薯叶面积减小, 叶片干重和厚度增加[27]。这些都显示马铃薯在增强UV-B辐射逆境胁迫下, 与其他植物(作物)一样也会引起形态特征的响应及品种间存在响应差异。同时, 由于UV-B辐射对光合作用有显著伤害作用[28], 削减同化物向库器官的输出, 影响花粉活力及受精作用, 从而降低作物的产量和品质[29-31]。在UV-B辐射对马铃薯生理生化指标影响的前期研究中, 揭示了彩色马铃薯品种在增强的UV-B辐射环境下比普通品种有更强的适应性[32-33]。因此, 在这一难以逆转的全球气候变化趋势下, 本研究将以3个彩色和4个普通马铃薯品种为材料, 进一步从形态指标上分析增强UV-B辐射对马铃薯不同品种的形态效应及品种间是否存在响应差异, 为综合评价UV-B辐射对马铃薯的影响和耐受性品种选育奠定基础。
1 材料和方法
1.1 试验地及试验品种
试验地位于云南省昆明市北郊(25°08′N, 102°45′E)云南农业大学后山试验农场, 海拔1 966 m, 年平均温度15.1 ℃, 年降雨量1 000 mm。全年无霜期341 d。降水以降雨为主。一年内干湿季分明, 年平均蒸发量为175.1 mm, 平均相对湿度为74%。土壤为偏酸性红壤, 肥力中等, 排灌方便。试验材料为7个马铃薯品种(系), 其中普通品种(系)4个: ‘合作88’、‘丽薯6号’、‘剑川红21-3’、‘青薯9号’, 彩色品种(系)3个: ‘剑川红21-1’、‘师大6号’和‘转心乌’。
1.2 试验设计
本研究于2014年3—10月进行。于2014年3月初对试验地进行深翻整平、种薯准备, 试验材料采用大号花盆种植(花盆外径0.38 m, 内径0.31 m,高度0.3 m, 底部直径0.27 m, 体积约为0.02 m3), 栽培基质为土壤和腐殖土按1∶1比例混匀装盆, 按当地中上生产水平施底肥。花盆随机排列, 每盆于盆中央播种萌芽种薯1个, 每个品种种植60株(60盆),分为3个小区, 每小区20株。小区内每株(盆)紧挨放置, 株间距约为0.75 m, 各小区间留有过道, 宽约0.8 m, 共21个小区。待苗期长齐后高度约0.2 m时开始进行试验处理(5月中旬)。
本试验在大田搭建铁丝, 采用户外防雨灯架安装紫外灯, 紫外灯源采用南京华强电子有限公司生产的紫外灯管(UVB-40), 波长范围280~320 nm, 辐照强度以灯光至冠层高度和灯管数调节, 以北京师范大学光电仪器厂生产的UV-B型紫外辐照计测量辐照强度。电线套上PVC管以防雨水, 灯管可随植株的生长高度进行调整, 同时对照组也安装空灯架以使处理和对照间的自然光照条件一致。
处理时从每个品种选取长势相近的45株, 每小区15株, 每个处理为5株, 3次重复。按照灯管长度于其正下方放置3盆植株, 分成3行排列。通过灯管高度调节辐照强度(以植株冠层计), 用辐照计测定297 nm波长处的辐射强度。试验设3个处理, 辐射剂量2.5 kJ·m-2·d-1为处理1(1根灯管, T1)、辐射剂量5.0 kJ·m-2·d-1为处理2(2根灯管, T2)、自然光照射为对照(CK)。于5月14日进行UV-B辐射处理,每天10:00—15:00进行5 h的辐照处理(阴雨天除外)。处理期间每周随植株高度调整灯管至冠层保持0.5 m距离, 以保证冠层叶片接受的照射量不因植株的生长而改变, 同时花盆旋转90°保证植株接受辐照的均匀性。分别在处理15 d、30 d和45 d时进行形态指标各数据测量, 整个马铃薯生育期增强UV-B辐射处理时间为50 d。
1.3 形态指标测定与分析
株高与节距: 以卷尺测量盆边缘到植株冠层的垂直高度作为株高(n=14), ‘师大6号’在处理45 d时植株已经黄化倒伏, 并未测定株高。对处理的每盆植株选取两根主茎, 自茎尖向下, 从明显能分出第一节间开始, 用直尺向下量取5个节距记录下每节长度。
叶面积: 以每个品种的空白处理植株采用系数法测定实际叶面积[34], 按照倒3、4叶位每株选取4~5片共50叶片进行测定(这些剪取叶片的空白植株不进行其他形态指标测定)。得到叶面积矫正系数后, 其余处理则使用直尺在植株上测量相同叶位叶片的长和最大宽, 长宽积乘以矫正系数K即得实际叶面积(n=50)。
比叶重的测定: 使用打孔法测定。田间选取具有完全生理功能, 处理症状明显的植株剪取倒3、倒4叶, 每个处理或对照选取15片(每盆选1片), 用打孔器(r=0.4 cm)避开主叶脉在每个叶片大致相同的位置上取下叶圆片, 每个处理取30~50个叶圆片。用培养皿装好并贴上各组标签, 放入80 ℃恒温箱烘干至恒重, 次日取出用千分之一电子天平称量出各组重量W(0.001 g)。按比叶重(SLW)=W/(3.14×r²× 10)×100%计算。各个品种的比叶重变化情况分别以15 d、30 d和45 d 3个时期测定值进行比较分析。
根冠比的计算: 收获时齐根际剪断, 主根、须根和块茎全部计为地下部分, 根际以上的主茎、分枝和叶片计为地上部分, 分别进行称重, 按根冠比(R/T)=地下部分质量/地上部分质量计算, 各品种(系)各测定7株。‘21-3’和‘师大6号’由于早衰和提前成熟原因收获时地上部分已经干枯, 因此并未对其进行统计, 只测定了其余5个品种的根冠比。
响应指数(response index, RI)按照RI=(T-CK)/ CK×100%进行计算, 以各个响应指数相加得到的和作为累积胁迫响应指数(cumulative stress response index, CSRI), 综合评价几个处理品种在UV-B辐射的形态响应变化[23]。株高、节距、叶面积的响应指数为3个处理时期的平均值, ‘21-3’和‘师大6号’未测根冠比, 因此没有CSRI值。
1.4 统计分析
利用Microsoft Excel 2007统计试验数据, 以SPSS 19.0进行单因素ANOVA分析和LSD多重比较, 分析不同处理间的差异显著性(P<0.05)。
2 结果与分析
2.1 增强UV-B辐射对马铃薯株高的影响
本次试验是在幼苗长至0.2 m时才开始增强的紫外辐射处理, 因此对马铃薯株高的影响表现出一定的时间效应。从表1可以看出, 在处理15 d后各品种的株高与对照相比并没有出现明显变化, 但在处理30 d后植株的高度与对照相比逐渐出现变矮的趋势。除‘转心乌’外, 其余6个品种(系)的植株高度随处理强度增加依次降低, 其中‘合作88’、‘丽薯6号’、‘21-1’和‘青薯9号’4个品种的处理强度T2与对照间的差异显著(P<0.05)。在处理45 d后, 随着植株生长势的加强, 植株高度多数较前期增加, 除‘21-3’外, 呈现的趋势依旧是处理后植株高度比对照降低, 其中‘合作88’和‘丽薯6号’2个处理强度与对照间有明显差异(P<0.05)。
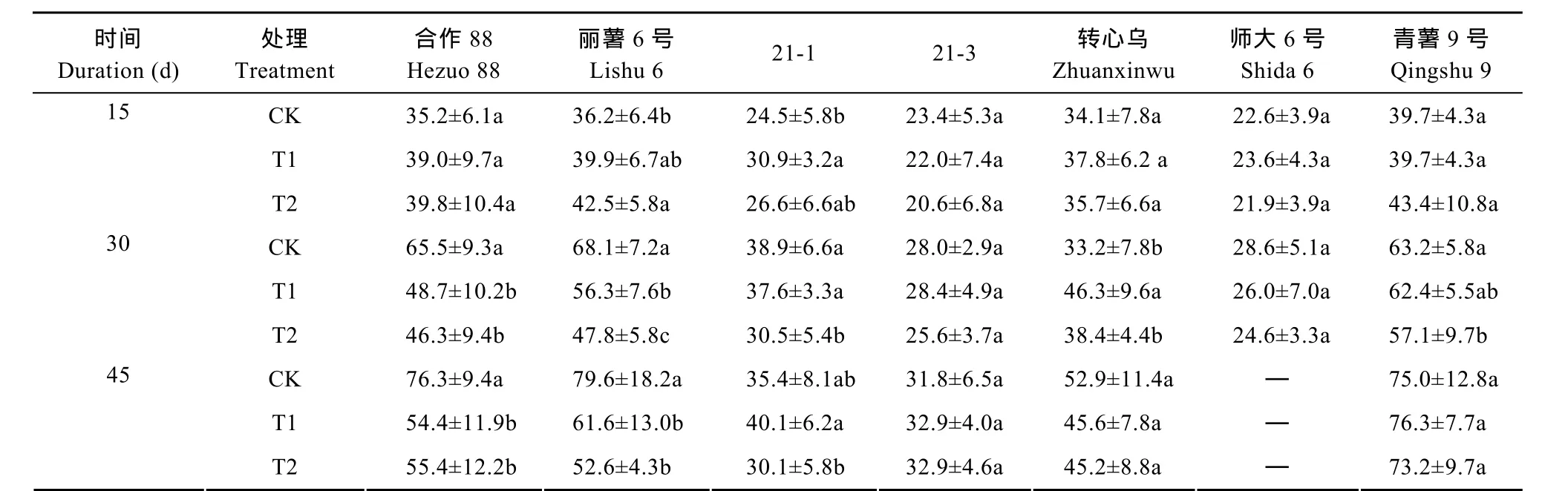
表1 不同UV-B辐射处理下马铃薯各品种(系)的株高变化Table 1 Variation of plant height of each potato variety (line) under different UV-B radiation treatments cm
2.2 增强UV-B辐射对马铃薯节距的影响
在增强的UV-B辐射处理后, 各处理品种的植株高度多出现下降趋势, 这种变化规律也表现在节距的变化上。由表2可以看出, ‘合作88’、‘丽薯6号’、‘21-1’3个品种在3个处理时期的变化规律较为一致, 处理后植株的节距与对照相比均显著变小,其中‘合作88’在2个处理时期(30 d和45 d)时不同处理强度间有显著的差异(P<0.05)。‘转心乌’和‘师大6号’在处理30 d时处理与对照差异不显著, 但在15 d、45 d时处理与对照相比间节距明显变小; ‘21-3’和‘青薯9号’则均在处理30 d时处理植株的节距显著下降, 在15 d、45 d时节距没有明显差异。
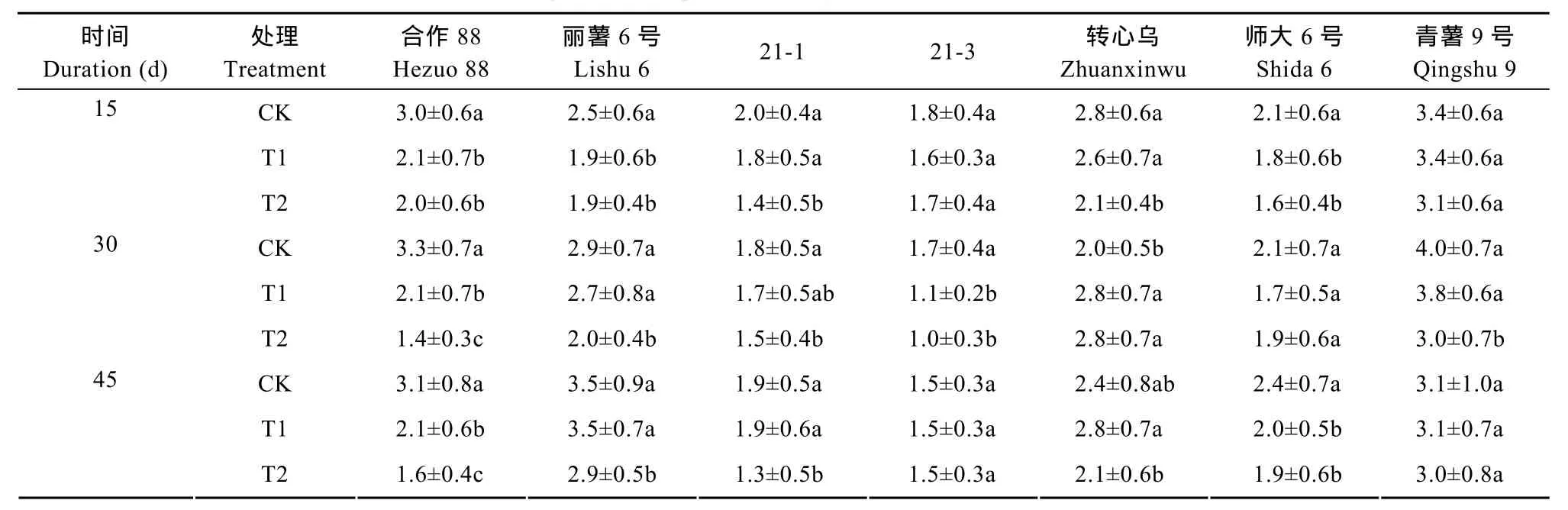
表2 不同UV-B辐射处理下马铃薯各品种(系)的节距变化Table 2 Variation of internode length of each potato variety (line) under different UV-B radiation treatments cm
2.3 增强UV-B辐射对马铃薯叶面积的影响
在增强的UV-B辐射处理下, 各处理品种(系)的植株高度、节距均呈下降趋势, 从表3可以看出叶片作为接受辐射最多的器官, 受到的影响也最为显著。7个试验品种在处理后叶面积均表现为减小, 除了‘21-3’外, 其余品种(系)在对照和处理、2个处理强度间多数都有显著的差异。‘合作88’、‘丽薯6号’、‘青薯9号’在处理30 d后叶面积的减幅即达到50%以上, 而在处理45 d以后除‘21-3’外的6个品种(系)在 T2处理强度下均达到 50%以上的减幅, 其中‘合作 88’和‘丽薯 6号’下降幅度最大,分别达到 67.6%和 66.0%。同时由表 3也可知,‘21-3’在所有品种(系)中叶面积受到的抑制最低,减幅也最小。叶片较大的品种如‘合作88’(10.8 cm2,45 d)、‘丽薯 6号’(9.7 cm2, 45 d)和‘青薯 9号’(10.2 cm2, 45 d)与叶片较小的‘21-3’(3.1 cm2, 45 d)相比, 受到增强辐射的影响更为显著, 叶面积的减幅也更大。

表3 不同UV-B辐射处理下马铃薯各品种(系)的叶面积变化Table 3 Variation of leaf area of each potato variety (line) under different UV-B radiation treatments cm2·leaf-1
2.4 增强UV-B辐射对马铃薯叶片比叶重的影响
在增强辐射下, 叶片的伸展受到抑制, 叶片趋于增厚。在对 3个时期比叶重分别测定后, 可以看出各品种(系)的比叶重在处理后与对照相比具有差异, 多表现出增加的趋势, 但并未达到显著水平(图1)。‘合作88’、‘丽薯6号’、‘21-1’和‘青薯9号’在处理后比叶重均增加,其中‘合作88’和‘丽薯6号’的增幅最大, 分别达24.07%(T2)和28.67%(T1), ‘青薯9号’的T1处理增幅也达到了11.44%, ‘21-1’则呈小幅度增加。‘21-3’和‘师大6号’在T1出现下降并在T2随后增加, ‘转心乌’在处理后都比对照的比叶重要小。
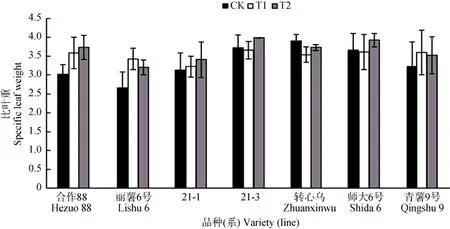
图1 不同UV-B辐射处理下马铃薯各品种(系)的比叶重变化Fig. 1 Variation of specific leaf weight of each potato variety (line) under different UV-B radiation treatments
2.5 增强UV-B辐射对马铃薯生物量及根冠比的影响
由表 4可以看出, 位于地下的马铃薯根系虽未受到直接的 UV-B辐射, 但也可能受到地上部分生物量减少带来的负面影响。‘合作88’、‘丽薯6号’、‘青薯9号’3个品种在处理后根系重量均下降, 特别是前2个品种根系的减幅更大。‘21-1’和‘转心乌’受到的影响则不明显, 根系量反而还略有增加。对地下块茎来说, 其发育时间要晚于根系, 因此受到的影响并不显著, 平均单株产量在不同处理强度下与对照相比既有增加也有减少, 波动幅度较大。而地上部分由于直接受到增强UV-B的照射, 生物量的减幅较大, 其中‘合作88’、‘丽薯6号’、 ‘21-1’和‘青薯9号’在T2处理强度下比对照生物量减少分别达到70.44%、66.44%、45.72%和32.01%, 只有‘转心乌’的地上生物量没有减少。以上结果可以看出, 由于地下部分比地上部分受到的影响要小的多, 因此各品种(系)的根冠比在接受增强UV-B照射后均表现为增大, 其中‘合作88’和‘丽薯6号’在T2处理下与对照相比均有显著差异(P<0.05)(表4), 分别增加2.15倍和1.44倍。

表4 不同UV-B辐射处理下马铃薯各品种(系)的生物量鲜重及根冠比变化Table 4 Variation of biomass (FSW) and root-shoot ratio (R/T) of each potato variety (line) under different UV-B radiation treatments
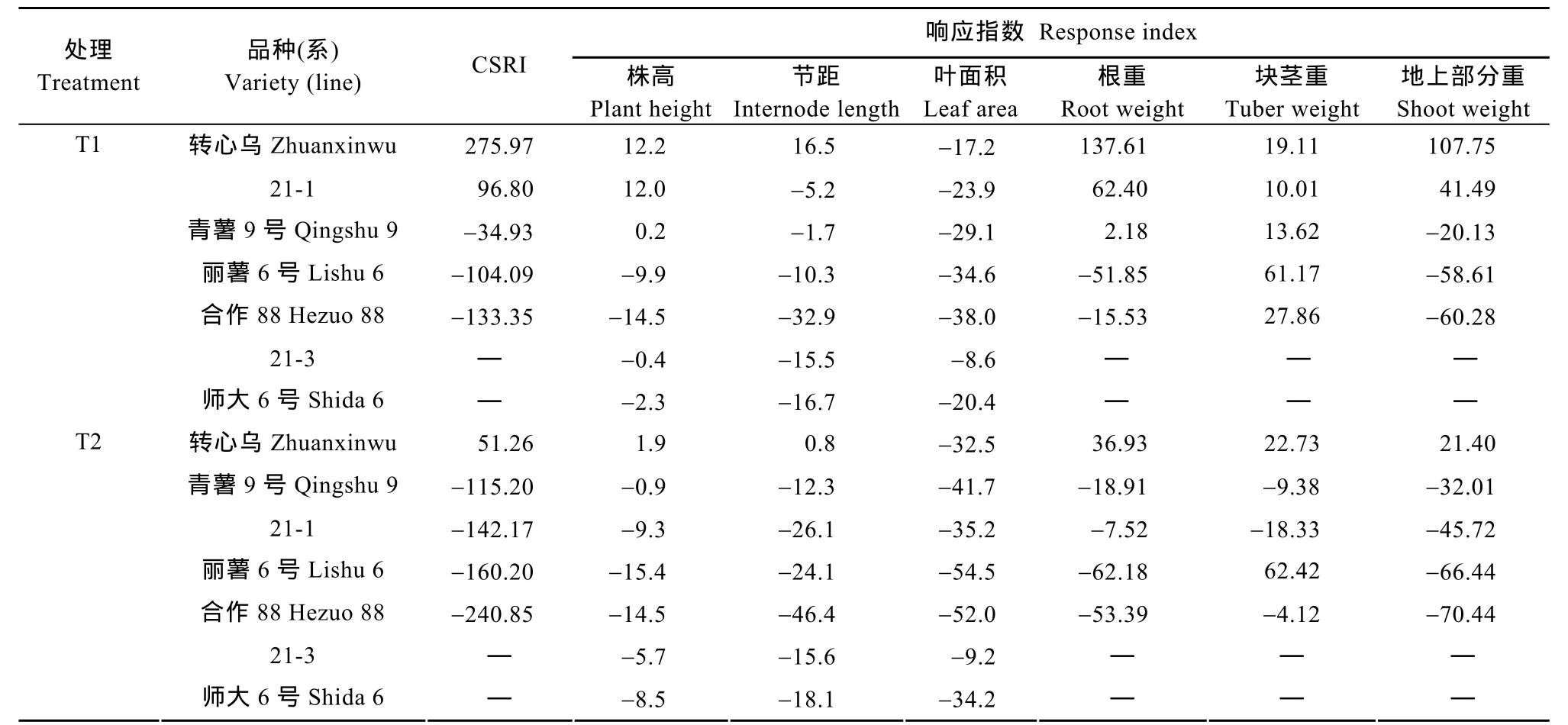
表5 不同UV-B辐射处理下马铃薯各品种(系)的累积胁迫响应指数(CSRI)和各形态指标的响应指数Table 5 Cumulative stress response index (CSRI) and stress response index of each morphological indicator of each potato variety (line) under different UV-B radiation treatments
2.6 增强UV-B辐射下各品种的响应指数及相关系数
在对各马铃薯品种的地上和地下形态指标进行响应指数分析后, 可看出各主要形态特征在增强的UV-B辐射下都不同程度地受到了抑制, 其抑制作用随辐射的增强愈加明显(表5)。在这6个指数中叶面积指数在2个处理强度下均为负值, 显示各品种在受到辐射时叶片的一种趋同适应特征。其余5个指数既有正值也有负值, 但以负值居多, 特别是随辐射强度增加, 负值出现比例增加,绝对值更大,显示受到的抑制效果愈加明显。明显的是, 不同品种在增强辐射下的形态响应具有显著的种间差异。5个品种中, ‘转心乌’的累积胁迫响应指数(CSRI)在2个处理下均为正值, ‘21-1’在T1处理下为正值, T2处理则为负值; 其余3个品种2个处理都是负值, 特别是‘丽薯6号’和‘合作88’其负值的绝对值均较大, 说明增强UV-B辐射对这2个品种的影响较大。
从表6可以看出, 不同处理下CSRI与各形态指标响应指数的相关性具有明显的差异。在T1处理下,CSRI分别与叶面积、根重、地上部分3个指数具有极显著相关性(P<0.01), 与株高具有显著相关性(P<0.05)。T2处理下, CSRI只与地上部分指数具有极显著相关性(P<0.01), 与节距和根重具有显著相关性(P<0.05)。各指数间的联系主要表现为叶面积与株高、节距、根重和地上部分有极显著或显著相关性(T1), 在T2时仅与根重显著相关; 而地上部分指数则与株高、根重、叶面积(T1)、节距(T2)具有极显著或显著相关性。
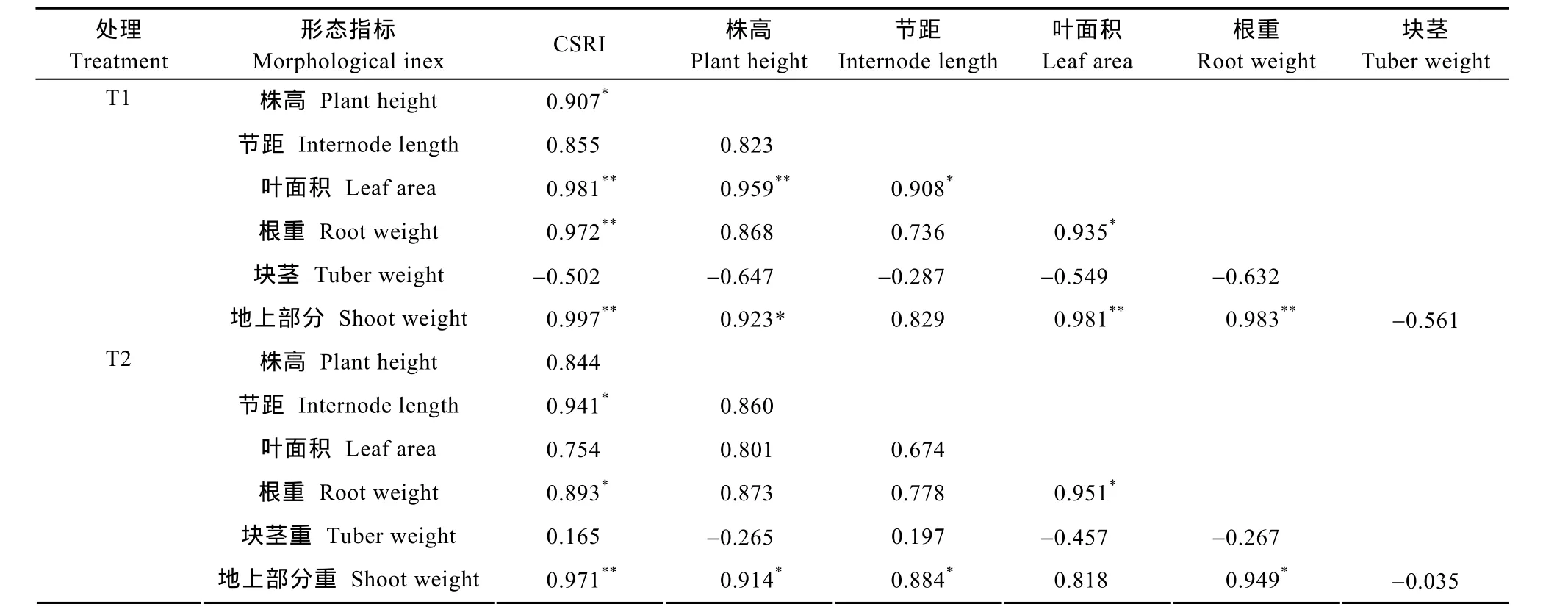
表6 不同UV-B辐射处理下马铃薯各形态指标响应指数间及与累积胁迫响应指数(CSRI)的相关性Table 6 Correlation coefficients among stress response indexes of tested indicators and cumulative stress response index (CSRI)under different UV-B radiation treatments
3 讨论和结论
处于逆境中的植物通常以抑制细胞伸长、刺激局部细胞分裂和改变细胞分化状态来调整外部形态,以此策略减少逆境胁迫暴露, 称为‘逆境诱导形态响应’(stress-induced morphogenic response, SIMR)[35]。本研究表明, 在增强的UV-B辐射下, 各马铃薯品种(系)的植株形态与自然光照射相比均有显著的变化,表现出株高降低、节距变短、叶面积下降、叶片厚度(比叶重)增加的典型UV-B辐射胁迫效应[11,24,36]。因此, 本研究结果表明马铃薯并不是一个UV-B辐射耐受型作物, 与其他作物一样在增强的UV-B辐射环境中同样会产生显著的形态响应。通过减小叶面积和降低株高, 马铃薯可减少UV-B辐射导致的直接伤害, 保护顶端分生组织, 是对非适宜环境的一种形态适应, 与高山垫状植物在强紫外辐射环境中的适应策略具有一定的相似性[37]。
对于营自养生活的高等植物而言, 在适宜环境中, 较大的叶面积和最佳的接受阳光照射角度将有助于植物生产更多的光合产物和取得生存竞争优势。但这种叶片特征在遇到逆境胁迫时受到的影响也是显而易见的, 从叶面积响应指数结果可看出叶面积较大的‘合作88’、‘丽薯6号’2个品种受到UV-B辐射的抑制是最强的, 而叶面积较小的‘21-3’抑制效果则不明显。相应地, 随着叶片膨大受抑, 单位面积的叶片质量随之增加, 并且叶面积较大的‘合作88’等2个品种增量最为明显。这种UV-B辐射引起的比叶重增加趋势与植物叶片在低温、高海拔、水分胁迫等气候变化环境中的效应极为相似[38], 有利于提高植物对不良环境的抵御能力。同时, 由于这2个品种植株健壮、叶片大、分枝多的品种特性造成了在UV-B辐射增强时其地上部分受到的影响较大, 株高、节距变小和叶面积的减少使得地上生物量减少量较为明显。
由于植物地上部分和地下部分间的相关性联系,增强辐射处理后不仅导致了地上生物量的显著减少,也引起了地下生物量(根、块茎)的变化。地上部分对辐射增强导致的生长抑制效果较为明显, 而地上部分生长受抑也影响了地下根系的发育和生长, 地上生物量与根重在2个处理强度下均有着显著相关性,在较高处理强度下(T2)多个品种的根系量均有不同程度地减少, 与相关研究一致[39]。通常, 由于UV-B辐射引起叶面积减小和对光合作用的显著抑制作用[40-41], 会导致运输至库器官的光合产物减少而产量降低(如禾谷类作物)。但本研究结果显示, 在T1处理时所有品种产量均呈正向效应, T2处理时才出现负向效应。这可能与辐射处理时间(累积效应)、辐射剂量具有一定的关系, 如低剂量辐射时植物通过形态建成来响应, 高剂量(>8 kJ·m-2·d-1)时则影响植物的多种生理代谢过程, 从而引起干物质和经济产量的减少[9]。本研究的处理时间仅为50 d(马铃薯生育期90~120 d), 辐射剂量最大为5 kJ·m-2·d-1, 这种辐射时间和剂量可能并不足以引起试验品种块茎产量的显著变化, 其通过形态响应有效降低UV-B辐射所致的不利影响。另外, 已有研究表明在马铃薯块茎形成和膨大过程中, 生长素具有重要的作用[42],而紫外辐射对生长素代谢具有显著影响[43]。因此,鉴于UV-B辐射对植物的复杂效应及植物在机体、细胞和分子水平的多种适应机制[44], 这种现象究竟是生长素代谢变化引起的还是马铃薯植株在辐射胁迫下转向地下块茎的补偿性生长值得深入研究。就整个植株而言, 由于地上部分受到辐射的直接作用,减幅较大(‘转心乌’除外), 所以各品种的根冠比在处理后呈增加趋势, 与相关研究结果相似[45-46]。
值得注意的是, 本研究中的7个试验品种(系)在相同的增强辐射处理下, 其形态特征变化具有一致性, 多数品种表现为株高降低、节距缩短、叶面积变小的‘避害’适应特征, 同时叶片比叶重增加、根冠比加大。但各品种的形态响应具有明显的种间差异, 如‘合作88’、‘丽薯6号’这2个地上生物量较大的普通品种, 在受到增强辐射后受到的抑制比较明显, 同时引起地下根系生物量的显著减少, 从CSRI值分析可归为辐射敏感型品种。而‘转心乌’在株高、节距、地上生物量、根量等响应指数的变化上显示并未受到辐射抑制, 其CSRI都呈正值, 表现出较强的UV-B辐射耐受性; ‘21-1’则在T1处理CSRI为正值, T2处理下才受到抑制。上述这2个品种均是彩色品种, 类似研究已经表明在增强的UV-B辐射下, 彩色品种比普通品种的生理抗性指标响应更加明显[32-33],因此本研究也从形态特征变化方面初步验证了彩色品种比普通品种在增强的UV-B辐射下可能具有更强的耐受性或其他的适应机制, 还有待于进一步从生理、分子水平等方面进行深入研究和阐述。
参考文献References
[1] Haase N U. Healthy aspects of potatoes as part of the human diet[J]. Potato Research, 2008, 51(3/4): 239-258
[2] Rosenzweig C, Parry M L. Potential impact of climate change on world food supply[J]. Nature, 1994, 367(6459): 133-138
[3] Lobell D B, Burke M B, Tebaldi C, et al. Prioritizing climate change adaptation needs for food security in 2030[J]. Science,2008, 319(5863): 607-610
[4] Jarvis A, Lane A, Hijmans R J. The effect of climate change on crop wild relatives[J]. Agriculture, Ecosystems & Environment, 2008, 126(1/2): 13-23
[5] Prado F E, Rosa M, Prado C, et al. UV-B radiation, its effects and defense mechanisms in terrestrial plants[M]//Ahmad P,Prasad M N V. Environmental Adaptations and Stress Tolerance of Plants in the Era of Climate Change. New York:Springer, 2012: 57-83
[6] Caldwell M M, Björn L O, Bornman J F, et al. Effects of increased solar ultraviolet radiation on terrestrial ecosystems[J]. Journal of Photochemistry and Photobiology B: Biology, 1998,46(1/3): 40-52
[7] Jansen M A K, Gaba V, Greenberg B M. Higher plants and UV-B radiation: Balancing damage, repair and acclimation[J]. Trends in Plant Science, 1998, 3(4): 131-135
[8] Björn L O, Callaghan T V, Gehrke C, et al. Ozone depletion,ultraviolet radiation and plant life[J]. Chemosphere-Global Change Science, 1999, 1(4): 449-454
[9] 陈慧泽, 韩榕. 植物响应UV-B辐射的研究进展[J]. 植物学报, 2015, 50(6): 790-801 Chen H Z, Han R. Plants respond to UV-B radiation: A review[J]. Chinese Bulletin of Botany, 2015, 50(6): 790-801
[10] Chen H, Han R. F-actin participates in the process of the “partition-bundle division”[J]. Russian Journal of Plant Physiology, 2015, 62(2): 187-194
[11] Jansen M A K. Ultraviolet-B radiation effects on plants: Induction of morphogenic responses[J]. Physiologia Plantarum,2002, 116(3): 423-429
[12] 兰春剑, 江洪, 黄梅玲, 等. UV-B辐射胁迫对杨桐幼苗生长及光合生理的影响[J]. 生态学报, 2011, 31(24):7516-7525 Lan C J, Jiang H, Huang M L, et al. The growth and photosynthetic responses of Cleyera japonica Thunb. seedlings to UV-B radiation stress[J]. Acta Ecologica Sinica, 2011, 31(24):7516-7525
[13] 黄梅玲, 江洪, 金清, 等. UV-B辐射胁迫下不同起源时期的3种木本植物幼苗的生长及光合特性[J]. 生态学报, 2010,30(8): 1998-2009 Huang M L, Jiang H, Jin Q, et al. The seedling growth and photosynthetic characteristic of three ligneous plants with different evolutionary time to UV-B radiation stress[J]. Acta Ecologica Sinica, 2010, 30(8): 1998-2009
[14] Ren J, Yao Y N, Yang Y Q, et al. Growth and physiological responses to supplemental UV-B radiation of two contrasting poplar species[J]. Tree Physiology, 2006, 26(5): 665-672
[15] Zu Y G, Pang H H, Yu J H, et al. Responses in the morphology,physiology and biochemistry of Taxus chinensis var. mairei grown under supplementary UV-B radiation[J]. Journal of Photochemistry and Photobiology B: Biology, 2010, 98(2):152-158
[16] Singh S K, Surabhi G K, Gao W, et al. Assessing genotypic variability of cowpea [Vigna unguiculata (L.) Walp.] to current and projected ultraviolet-B radiation[J]. Journal of Photochemistry and Photobiology B: Biology, 2008, 93(2): 71-81
[17] Singh S, Kumari R, Agrawal M, et al. Modification of growth and yield responses of Amaranthus tricolor L. to UV-B under varying mineral nutrient supply[J]. Scientia Horticulturae,2009, 120(2): 173-180
[18] 张君玮, 周青. UV-B辐射对植物水分代谢的影响[J]. 中国生态农业学报, 2009, 17(4): 829-833 Zhang J W, Zhou Q. Effect of UV-B radiation on water metabolism in plants[J]. Chinese Journal of Eco-Agriculture,2009, 17(4): 829-833
[19] 朱婷婷, 娄运生, 黄岩. UV-B辐射增强及种植密度对大麦生长发育的影响[J]. 江苏农业学报, 2013, 29(2): 254-260 Zhu T T, Lou Y S, Huang Y. Effects of planting density and enhanced UV-B radiation on growth and development of barley[J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(2):254-260
[20] 包龙丽, 何永美, 祖艳群, 等. 大田条件下增强UV-B辐射对元阳梯田2个地方水稻品种叶片形态解剖结构的影响[J].生态学杂志, 2013, 32(4): 882-889 Bao L L, He Y M, Zu Y Q, et al. Effects of enhanced UV-B radiation on the leaf morphology and anatomical structure of two local rice varieties in Yuanyang terraced fields, Yunnan Province of Southwest China[J]. Chinese Journal of Ecology,2013, 32(4): 882-889
[21] 吴荣军, 郑有飞, 王传海, 等. 紫外辐射增强对玉米地上部分与根系生长的影响比较[J]. 生态环境, 2007, 16(2):323-326 Wu R J, Zheng Y F, Wang C H, et al. Effects of enhanced UV-B radiation on the growth of aerial parts and root of maize[J]. Ecology and Environment, 2007, 16(2): 323-326
[22] 林文雄. 水稻对UV-B辐射增强的生理响应及其分子机制研究[J]. 中国生态农业学报, 2013, 21(1): 119-126 Lin W X. Physiological responses and molecular mechanism of rice (Oryza sativa) exposed to enhanced UV-B radiation[J]. Chinese Journal of Eco-Agriculture, 2013, 21(1): 119-126
[23] Lü Z W, Zhang X S, Liu L K, et al. Comparing intraspecific responses of 12 winter wheat cultivars to different doses of ultraviolet-B radiation[J]. Journal of Photochemistry and Photobiology B: Biology, 2013, 119: 1-8
[24] Kakani V G, Reddy K R, Zhao D, et al. Field crop responses to ultraviolet-B radiation: A review[J]. Agricultural and Forest Meteorology, 2003, 120(1/4): 191-218
[25] Krupa S V, Kickert R N. The greenhouse effect: impacts of ultraviolet-B (UV-B) radiation, carbon dioxide (CO2), and ozone (O3) on vegetation[J]. Environmental Pollution, 1989,61(4): 263-393
[26] 马桂兰, 徐风学. 马铃薯品种对紫外线强辐射作用的敏感性[J]. 国外农学: 杂粮作物, 1999, 19(2): 53-54 Ma G L, Xu F X. The sensitivity of potato varieties to strong ultraviolet radiation[J]. Rain Fed Crops, 1999, 19(2): 53-54
[27] Santos I, Fidalgo F, Almeida J M, et al. Biochemical and ultrastructural changes in leaves of potato plants grown under supplementary UV-B radiation[J]. Plant Science, 2004, 167(4):925-935
[28] Teramura A H, Ziska L H. Ultraviolet-B radiation and photosynthesis[M]//Baker N R. Photosynthesis and the Environment. Netherlands: Springer, 1996: 435-450
[29] Zu Y Q, Li Y, Chen J J, et al. Intraspecific responses in grain quality of 10 wheat cultivars to enhanced UV-B radiation under field conditions[J]. Journal of Photochemistry and Photobiology B: Biology, 2004, 74(2/3): 95-100
[30] Breznik B, Germ M, Kreft I, et al. Crop responses to enhanced UV-B radiation[M]//Singh S N. Climate Change and Crops. Berlin Heidelberg: Springer, 2009
[31] Reddy K R, Prasad P V V, Singh S K. Effects of ultraviolet-B radiation and its interactions with climate change factors on agricultural crop growth and yield[M]//Gao W, Slusser J R,Schmoldt D L. UV Radiation in Global Climate Change. Berlin Heidelberg: Springer, 2010: 395-436
[32] 张新永, 郭华春, 戴华峰. 增强UV-B辐射对彩色马铃薯叶片中相关保护酶活性的影响[J]. 西北植物学报, 2009, 29(5):968-974 Zhang X Y, Guo H C, Dai H F. Effects of supplemental ultraviolet-B radiation on activities of the related protective enzymes in the leaves of chromatic potato[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(5): 968-974
[33] 张新永, 郭华春, 艾星梅, 等. 增强UV-B辐射对彩色马铃薯相关生理生化特性的影响[J]. 生态环境学报, 2009, 18(2):664-668 Zhang X Y, Guo H C, Ai X M, et al. Effects of supplemental ultraviolet-B radiation on the physiological and biochemical characteristics of chromatic potato[J]. Ecology and Environmental Sciences, 2009, 18(2): 664-668
[34] 李俊, 钟英娜, 郭华春. 马铃薯叶面积与产量、品质关系研究[J]. 中国马铃薯, 2013, 27(1): 34-37 Li J, Zhong Y N, Guo H C. Correlation of leaf area with yield and quality in potato[J]. Chinese Potato Journal, 2013, 27(1):34-37
[35] Potters G, Pasternak T P, Guisez Y, et al. Stress-induced morphogenic responses: Growing out of trouble?[J]. Trends in Plant Science, 2007, 12(3): 98-105
[36] Kumari R, Prasad M N V, Agrawal S B. Growth and defense metabolism of plants exposed to Ultraviolet-B radiation[M]// Lichtfouse E. Sustainable Agriculture Reviews. Switzerland:Springer International Publishing, 2015: 263-305
[37] Körner C. Alpine Plant Life: Functional Plant Ecology of High Mountain Ecosystems[M]. 2nd ed. Berlin Heidelberg:Springer, 2003
[38] 王常顺, 汪诗平. 植物叶片性状对气候变化的响应研究进展[J]. 植物生态学报, 2015, 39(2): 206-216 Wang C S, Wang S P. A review of research on responses of leaf traits to climate change[J]. Chinese Journal of Plant Ecology, 2015, 39(2): 206-216
[39] Furness N H, Upadhyaya M K. Differential susceptibility of agricultural weeds to ultraviolet-B radiation[J]. Canadian Journal of Plant Science, 2002, 82(4): 789-796
[40] Kataria S, Jajoo A, Guruprasad K N. Impact of increasing ultraviolet-B (UV-B) radiation on photosynthetic processes[J]. Journal of Photochemistry and Photobiology B: Biology, 2014,137: 55-66
[41] Lidon F J C, Reboredo F H, Leitão A E, et al. Impact of UV-B radiation on photosynthesis — An overview[J]. Emirates Journal of Food and Agriculture, 2012, 24(6): 546-556
[42] Kolachevskaya O O, Alekseeva V V, Sergeeva L I, et al. Expression of auxin synthesis gene tms1 under control of tuber-specific promoter enhances potato tuberization in vitro[J]. Journal of Integrative Plant Biology, 2015, 57(9): 734-744
[43] Hectors K, van Oevelen S, Guisez Y, et al. The phytohormone auxin is a component of the regulatory system that controls UV-mediated accumulation of flavonoids and UV-induced morphogenesis[J]. Physiologia Plantarum, 2012, 145(4):594-603
[44] Robson T M, Klem K, Urban O, et al. Re-interpreting plant morphological responses to UV-B radiation[J]. Plant, Cell & Environment, 2015, 38(5): 856-866
[45] Bussell J S, Gwynn-Jones D, Griffith G W, et al. Above- and below-ground responses of Calamagrostis purpurea to UV-B radiation and elevated CO2under phosphorus limitation[J]. Physiologia Plantarum, 2012, 145(4): 619-628
[46] Comont D, Winters A, Gomez L D, et al. Latitudinal variation in ambient UV-B radiation is an important determinant of Lolium perenne forage production, quality, and digestibility[J]. Journal of Experimental Botany, 2013, 64(8): 2193-2204
* 国家自然科学基金项目(31260342)、国家马铃薯产业体系(CARS-10-P21)和云南省马铃薯种业重大专项(2013ZA007)资助
** 通讯作者: 郭华春, 主要研究薯类作物栽培生理与育种。E-mail: ynghc@126.com
李俊, 主要研究马铃薯栽培及逆境生理。E-mail: nxy8mm@163.com
* This work was supported by the National Natural Science Foundation of China (No. 31260342), the National Potato Industry Technology System (No. CARS-10-P21) and the Major Projects of Yunnan Potato Seed Industry (No. 2013ZA007).
** Corresponding author, E-mail: ynghc@126.com
Received Nov. 19, 2015; accepted Jan. 14, 2016
中图分类号:S181
文献标识码:A
文章编号:1671-3990(2016)06-0770-10
DOI:10.13930/j.cnki.cjea.151229
收稿日期:2015-11-19 接受日期: 2016-01-14
Morphological responses of potato varieties (lines) to enhanced UV-B radiation*
LI Jun, NIU Jinwen, YANG Fang, XIAO Jiping, GUO Huachun**
(College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China)
AbstractUV-B radiation has a profound effect on plant morphogenesis, inevitably affecting potato cultivation, especially with enhanced UV-B radiation on the earth’s surface. Compared with rice, wheat, corn and other crops, the total effect of UV-B radiation on potato is still not conclusive, especially the morphological response of potato to UV-B radiation. In this study, the effect of enhanced UV-B radiation on plant height, internode length, leaf area, root to shoot ratio (R/T) and other morphological indices of 7 potato varieties (lines) were analyzed and compared. The determination of the inter-variety variations in response was critical for the evaluation of the effect of UV-B radiation on potato. It was also important for providing further understanding on the tolerance and sensitivity of different varieties of potato to enhanced UV-B radiation. An outdoor pot cul-ture experiment was conducted to evaluate the sensitivity of 7 potato varieties (lines), 3 colored-tuber and 4 achromatic-tuber,to a range of UV-B radiation levels. Three biologically effective UV-B radiation treatments — 0 (control), 2.5 kJ·m-2·d-1(T1)and 5.0 kJ·m-2·d-1(T2) — were imposed on the potato varieties for 50 d when seedlings were over 20 cm high. Aboveground morphological indices were measured after 15 d, 30 d and 45 d of treatment, respectively. Response index (RI) and cumulative stress response index (CSRI) were eventually used to evaluate the sensitivity of the different varieties (lines) of potato to the UV-B radiations. The results showed that plant height, internode and leaf area of most of the treated varieties (lines) decreased consistently under enhanced UV-B radiation. The inhibitory effect of UV-B radiation on potato was more obvious under higher UV-B dose with longer duration. While a significant variability of morphological response was observed, the degree of sensitivity to UV-B radiation also varied among the potato varieties. Compared with colored-tuber varieties (lines), achromatic-tuber varieties (lines) were inhibited more severe under elevated UV-B radiation, with more evident reduction in aboveground biomass. For example, the shoot fresh weight response index of ‘Hezuo 88’ was -60.28 and -70.44 (negative), respectively, while that of colored-tuber ‘Zhuanxinwu’ was 107.75 and 21.4 (positive) under T1 and T2, respectively. Due to the negative effect of enhanced UV-B radiation on aboveground biomass, root biomass also dropped significantly for most of the potato varieties (lines). Compared with belowground root and tuber, the inhibition of aboveground biomass increased with increasing exposure to enhanced UV-B radiation. Thus, R/T of all the potato varieties (lines) obviously increased, especially at high UV-B radiation (T2). Based on the calculated CSRI, achromatic-tube varieties (lines) (‘Hezuo 88’ and ‘Lishu 6’) were sensitive to UV-B radiation, while colored-tube varieties (‘Zhuanxinwu’ and ‘21-1’) more tolerant to UV-B radiation. The results suggested that the biomass of both shoot and root and tuber color were important indicators in selecting or developing UV-B radiation tolerant potato varieties.
KeywordsUV-B radiation; Potato; Morphological response; Colored-tube variety; Achromatic-tube variety
