太空诱变玉米核不育突变体矮化的遗传及外施赤霉素分析
2016-07-25曹墨菊
汪 静, 程 江, 曹墨菊
( 四川农业大学 玉米研究所/农业部西南玉米生物学与遗传育种重点实验室, 成都 611130 )
太空诱变玉米核不育突变体矮化的遗传及外施赤霉素分析
汪静, 程江, 曹墨菊*
( 四川农业大学 玉米研究所/农业部西南玉米生物学与遗传育种重点实验室, 成都 611130 )
摘要:为了解太空诱变玉米核不育突变体矮化的遗传规律和原因,该研究以不育突变体为母本,自交系178、478为父本,对测交F1、F2群体进行育性鉴定和株高分析,对F2可育株进行基因型和株高分析,对姊妹交后代分离群体进行育性鉴定和株高、雄穗长度、节间数、节间长度分析,同时,还对姊妹交后代分离群体进行施赤霉素处理,调查育性和株高的变化。结果表明:178和478背景下的F1表现出与测交母本一样的极显著差异;在178和478核背景下的F2中,不育株株高极显著矮于可育株,两核背景下的不育株间株高差异不显著,而可育株间株高差异极显著;F2中纯合和杂合可育株的株高差异不显著;姊妹交后代分离群体中不育株株高、雄穗长度、节间数和节间长度极显著小于可育株;外施赤霉素的不育株在苗期表现出对赤霉素一定的敏感性,但株高最终未恢复正常高度。因此,得出该突变体矮化表现稳定,与不育性状并存,且不受细胞核背景的影响;核不育基因对植株株高的矮化无剂量效应;突变体的矮化与雄穗长度、节间数和节间长度有关;突变体不完全属于赤霉素不敏感型,其矮化并不是单一缺乏赤霉素而引起。该研究结果为认识太空诱变玉米核不育突变体矮化的遗传和生理机制提供了参考。
关键词:太空诱变, 玉米, 细胞核雄性不育, 矮化, 遗传, 赤霉素
植物雄性不育是指由于遗传、生理、环境等原因造成植物自身不能产生正常功能的花粉,而雌配子发育正常仍能接受外来花粉的现象。雄性不育对植物本身来说是有害的,但在作物育种以及遗传、发育等生物学研究中却有着重要的意义。尤其是在育种上,雄性不育为玉米杂交种子的生产提供了一条有效的途径(李竞雄等, 1998)。
植株矮化是农作物育种实践中最重要的农艺性状之一,矮秆也是作物育种的重要目标性状。在玉米育种中,株高和穗位高是影响玉米产量、抗倒伏性及生态适应性极为重要的农艺性状。培育矮生型玉米杂交种,可以降低株高,提高抗倒性,改善株型结构,增加种植密度,提高群体光合效能,近而达到高产的目的。因此,明确玉米矮杆的遗传方式和作用机制有着重要意义(延吉, 2003)。矮生性状可受主效单基因控制,也可由微效多基因共同控制。矮生基因的挖掘为转基因矮杆材料的创制提供了优异的基因资源。目前玉米已鉴定并命名矮生主效单基因有34个,其中已经定位的有27个(张素梅, 2008; 李启芳, 2010)。引起植物矮化的因素很多,如植物激素的合成以及转导不正常等都会导致植株的矮化(李晓波等, 2004; 石琰璟, 2005; Depuydt & Hardtke, 2011),而研究表明多数的矮化突变体与赤霉素(GAs)有关(Rebetzke, 2012; Wang et al, 2013; Ayele et al, 2014; Ji et al, 2014)。GAs对高等植物茎的延伸起着非常重要的调控作用。与植物激素相关的矮化突变体主要分为缺陷型和不敏感型两类。缺陷型矮化突变体是活性激素的生物合成途径被抑制或阻断,使得植物体内源活性激素缺乏或含量极微少,外施相应的活性激素可使植株恢复野生型高度;而不敏感型矮化突变体是激素的信号吸收或传递出现障碍,其内源活性激素水平变化不大,甚至比野生型的还高,外施相应的活性激素不能使植株恢复野生型高度(于永红和斯华敏, 2005)。
四川农业大学玉米研究所通过卫星搭载获得了1份受一对隐性基因控制的细胞核雄性不育突变体(曹墨菊等, 2003; 刘福霞等, 2005; 李式昭等, 2007),其兼具了不育性与矮生性两种育种上需要的性状。初步研究发现,在该突变体不育株姊妹交后代分离群体中,不育株与可育株的株高整个生育期不同的发育阶段均存在极显著的差异(曹墨菊等, 2004)。因此,本文以太空诱变玉米核不育测交F1、F2群体,F2可育株自交F2:3家系,以及姊妹交后代分离群体为材料,进一步分析植株株高的矮化是否与不同的遗传背景相关,控制玉米核不育的基因对植株株高的矮化是否有剂量效应,以及不育株与可育株的株高存在差异是否与雄穗长度、节间数、节间平均长度有关。同时通过外施GAs实验,分析GAs与不育株矮化表现的关系。通过对该太空诱变玉米核不育突变体矮化现象的遗传和外施GAs研究,以期揭示不育突变体矮化的遗传规律和原因,为认识其矮化的遗传和生理机制提供参考。
1材料与方法
1.1 材料
株高遗传分析以自交系178和478,太空诱变玉米细胞核雄性不育株(A)与自交系178、478杂交F1、F2群体及其F2可育株自交F2:3家系,以及不育株姊妹交后代分离群体为材料。自交系178和478、[A×178]F1和F2、[A×478]F1和F2群体各自来自1个果穗;[A×178]F2:3家系来自[A×178]F2可育株自交的28个果穗;[A×478]F2:3家系来自[A×478]F2可育株自交的23个果穗;不育株姊妹交后代分离群体来自2个果穗。
外施GAs分析以不育株姊妹交后代分离群体为材料,来自另外7个果穗,分7个小区种植,田间区号为C1、C2、C3、C4、C5、C6、C7。
以上所有材料单果穗分区种植,育苗移栽,不间苗,田间精细管理。
1.2 方法
1.2.1 株高遗传分析(1)育性和株高调查:在植株抽雄散粉后,分两次按Duvick(1965)的育性标准调查各群体植株的育性表现;成株期调查各群体植株株高,同时还对不育株姊妹交后代分离群体植株进行雄穗长度、节间数和节间长度调查。(2)F2可育株基因型鉴定:调查[A×178]F2和[A×478]F2可育株自交F2:3家系的育性表现。育性未发生分离的F2:3家系,其F2为纯合体可育(RR);育性发生分离的F2:3家系,其F2为杂合体可育(Rr)。
1.2.2 外施GAs分析GAs外施的方法参见曹墨菊等(2010),实验设50、100、150 mg·L-13个GAs浓度,在苗期(4月22日)和拔节期(5月12日)各喷施一次, C1和C4小区喷施浓度为50 mg·L-1, C2和C5小区喷施浓度为100 mg·L-1, C3和C6小区喷施浓度为150 mg·L-1, C7小区不喷施。从苗期第一次GAs喷施后,每10天调查一次株高直到植株抽雄,在植株散粉完全成熟后再调查一次株高,一共调查6次。同时,还在植株抽雄散粉后调查雄穗的育性表现,方法同上。
1.2.3 数据分析对姊妹交后代分离群体的育性分离比进行χ2适合性测验,对各群体不同育性植株调查性状的数据采用Microsoft Excel进行整理和作图,并采用DPS软件进行成组数据差异显著性测验(明道绪, 2013)。
2结果与分析
2.1 不育株与178、478杂交后代群体的株高分析
2.1.1 F1、F2群体株高分析以单株为测量单位,分别调查自交系178和478,以及不育株与178和478杂交F1、F2群体的株高。其中自交系178和478分别调查了21株和22株,[A×178] F1和[A×478]F1分别调查了25株和30株,[A×178] F2和[A×478]F2分别调查了50株和69株。对178和478、[A×178]F1和[A×478]F1、[A×178]F2和[A×478]F2群体中不育株和可育株的平均株高分别进行成组数据差异显著性测验(表1)。表1结果表明,自交系478和[A×478]F1的植株株高分别极显著矮于自交系178和[A×178]F1的植株株高,并且F1株高均高于各自父本自交系;[A×478]F2和[A×178] F2群体中不育株株高均极显著矮于可育株株高;[A×478]F2中可育株株高极显著矮于[A×178]F2群体中的可育株的株高,但[A×478]F2群体中不育株株高与[A×178]F2群体中的不育株株高差异不显著。
2.1.2 F2不同基因型可育株株高分析对测定了株高的F2可育株自交F2:3家系植株进行田间育性鉴定,发现28个[A×178]F2:3中有18个发生育性分离,10个未发生育性分离;23个[A×478]F2:3家系中有16个发生育性分离,7个未发生分离。表明[A×178]F2群体中28株可育株中有10株为纯合可育(RR),18株为杂合可育(Rr);[A×478]F2群体中23株可育株中有7株为纯合可育(RR),16株为杂合可育(Rr)。对[A×178]F2和[A×478]F2群体中纯合可育株和杂合可育株的平均株高分别进行成组数据差异显著性测验(表2)。表2结果表明,[A×178]F2和[A×478]F2群体中两种基因型的可育株株高差异均不显著。

表 1 不育株与178、478杂交后代群体的平均株高 (单位:cm)
注:大/小写字母表示差异显著水平为0.01/0.05;表中数据后第一个/第二个字母表示横向/纵向比较。
Note: Capital/lowercase letters indicate the significant differences at 0.01/0.05 level; the first/second letters after the data in the table indicate horizontally/ longitudinally comparison.

表 2 不育株与178、478杂交F2纯合和杂合可育株平均株高 (单位:cm)
注:小写字母表示差异显著水平为0.05,表中数据均为横向比较。
Note: Lowercase letters indicate the significant differences at 0.05 level; the data in the table are compared horizontally.
2.2 不育姊妹交后代分离群体的株高分析
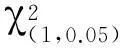
以单株为单位,调查76株姊妹交后代分离群体中的不育株和可育株株高、雄穗长度、节间数和节间长度并计算得出各植株节间长度平均值。对姊妹交后代分离群体中可育株和不育株的平均株高、雄穗长度、节间数和节间长度分别进行成组数据差异显著性测验(表3)。结果表明,不育株的株高、雄穗长度、节间数及节间长度均极显著小于可育株。
2.3 外施GAs对不育株姊妹交后代分离群体株高的影响
以单株为单位,调查外施GAs的不育株姊妹交后代分离群体的育性,育性鉴定结果详见曹墨菊等(2010)。外施GAs小区和对照小区都发生育性分离,且均符合育性分离比为1∶1。表明在苗期和拔节期外施GAs对太空诱变玉米核不育突变体的育性没有影响。
以单株为单位,调查GAs处理小区和对照小区不同发育时段植株的株高, 对不同浓度GAs处理小区或对照区不同发育时段不育株和可育株的平均株高进行成组数据差异显著性测验(表4),结果表明,不育株株高极显著矮于可育株株高。GAs处理小区或对照小区不同发育时段不育株和可育株的平均株高曲线如图1,图2所示,处理和对照植株株高增长趋势基本一致,不育株和可育株株高在调查前期差异较小,随着植株的生长,差异逐渐变大,到成株期差异最大。GAs处理不育株和对照可育株不同发育时段平均株高曲线如图3所示,在5/02处理不育株株高高于对照可育株株高,之后它们间的株高差异减小,在5/12到5/22之间出现交叉,之后处理不育株株高变为低于对照可育株株高,随着植株的生长,差异逐渐增大,也是在植株完全成熟时差异最大。

表 3 姊妹交后代分离群体不育株和可育株的平均株高、雄穗长度、节间数和节间长度 (单位:cm)
注:大写字母表示差异显著水平为0.01,表中数据均为横向比较。
Note: Capital letters indicate the significant differences at 0.01 level; the data in the table are compared horizontally.
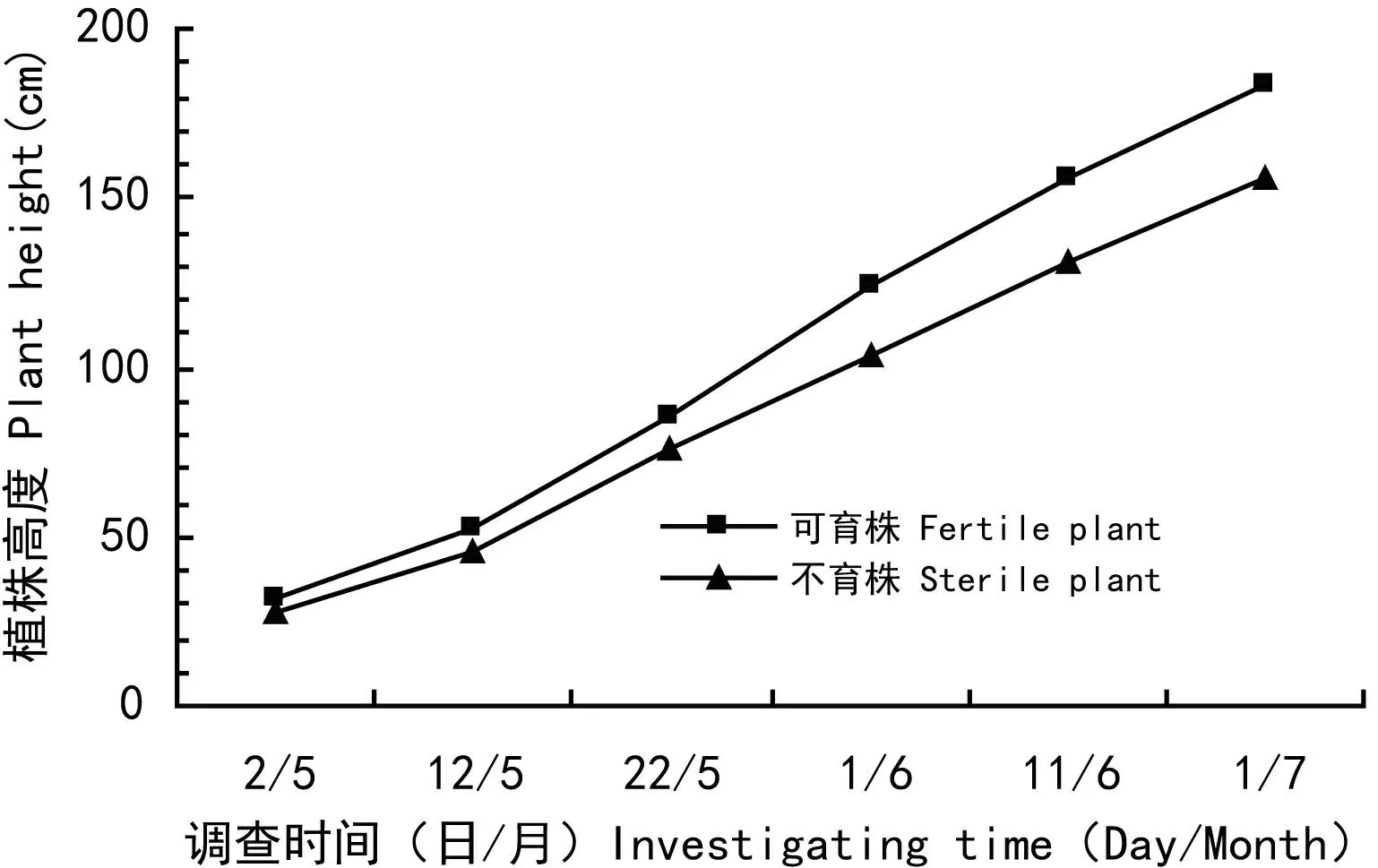
图 1 GAs处理两种育性植株的平均株高生长曲线图Fig. 1 Diagram of dynamic average height of fertile and sterile plants treated by GAs
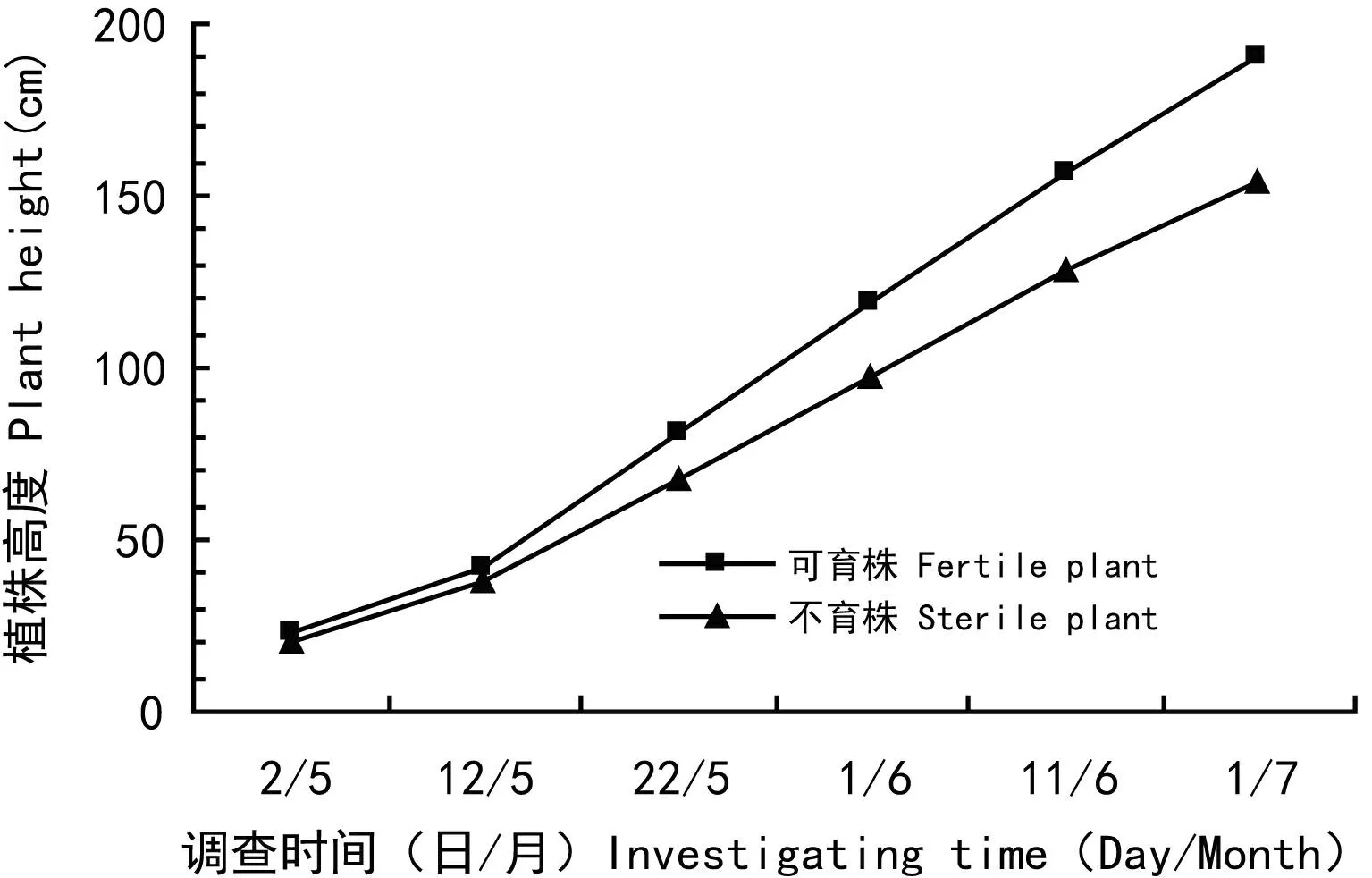
图 2 对照两种育性植株的平均株高生长曲线图Fig. 2 Diagram of dynamic average height of fertile and sterile plants of control

图 3 GAs处理不育株与对照可育株的平均株高生长曲线图Fig. 3 Diagram of dynamic average height of sterile plants treated by GAs and fertile plants of control
3讨论与结论
自交系178是由中国农业大学选育的晚熟类群,自交系478是山东省莱州市玉米研究所选出的中熟类群,178和478在川黔多年种植表现为478株高较178的株高矮(曹广才等, 2000)。因此,本研究利用两自交系株高显著差异进行玉米细胞核雄性不育测交试验。首先,对测交F1和F2群体的育性和株高分析发现,178和478背景下的F1表现出与测交亲本一样的极显著差异,但分别又比各自测交亲本显著升高,这应与杂交优势表现有关;F2群体中两种育性植株的株高表现除了具有不育株极显著矮于可育株的共性之外还表现出各自的个性,即在178和478两个不同核背景下的F2不育株株高差异不显著,而可育株株高差异极显著。可见,不育株的矮化表现稳定且与不育性状并存,不育株与可育株的株高差异不因核背景的不同而改变。其次,对F2群体中可育株自交F2:3家系育性分离调查结合可育F2株高分析发现,可育F2中纯合和杂合株之间的株高差异不显著,表明核不育基因对植株株高的矮化无剂量效应,且该不育突变体的矮化为高杆对矮秆显性遗传。最后,对不育姊妹交后代分离群体中不育株和可育株株高、雄穗长度、节间数和节间长度分析发现,不育株的株高极显著矮于可育株可能与不育株的雄穗长度、节间数和节间长度极显著变小变少有关。
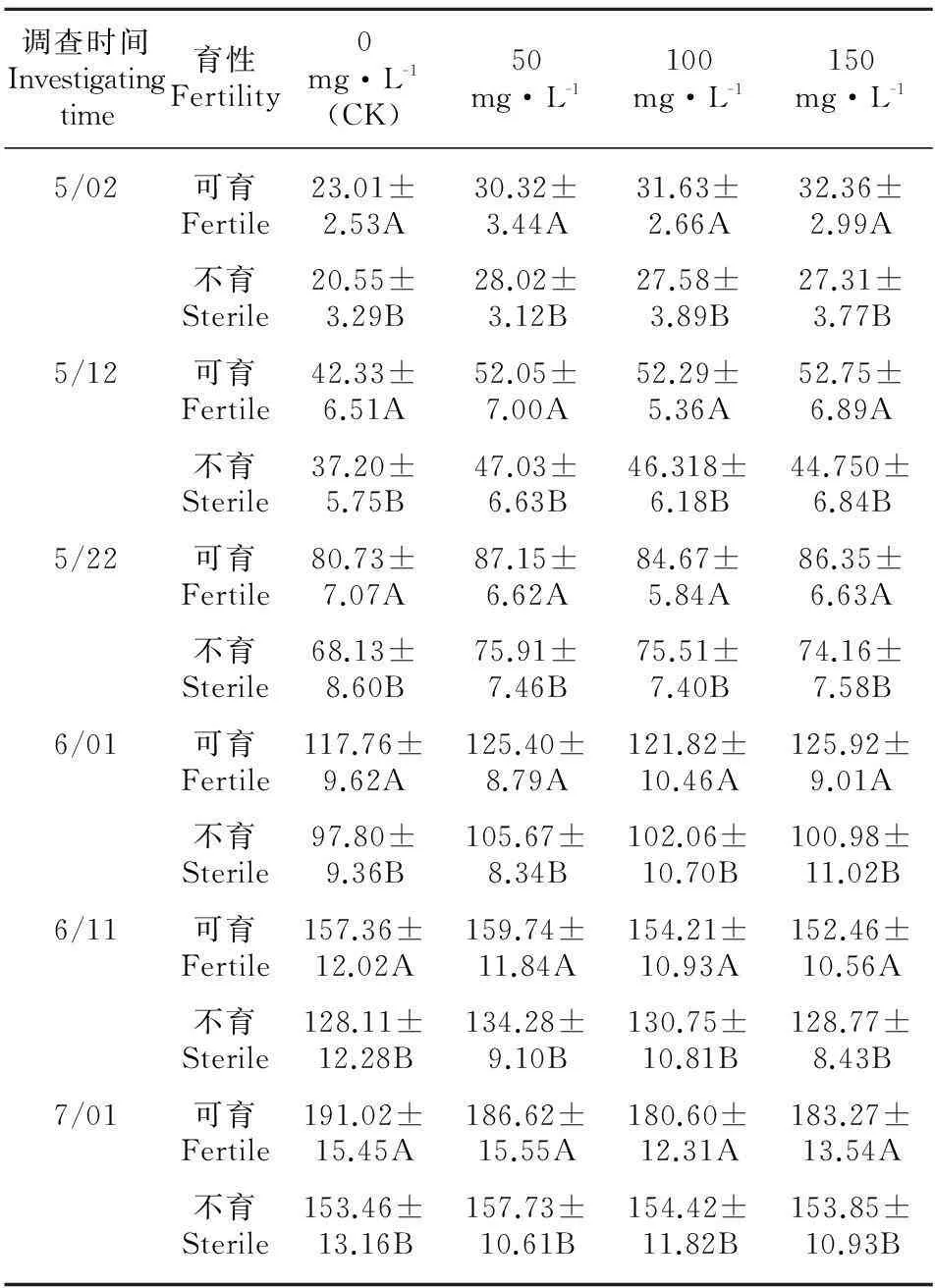
表 4 姊妹交后代分离群体GAs处理和对照小区不育株和可育株的平均株高 (单位:cm)
注:大写字母表示差异显著水平为0.01,表中数据均为同条件下可育株与不育株纵向比较。
Note: Capital letters indicate the significant differences at 0.01 level; the data of fertile and sterile plants at the same condition in the table are compared longitudinally.
对发育至苗期、拔节期、小孢子单核期和双核期不同育性植株叶片的内源GAs含量测定发现,不育株GAs含量各时期均低于可育株,在拔节期二者的GAs含量差异达极显著水平(曹墨菊等, 2010)。本研究在调查的各个时期,GAs处理小区或对照小区的可育株株高均极显著地高于不育株株高,并且变化趋势一致;在处理前期(苗期),处理不育株的株高高于对照可育株的株高,随后差异逐渐减小,变为处理不育株的株高低于对照可育株,此后差异逐渐变大,到成株期时差异达最大。这表明外施GAs对不育株与可育株的株高影响一致;不育株尽管在苗期表现出对GAs一定的敏感性,但外施GAs后其株高最终并未恢复到正常植株高度。可见,该不育突变体不完全属于GAs不敏感型,其矮化并不是因单一的缺乏GAs引起的,GAs的敏感程度取决于发育阶段的变化,玉米中也有类似报道(Galbiati et al, 2002)。
控制该突变体不育性的隐性基因已经被定位在玉米第3染色体长臂3.06的位置(李式昭等, 2007),也有报道显示,有两个玉米矮生基因位于该位置(Robertson et al, 1974; Neuffer & England, 1995)。植物雄性不育和矮化都可能与其内源激素含量的变化和相互间的调控作用有关系(张艳玉等, 2013; Tang et al, 2008; Zhu et al, 2010; Rebetzke, 2012; Wang et al, 2013; Ayele et al, 2014; Ji et al, 2014)。因此,综合该玉米细胞核雄性不育突变体矮败遗传和外施GAs分析结果,推测该突变体不育和矮化两性状可能受一因多效基因控制,也可能受两隐性连锁遗传的基因控制,且控制株高的基因会产生一系列连锁反应,最终影响内源GAs的含量并在玉米发育特定阶段受外源GAs的调节。关于该雄性不育突变体的矮化现象需要通过构建近等基因系进行遗传分析和定位,找出控两形状可能的基因,进一步探讨不育和矮化的遗传关系。
参考文献:
AYELE BT, MAGOME H, LEE S,et al, 2014. GA-sensitivedwarf1-1D(gsd1-1D) defines a new mutation that controls endogenous GA levels inArabidopsis[J]. J Plant Growth Regul, 33(2): 340-354.
CAO GC, XU YC, HUANG CL, et al, 2000. Practical maize inbred lines [M]. Beijing: Meteorological Press: 75-91. [曹广才, 徐雨昌, 黄长玲, 等, 2000. 实用玉米自交系 [M]. 北京: 气象出版社: 75-91.]
CAO MJ, RONG TZ, PAN GT, 2003. Genetic analysis about maize sterile mutant obtained by space flight [J]. J Genet Genom, 30(9): 817-822. [曹墨菊, 荣廷昭, 潘光堂, 2003. 首例航天诱变玉米雄性不育突变体的遗传分析 [J]. 遗传学报, 30(9): 817-822.]
CAO MJ, HUANG WC, PAN GT, et al, 2004. Analysis of plant height between male sterile plants obtained by space flight and male fertile plants in maize [J]. J Nucl Agric Sci, 18(4): 261-264. [曹墨菊, 黄文超, 潘光堂, 等, 2004. 首例航天诱变玉米细胞核雄性不育株与可育株的株高生长分析 [J]. 核农学报, 18(4): 261-264.]
CAO MJ, CHENG J, WANG J, et al, 2010. Relationship between phytohormones and genic male sterility induced by space flight in maize [J]. J Nucl Agric Sci, 24(3): 447-452. [曹墨菊, 程江, 汪静, 等, 2010. 太空诱变玉米核雄性不育与植物激素的关系 [J]. 核农学报, 24(3): 447-452.]
DEPUYDT S, HARDTKE CS, 2011. Hormone signalling crosstalk in plant growth regulation [J]. Curr Biol, 21(9): 365-373.
DUVICK DN, 1965. Cytoplasmic pollen sterility in corn [J]. Adv Genet, 13(1): 1-56.
GALBIATI M, LANDONI M, CONSONNI G,et al, 2002. Identification and analysis of maize mutants defining six new genes affecting plant stature [J]. Maydica, 47(3-4): 169-180.
JI SH, GURURANI MA, LEE JW,et al, 2014. Isolation and characterisation of a dwarf rice mutant exhibiting defective gibberellins biosynthesis [J]. Plant Biol, 16(2): 428-439.
LI JX, ZHOU HS, SUN RJ, 1998. Maize male sterile biology [M]. Beijing: China Agriculture Press: 1-2. [李竞雄, 周洪生, 孙荣锦, 1998. 玉米雄性不育生物学 [M]. 北京: 中国农业出版社: 1-2. ]
LI QF, 2010. Fine mapping of the maize dwarf geneDtand the pilot study about its dwarfing mechanism [D]. Tai’an:Shandong Agricultural University: 1-2. [李启芳, 2010. 玉米矮秆基因Dt的精细定位及其矮化机理的初步研究 [D]. 泰安:山东农业大学: 1-2.]
LI SZ, CAO MJ, RONG TZ, et al, 2007. SSR mapping of maize genic male sterile gene induced by space flight [J]. High Technol Lett, 17(8): 869-873. [李式昭, 曹墨菊, 荣廷昭, 等, 2007. 太空诱变玉米核不育基因的SSR作图 [J]. 高技术通讯, 17(8): 869-873.]
LI XB, XU JC, ZHU LH, 2004. Gibberellin signal transduction and plant dwarfism [J]. Chin Biotechnol, 24(12): 26-31. [李晓波, 徐吉臣, 朱立煌, 2004. 赤霉素信号转导与植物的矮化 [J]. 中国生物工程杂志, 24(12): 26-31.]LIU FX, CAO MJ, RONG TZ, et al, 2005. Location of the maize male sterility gene induced by space flight using the microsatellite marker [J]. J Genet Genom, 32(7): 753-757. [刘福霞, 曹墨菊, 荣廷昭, 等, 2005. 用微卫星标记定位太空诱变玉米核不育基因 [J]. 遗传学报, 32(7): 753-757.]
MING DX, 2013. Field test and statistical analysis [M]. 3rd ed. Beijing: Science Press: 88-91. [明道绪, 2013. 田间试验与统计分析 [M]. 第三版. 北京: 科学出版社: 88-91.]
(Continueonpage678)(Continuefrompage712)
NEUFFER MG, ENGLAND DJ, 1995. Induced mutations with confirmed locations [J]. Maize Genet Coop Newsl, 69: 43-46.
REBETZKE GJ, ELLIS MH, BONNETT DG,et al, 2012. Height reduction and agronomic performance for selected gibberellin-responsive dwarfing genes in bread wheat (TriticumaestivumL.) [J]. Field Crop Res, 126: 87-96.
ROBERTSON DS, 1974. Linkage data for yellow dwarf 2 on chromosome 3 [J]. MNL, 48(41): 70-72.
SHI YJ,SUN ZX,SU HR, 2005. Plant dwarfisms caused by deficiency in BRs biosynthesis and signal transduction [J]. Chin Bull Life Sci, 17(1): 69-75. [石琰璟,孙仲序,束怀瑞, 2005. 油菜内酯类似物(BRs)的生物合成与信号传导引起的植物矮化 [J]. 生命科学, 17(1): 69-75.]
TANG RS, ZHENG JC, JIN ZQ, et al, 2008. Possible correlation between high temperature-induced floret sterility and endogenous levels of IAA, GAs and ABA in rice (OryzasativaL.) [J]. Plant Growth Regul, 54(1): 37-43.
WANG Y, DENG D, DING H,et al, 2013. Gibberellin biosynthetic deficiency is responsible for maize dominantDwarf11 (D11) mutant phenotype: physiological and transcriptomic evidence [J]. PLoS ONE, 8(6): e66466.
YAN J, 2003. Plant breeding [M]. Beijing: Higher Education Press:1-19. [延吉, 2003. 植物育种学 [M]. 北京: 高等教育出版社:1-19.]
YU YH, SI HM, 2005. Research progress on the dwarf-related gene in rice [J]. J Plant Genet Resour, 6(3): 344-347. [于永红, 斯华敏, 2005. 水稻矮化相关基因的研究进展 [J]. 植物遗传资源学报, 6(3): 344-347.]
ZHANG SM, 2008. Genetic analysis and gene mapping of a plant height mutant in maize [D]. Tai’an:Shandong Agricultural University: 9-10. [张素梅, 2008. 玉米株高突变体的遗传分析和初步基因定位 [D]. 泰安:山东农业大学: 9-10.]
ZHANG YY, ZHANG WD, GAO QR, et al, 2013. Dynamic changes of endogenous hormones in thermo-photo-sensitive male sterile wheat line BNS [J]. Acta Bot Boreal-Occident Sin, 33(6): 1 165-1 170. [张艳玉, 张卫东, 高庆荣, 等, 2013. 温光敏雄性不育小麦BNS幼穗发育中的内源激素变化 [J]. 西北植物学报, 33(6): 1 165-1 170.]
ZHU Y, DUN XL, ZHOU ZF, et al, 2010. A separation defect of tapetum cells and microspore mother cells results in male sterility inBrassicanapus: the role of abscisic acid in early anther development [J]. Plant Mol Biol, 72(1-2): 111-123.
Genetic analysis and gibberellins treatment effects on dwarfism of maize genic male sterile mutant induced by space flight
WANG Jing, CHENG Jiang, CAO Mo-Ju*
(MaizeResearchInstitute/KeyLaboratoryofBiologyandGeneticImprovementofMaizeinSouthwestRegion,MinistryofAgriculture,SichuanAgriculturalUniversity, Chengdu 611130, China )
Abstract:Male sterility provides an effective way for maize hybrids production. Plant dwarfism is one of the important target traits in crop breeding. Maize research institute of Sichuan Agricultural University obtained a genic male sterile mutant induced by space flight which was controlled by a pair of recessive genes. This mutant has the traits of sterility and dwarfism both needed by breeding. In order to find the genetic rules and reasons of dwarfism of the maize genic male sterile mutant, taking this sterile mutant as mother and inbred lines 178, 478 as father, fertility identification and plant height analysis of test cross F1, F2, genotype and plant height analysis of fertile F2, fertility identification and plant height, tassel length, internode number and internode length analysis of sister cross off-springs were done. Meanwhile, gibberellins were applied on sister cross off-springs, fertility and plant height of which were examined. The results were as follows: The plant height difference of F1 at the background of 178 and 478 which was significant was the same with that between 178 and 478; Sterile plant height was significantly lower than fertile plant height in F2 at the background of 178 or 478, and the difference of sterile plant heights was not significant in F2 at the background of 178 and 478, while the difference of fertile plant heights was significant; In fertile F2at the background of 178 or 478 of which the off-springs’ fertility separated, the difference between homozygous and heterozygous plant heights was all not significant; In sister cross off-springs, separation ratio of fertile and sterile plants met 1∶1, and sterile plant height, tassel length, internode number and internode length were significantly less to those of fertile plant; Exogenous application of gibberellins did not affect the fertility of sterile plants, and the sterile plants showed certain sensitivity to gibberellins at seedling stage, but the plant height of which did not restore to normality finally. Collectively, it was obtained that the dwarfism of this sterile mutant existing with the sterile trait was stable and not affected by nuclear background; There was no dose effect of nuclear male sterile gene on the dwarfism of plant height; Plant height difference of sterile and fertile plants was associated with tassel length, internode number and internode length; The sterile plant did not completely belong to gibberellins reduced response type, the dwarfism of which was not caused only by lack of gibberellins. The recessive gene controlling this male sterile mutant has been mapped at bin 3.06 of the maize third chromosome long arm and it is reported that there are also two maize dwarfism genes at this location. So, it was supposed that the abortion and dwarfism traits of this mutant were possibly regulated by a pleiotropic gene or two recessive genetic linkage genes, and the gene controlling plant height would produce a series of chain reaction, ultimately affecting the content of endogenous gibberellins and being regulated by exogenous gibberellins at certain developmental stages. These research results provide a reference for us to further understand the genetic and physiological mechanism of dwarfism of this mutant.
Key words:space flight, maize, genic male sterility, dwarfism, genetic, gibberellins
DOI:10.11931/guihaia.gxzw201410045
收稿日期:2014-10-27修回日期:2014-12-30
基金项目:国家“863”计划项目(2011AA10A103, 2012AA101202-4); 国家科技支撑计划项目(2008BAD97B03)[Supported by the National Development Planning of High-Technology Research of China(2011AA10A103, 2012aa101202-4); National Key Technology R & D Program of China(2008BAD97B03)]。
作者简介:汪静(1982-),女,四川宜宾人,硕士,主要从事玉米雄性不育分子生物学研究,(E-mail)710049552@qq.com。 *通讯作者:曹墨菊,博士,教授,主要从事玉米雄性不育分子生物学研究与遗传育种,(E-mail)caomj@sicau.edu.cn。
中图分类号:Q945.49, Q37, S513
文献标识码:A
文章编号:1000-3142(2016)06-0707-06
汪静,程江,曹墨菊. 太空诱变玉米核不育突变体矮化的遗传及外施赤霉素分析 [J]. 广西植物, 2016, 36(6):707-712
WANG J,CHENG J,CAO MJ. Genetic analysis and gibberellins treatment effects on dwarfism of maize genic male sterile mutant induced by space flight [J]. Guihaia, 2016, 36(6):707-712
