IL-33基因单核苷酸多态性与糖代谢异常的相关性*
2016-07-24戴文琴杨进华吴芳琴程龙献
戴文琴,杨进华,文 强,吴芳琴,程龙献
(1.华中科技大学同济医学院附属协和医院心血管科,武汉 430000;2.武汉市武昌医院心血管内科,武汉 430063;3.郑州大学第一附属医院心内科,郑州 450052)
·经验交流·
IL-33基因单核苷酸多态性与糖代谢异常的相关性*
戴文琴1,2,杨进华1,3,文 强1,2,吴芳琴2,程龙献1
(1.华中科技大学同济医学院附属协和医院心血管科,武汉 430000;2.武汉市武昌医院心血管内科,武汉 430063;3.郑州大学第一附属医院心内科,郑州 450052)
目的 探讨IL-33基因多态性与糖代谢异常(IGR)的相关性。方法 采用病例对照研究,选取2008~2010年就诊于武汉市协和医院、同济医院、武钢医院心血管内科的IGR患者165例(IGR组),选取上述医院同一时期糖代谢正常的非冠心病患者258例(对照组)。采用 Sequenom MassArray 和 Taqman 基因分型技术,从HaPMaP挑选了IL-33的3个单核苷酸多态位点(rs10975520、rs1929992、rs11792633),分析其在IGR组和对照组的基因型和等位基因频率的分布,以及与IGR人群的相关性。结果 rs1929992的基因型AA、GG、GA在IGR组和对照组中的分布频率分别为0.182、0.333、0.485和0.194、0.353、0.453;rs10975520的基因型GG、CC、GC的分布频率分别为0.200、0.285、0.515和0.221、0.333、0.446;rs11792633的基因型CC、TT、TC的分布频率分别为0.182、0.327、0.491和0.194、0.349、0.457,两组比较差异无统计学意义(P>0.05);三者的等位基因频率在两组中的分布亦差异无统计学意义(P>0.05)。二元Logistic回归校正年龄、性别、吸烟和饮酒、体质量指数(BMI)、三酰甘油(TG)等危险因素后显示,rs1929992、rs10975520、rs11792633与IGR无明显相关性(P>0.05)。结论 IL-33的基因多态性可能与汉族人群IGR无关。
糖代谢异常;IL-33;基因多态性
糖代谢异常(IGR)包括前糖尿病(T2DM)和2型糖尿病,前者包括空腹血糖受损(IFG)、单纯糖耐量受损(IGT)及二者的组合。目前研究表明,慢性炎症在IGR的发生、发展中起着重要的作用[1-2]。IL-33/ST2是近年来新发现的一种信号传导途径,有研究表明,IL-33/ST2通路可以抑制泡沫细胞形成和延缓动脉粥样硬化进程,对冠心病起到保护作用[3-4]。有研究显示,该通路可减轻ob/ob小鼠脂肪积聚,缓解脂肪组织炎症状态,改善胰岛素抵抗(IR),在糖代谢中起到重要作用[5]。在临床研究中,有学者发现严重肥胖患者其脂肪组织中的IL-33表达水平显著增加[6];也有学者证实IL-33和非糖尿病患者的体质量指数(BMI)呈负相关[7]。该通路在IGR人群中的作用机制尚不明确,二者在基因水平上的关系更是缺乏。本研究旨在探讨排除冠心病诊断后IL-33基因单核苷酸多态性(SNPs)与汉族人群IGR的相关性。
1 资料与方法
1.1 一般资料 选取2008~2010年就诊于武汉市协和医院、同济医院、武钢医院心血管内科的IGR的患者共165例(IGR组)。选择同一时期在上述医院就诊的糖代谢正常的非冠心病患者258例(对照组)。入选标准:(1)近2周服用降糖药物者;(2)出院诊断证实者;(3)入院后首次空腹血糖值在6.0 mmol/L以上者。排除标准:冠心病患者(血管造影术证实在至少一支主要冠状动脉的狭窄达到50%以上)。两组对象均为汉族非血缘个体。采用Inter-heart调查表收集研究对象的一般情况、家族史、职业史及其他情况,并取得研究对象的知情同意书。
1.2 方法
1.2.1 临床及生化指标测定 常规测量血压、身高、体质量,并根据公式BMI=体质量/身高(kg/m2)计算BMI。所有研究对象均禁食10 h以上,并于次日清晨采静脉血,由武汉市协和医院检验科按标准方法检测研究对象血清总胆固醇(TC)、三酰甘油(TG)水平。
1.2.2 基因组DNA的提取 空腹采取肘静脉血5 mL,注入EDTA-Na抗凝管离心管,于当天离心后采用美国PUREGENE公司的DNA提取试剂盒,根据说明书提取外周血中的DNA,并放入-80 ℃冰箱保存备用。
1.2.3 Taqman等位基因分型 采用美国ABI 7900HT等位基因分析仪,采用TaqMan基因分型技术分析。PCR反应采用美国荧光定量PCR(Taqman Master Mix)仪,相对的引物探针均根据仪器标准程序设定。PCR扩增条件为:94 ℃变性10 min,接着进入PCR扩增循环,92 ℃变性15 s,60 ℃退火延伸60 s,循环次数40次。每次均设有2个空白组和2个对照组以进行实验室质控。

2 结 果
2.1 位点选择及Hard-Weinberg平衡检验 根据Hapmap软件共选了IL-33的5个相关基因多态,其中rs115505在Hard-Weinberg平衡检验中P<0.05,rs1624159的最小等位基因频率P<0.05,不符合入选要求,最后共有3个基因多态入选(rs11792633、rs1929992、rs10975520)。所入选位点基因型分布在IGR组和对照组均符合Hardy-Weinberg平衡(P>0.05),说明研究对象有群体代表性。
2.2 两组对象一般资料比较 两组间的性别比、BMI及人群中吸烟、饮酒率比较差异无统计学意义(P>0.05)。IGR组的平均年龄、TC、TG水平及高血压发病率显著高于对照组,差异有统计学意义(P<0.05),见表1。
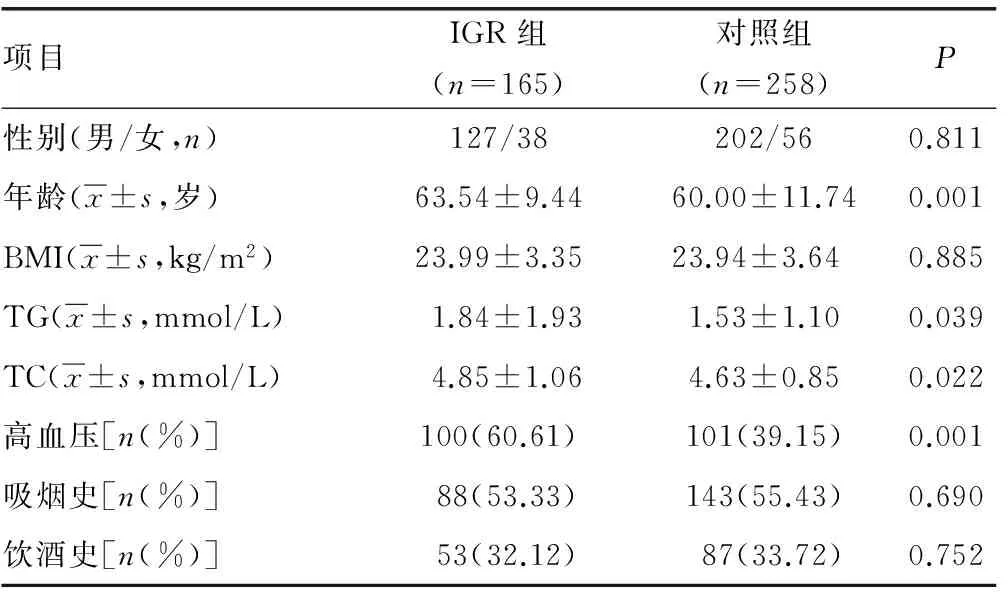
表1 各组对象一般资料比较
2.3 3种SNP基因型频率和等位基因频率的比较 与对照组比较,IGR组3个IL-33基因SNPs的基因型频率和等位基因频率分布,差异均无统计学意义(P>0.05)。进一步组合分析3个SNPs在两组间比较亦差异无统计学意义(P>0.05),见表2。
2.4 IGR组3种基因多态性与一般临床特征的相关性 IGR患者为研究对象,以rs4624606、rs1041973、rs11792633不同基因型为分类标准。观察IL-33基因的3种SNPs与IGR人群的BMI、TG、TC、高血压的相关性。结果发现,上述临床特征在3种SNPs的基因型之间,均无明显相关性(P>0.05),见表3。

表2 两组间3种SNP基因型频率和等位基因频率的比较
a:P>0.05,与本组GG基因型比较;b:P>0.05,与本组CC基因型比较;c:P>0.05,与本组TT基因型比较。
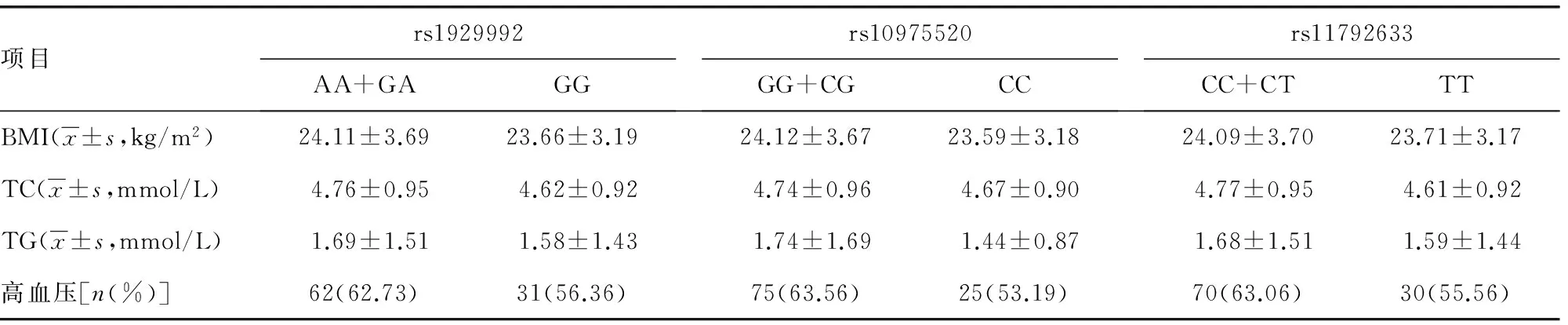
表3 基因型频率对IGR一般临床特征的影响
2.5 二元逐步Logistic回归分析 以全部研究对象为整体,以IGR分组为因变量,基因多态性rs位点为因子,行单因素Logistic回归分析,未发现某一SNP与IGR有显著相关性。在校正性别、年龄、BMI、吸烟史、饮酒史、TG、TC、高血压等因素后,仍未发现有SNP与IGR显著相关。
3 讨 论
目前认为,T2DM是一种慢性炎症疾病,IGR与炎症关系密切。Rocha等[8]研究发现,T细胞介导的免疫反应在肥胖的发生过程中起着重要的作用,其中以 Th1 细胞活性增强为主,可引起一系列促炎症细胞因子分泌的增加。以糖尿病人群为基础的研究也发现,糖尿病患者的IL-6、TNF-α水平较非糖尿病患者显著升高[9]。
IL-33/ST2L信号转导通路是近年来新发现的一种信号转导途径,在减轻多种炎症免疫过程中发挥重要的作用[10-12]。作为一种趋化Th2细胞的前炎症因子,IL-33可募集Th2细胞到炎症部位,在维持慢性炎症中起着重要的作用[13-14]。在动物实验中也证实了这一点,在大鼠脂肪组织中发现了一种能够表达ST2的细胞,称之为“脂肪相关淋巴结簇”(fat-associated lymphoid cluster,FALC)或自然辅助细胞(natural helper cell),后者在受到IL-33刺激时产生大量的Th2型细胞因子[15]。在人类脂肪组织中也发现了IL-33/ST2和IL-1受体辅助蛋白(IL-1RacP)的表达[16]。 Miller等[5]研究发现,使用IL-33重组体干预肥胖的糖尿病大鼠模型(ob/ob),可减少脂肪形成,并降低空腹血糖,提高机体对糖和胰岛素的耐受能力,提示IL-33对肥胖人群的代谢可能具有一定的保护作用。在临床研究中也证实,严重的肥胖能够使脂肪组织以自分泌的方式增加IL-33在人体中表达[6]。
本研究探讨了IL-33基因的多态性位点与IGR人群之间的关系,结果发现,入选的3个多态性位点与IGR均无相关性。进一步分析相应位点与TG、TC、BMI之间也无明显的相关性。在本课题组未发表的数据中,也分析了相关ST2的基因多态性与IGR人群的关系,也未发现二者有明显的相关性。这可能与本研究所选的SNP位点有关,也有可能与样本量偏小有关。对于研究中的结果,尚需要更大规模的样本进一步验证。另外,IGR受遗传因素与环境因素的共同影响,不同种群、人群的遗传背景不同,可能会有不同的结果。同时饮食习惯、居住环境及统计方法的选择都有可能影响研究的结果,因此,对于IL-33基因多态性与IGR人群的关系,可能需要进一步更深入的研究。
总之,通过探讨IL-33基因多态性在IGR人群中的频率分布,本研究未发现二者有明显的关联性,经多重回归分析后也差异无统计学意义(P>0.05)。但结果尚需要更大规模样本的进一步验证。
[1]Heraclides A,Jensen TM,Rasmussen SS,et al.The pro-inflammatory biomarker soluble urokinase plasminogen activator receptor (suPAR) is associated with incident type 2 diabetes among overweight but not obese individuals with impaired glucose regulation:effect modification by smoking and body weight status[J].Diabetologia,2013,56(7):1542-1546.
[2]Hasnain SZ,Borg DJ,Harcourt BE,et al.Glycemic control in diabetes is restored by therapeutic manipulation of cytokines that regulate beta cell stress[J].Nat Med,2014,20(12):1417-1426.
[3]McLaren JE,Michael DR,Salter RC,et al.IL-33 reduces macrophage foam cell formation[J].J Immunol,2010,185(2):1222-1229.
[4]Miller AM,Xu D,Asquith DL,et al.IL-33 reduces the development of atherosclerosis[J].J Exp Med,2008,205(2):339-346.
[5]Miller A,Asquith D,Hueber A,et al.Interleukin-33 induces protective effects in adipose tissue inflammation during obesity in mice[J].Circulation Research,2010,107(5):650-658.
[6]Zeyda M,Wernly B,Demyanets S,et al.Severe obesity increases adipose tissue expression of interleukin-33 and its receptor ST2,both predominantly detectable in endothelial cells of human adipose tissue[J].Int J Obes (Lond),2013,37(5):658-665.
[7]Hasan A,Al-Ghimlas F,Warsame S,et al.IL-33 is negatively associated with the BMI and confers a protective lipid/metabolic profile in non-diabetic but not diabetic subjects[J].BMC Immunol,2014,10(5):15-19.
[8]Rocha VZ,Folco EJ,Sukhova G,et al.Interferon-gamma,a Th1 cytokine,regulates fat inflammation:a role for adaptive immunity in obesity[J].Circ Res,2008,103(5):467-476.
[9]Lucas R,Parikh SJ,Sridhar S,et al.Cytokine profiling of young overweight and obese female African American adults with prediabetes[J].Cytokine,2013,64(1):310-315.
[10]Liew FY,Pitman NI,McInnes IB.Disease-associated functions of IL-33:the new kid in the IL-1 family[J].Nat Rev Immunol,2010,10(2):103-110.
[11]Sedhom M,Pichery M,Murdoch J,et al.Neutralisation of the interleukin-33/ST2 pathway ameliorates experimental colitis through enhancement of mucosal healing In mice[J].Gut,2013,62(12):1714-1723.
[12]Li D,Guabiraba R,Besnard AG,et al.IL-33 promotes ST2-dependent lung fibrosis by the induction of alternatively activated macrophages and innate lymphoid cells in mice[J].J Allergy Clin Immunol,2014,134(10):1422-1432.
[13]Kurowska-Stolarska M,Stolarski B,Kewin P,et al.IL-33 amplifies the polarization of alternatively activated macrophages that contribute to airway inflammation[J].J Immunol,2009,183(10):6469-6477.
[14]Milovanovic M,Volarevic V,Radosavljevic G,et al.IL-33/ST2 axis in inflammation and immunopathology[J].Immunol Res,2012,52(1/2):89-99.
[15]Moro K,Yamada T,Tanabe M,et al.Innate production of T(H)2 cytokines by adipose tissue-associated c-Kit(+)Sca-1(+) lymphoid cells[J].Nature,2010,463(7280):540-544.
[16]Wood IS,Wang B,Trayhurn P.IL-33,a recently identified interleukin-1 gene family member,is expressed in human adipocytes[J].Biochem Biophys Res Commun,2009,384(1):105-109.
10.3969/j.issn.1671-8348.2016.05.039
国家自然科学基金资助项目(81172750)。 作者简介:戴文琴(1975-),主治医师,硕士研究生,主要从事心血管疾病诊治的研究。
R394.3
B
1671-8348(2016)05-0690-03
2015-06-03
2015-10-10)
