绞股蓝总皂甙对肝HepG2细胞三酰甘油代谢的影响及机制*
2016-07-24陈建萍任新生孙中华郭再玉
陈建萍,任新生,李 青,孙中华,郭再玉
(1.天津泰达医院急诊科;2.天津泰达医院ICU;3.天津泰达医院肾内科;4.天津泰达国际心血管病医院心内科;5.天津泰达医院神经外科,天津300457)
论著·基础研究
绞股蓝总皂甙对肝HepG2细胞三酰甘油代谢的影响及机制*
陈建萍1,任新生2,李 青3,孙中华4,郭再玉5△
(1.天津泰达医院急诊科;2.天津泰达医院ICU;3.天津泰达医院肾内科;4.天津泰达国际心血管病医院心内科;5.天津泰达医院神经外科,天津300457)
目的 探讨绞股蓝总皂甙(GPs)对培养肝HepG2细胞三酰甘油(TG)代谢的影响及机制。方法 采用HepG2细胞为模型细胞,加入GPs进行孵育,观察其对细胞内TG的影响,并采用荧光定量PCR的方法,分析脂代谢过程中的关键酶基因,包括乙酰辅酶A羧化酶(ACAC)A、ACACB、脂肪酸合成酶(FASN)、乙酰辅酶A乙酰转移酶(ACAT1)、棕榈酰辅酶A氧化酶(ACOX1)及肉碱脂酰转移酶(CPT)1、2。并进一步在细胞水平干扰关键酶基因,验证其对TG代谢的影响。结果 GPs可显著降低HepG2细胞的TG水平,发现GPs可显著抑制FASN基因的表达及其在较高水平下促进CPT1基因的表达,其蛋白水平的表达改变与基因表达一致。在细胞水平瞬时干扰FASN的表达,在干扰FASN后,GPs降低TG的幅度显著减少,提示GPs主要通过抑制FASN起作用。结论 GPs可减少肝HepG2细胞内TG水平,其作用主要是通过抑制FASN的表达而抑制脂肪酸的合成。
绞股蓝总皂甙;甘油三酯类;脂肪酸合成酶复合物;肉碱脂酰转移酶
绞股蓝(gynostemma pentaphyllum)为葫芦科绞股蓝属植物绞股蓝的根状茎或全草,为我国常用中药,具有清热解毒、止咳化痰、补气生津、健脾安神之功效。现代药学研究表明,其主要药效成分为绞股蓝总皂苷(gypenosides,GPs),它是从绞股蓝中分离获得的80 余种皂苷的总称,现已研究发现其抗肿瘤、抗血小板聚集、抗氧化、抗缺血再灌注损伤及调节脂质代谢等作用显著,并能够有效地保护心脑血管和肝脏损伤[1]。近年来,越来越多的研究显示GPs对血脂代谢有重要的调节作用,能有效防治高脂血症及动脉粥样硬化。如灌胃给予高脂乳剂的大鼠服用GPs后,大鼠血脂中总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)及三酰甘油(TG)水平有显著降低,对高密度脂蛋白胆固醇(HDL-C)有升高作用,显示绞股蓝提取物具有改善高脂血症的作用[2]。在实验中发现GPs能通过对血脂的调节,减少动脉粥样硬化的发生[3-4]。其降低TC、可能与促进肝细胞低密度脂蛋白受体(LDLR)的表达有关[5]。尽管这些研究提示GPs对血脂代谢有重要的调节效应,但具体的机制并不十分清楚。鉴于肝脏在脂质代谢中的核心作用及TG在肝脏中蓄积导致脂肪肝的发生、发展,因此,本文选择肝HepG2细胞模型,探讨GPs对TG的影响,并探索其作用机制。
1 材料与方法
1.1 材料 HepG2细胞购自美国ATCC细胞库(ATCC HB-8065),培养基为含10%胎牛血清FBS (Gibco,Grand Island,NY) 的MEM (Invitrogen,Carlsbad,CA,USA) ,置于37 ℃的5%CO2的培养箱。GPs购自上海同田生物技术有限公司, 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)购自江苏碧云天生物技术研究所。TG测定试剂盒购自上海生物制品研究所。乙酰辅酶A羧化酶(ACAC)A、ACACB、脂肪酸合成酶(FASN)、肉碱脂酰转移酶Ⅰ(CPT1)及GAPDH的抗体均购自美国的Abcam公司(Cambridge,MA)公司。
1.2 方法
1.2.1 细胞增殖活力测定 采用MTT法检测细胞的增殖活性。GPs用二甲基亚砜DMSO配成10 mg/mL的母液,实验时用培液稀释至相应的浓度。HepG2接种于96孔培养板,每孔细胞数为5×103个,实验组分别给予终浓度为125、25、5、1 μg/mL的GPs,以0.1% DMSO为溶剂对照。加药孵育时间为48 h,然后每孔加入20 μL 5 mg/mL的MTT,孵育4 h,弃培养液,然后每孔加入150 μL的DMSO,摇匀10 min,然后置于酶标仪测波长490 nm的每孔吸光度(A),以对照组细胞为100%,其他组根据A值进行相应的换算。每组有4个重复孔,实验重复3次。
1.2.2 细胞内TG的测定 HepG2细胞接种于6孔板,每孔的细胞数为4×105个,接种过夜后再加入不同浓度的GPs孵育24 h,选用50 μmol/L的非诺贝特(Fenofibrate)作为阳性对照。细胞经加药处理后,收集细胞,进行TG的测定。具体方法如下:各管加入800 μL异丙醇,置冰上静置提取1 h,然后置4 ℃ 12 000×g离心15 min。取上清真空抽干,最后用20 μL异丙醇溶解,用于测定细胞TG水平。TG水平的测定采用TG试剂盒根据说明书进行测定。另外取离心后的沉淀用20 μL的蛋白RIPA裂解液溶解后测定其蛋白水平,采用BCA方法按照操作说明进行,结果表示为每毫克细胞总蛋白中所含的TG(μg/mg)。每组有3个重复孔,实验重复3次。
1.2.3 荧光定量PCR HepG2细胞接种于6孔板,每孔的细胞数为4×105个,接种过夜后再加入不同浓度的GPs孵育24 h。收集细胞,每孔加入1 mL TRIzol裂解细胞后收集至1.5 mL无RNA酶离心管,提取总RNA。然后用Invitrogen产品的反转录酶试剂盒(SuperScript II Reverse Transcriptase kit)合成cDNA。以cDNA为模版,采用TOYOBO公司的荧光定量PCR试剂盒(SYBR Green Realtime PCR Master Mix)进行检测,内参基因选择GAPDH。具体方法如下:模版为2 μg,引物为0.2 μmol/L,PCR预混合试剂为10 μL,加水补至20 μL的终体积,混合试剂置于ABI7300定量PCR仪进行检测。反应结束后计算△△CT值,并设对照组为1。各基因的引物序列,见表1。
1.2.4 蛋白免疫印迹分析 HepG2细胞接种于6孔板,每孔的细胞数为4×105个,接种过夜后再加入不同浓度的GPs孵育24 h,选用50 μmol/L的非诺贝特(Fenofibrate)作为阳性对照。收集细胞,用蛋白裂解液(RIPA)收集细胞的总蛋白直接用于蛋白免疫印迹分析。蛋白免疫印迹方法如下:每孔细胞总蛋白的上样量为10 μg,用聚丙烯酰胺凝胶电泳分离,然后用转移至硝酸纤维素膜。用5%脱脂奶粉的含0.1%的Tris缓冲液(TBST)室温封闭2 h,再用一抗在4 ℃孵育过夜。一抗用TBST洗涤后,再用相应的二抗在室温孵育1 h,最后用相应灵敏度的ECL发光剂进行发光。
1.2.5 siRNA检测 HepG2细胞接种于6孔板,每孔的细胞数为2×105个,接种过夜后再加入干扰RNA(siRNA),FASN的siRNA是购自于商品化的4个siRNA的混合物 (Dharmacon Inc.,Lafayette,Co.),并用scrambled siRNA 作为阴性对照。使用Invitrogen公司的lipofectamine 2000按标准操作说明进行转染。转染48 h后,再加入GPs处理24 h,一部分样本采用蛋白免疫印迹方法进行干扰效率的验证,一部分样本用于测定细胞内TG水平,方法同上。

2 结 果
2.1 GPs可降低培养HepG2细胞的TG水平 采用MTT的方法,观察GPs对HepG2细胞的增殖活性影响。GPs为125 μg/mL时可显著降低HepG2细胞的增殖活力,在25 μg/mL时对细胞活性有轻度的抑制作用,而在5、1 μg/mL时对细胞增殖活性无明显抑制作用,见图1。因此,为了排除GPs其他作用的干扰,本研究选择了GPs 25、5、1 μg/mL对肝细胞TG代谢的影响。GPs与HepG2孵育24 h后,测定细胞内TG水平,发现GPs 25、5 μg/mL可显著降低细胞内TG水平,而在GPs 1 μg/mL时无明显作用。GPs在25 μg/mL时对肝细胞的降TG效应与阳性对照药非诺贝特(Fenofibrate)在50 μmol/L时效应较为接近,显示其较好的降脂效果,见图2。
2.2 GPs对脂肪酸代谢相关基因表达的影响 采用荧光定量PCR的方法,检测ACACA,ACACB、FASN、乙酰辅酶A乙酰转移酶(ACAT1)、棕榈酰辅酶A氧化酶(ACOX1)、CPT1及CPT2基因在GPs作用24 h后的表达改变。GPs对FASN有显著的抑制作用,对CPT1在25 μg/mL时有一定的促进作用,而对其他一些基因的表达无明显影响(图3)。结果提示,GPs可能通过抑制脂肪酸的合成,及一定程度上激活脂肪酸氧化来降低TG水平,而促进脂肪酸氧化与阳性对照药非诺贝特作用特点相似。

1:对照组;2:1 μg/mL GPs组;3:5 μg/mL GPs组;4:25 μg/mL GPs组;5:125 μg/mL GPs组;a:P<0.05,与对照组比较。
图1 GPs与HepG2细胞孵育48 h对HepG2细胞
增殖活性的影响

1:对照组;2:1 μg/mL GPs组;3:5 μg/mL GPs组;4:25 μg/mL GPs组;5:阴性对照组;a:P<0.05,与对照组比较。
图2 GPs与HepG2孵育24 h对细胞TG水平的影响

1:ACACA;2:ACACB;3:FASN;4:ACAT1;5:ACOX1;6:CPT1;7:CPT2。a:P<0.05,与对照组相比。
图3 GPs对脂肪酸合成及代谢关键酶基因表达的影响
2.3 GPs可抑制FASN的蛋白表达 GPs可以显著降低FASN的基因表达及促进CPT1的基因表达,由于蛋白水平是分子功能的执行体,因此本研究进一步检测了这些分子在蛋白水平的改变情况。用GPs处理HepG2细胞24 h,并选用阳性对照药非诺贝特作为对照。采用蛋白免疫印迹的方法,检测药物作用24 h的蛋白表达,GPs可显著抑制FASN的蛋白表达,并与剂量浓度相关(图4)。GPs在25 μg/mL时对CPT1的蛋白表达有一定的促进作用,而阳性对照药非诺贝特可显著促进CPT1表达。另外, ACACA也是脂肪酸合成的关键酶,结果显示其在蛋白水平也无改变,与基因的检测结果一致。以上结果提示,GPs降TG水平与其抑制脂肪酸合成有关,而与阳性对照药非诺贝特主要促进脂肪酸氧化代谢有所不同。
2.4 干扰FASN的表达可显著减少GPs的降脂效应 FASN的干扰效率采用蛋白免疫印迹方法进行验证,在FASN未干扰组中,加入GPs后,FASN显著减少,而在FASN干扰组中,加入GPs后,FASN下降幅度有所缩小(图5A)。同时,检测了细胞内TG水平(图5B),加入GPs后,细胞内的TG水平明显下降,与上述结果一致;另外,HepG2在干扰FASN后,细胞内的TG水平也显著下降,然而在干扰TG的情况下,GPs降TG的作用幅度显著减少。

-:不添加化合物;+:添加化合物。
图4 GPs对脂肪酸合成及代谢酶的蛋白表达影响
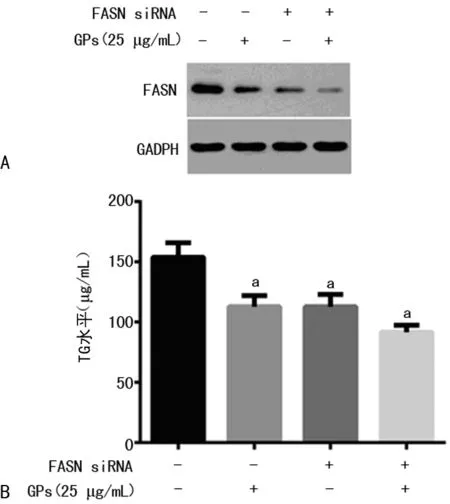
A:蛋白免疫印迹方法;B:细胞内TG水平;a:P<0.05,与对照组比较。-:不添加化合物,+:添加化合物。
图5 干扰FASN对GPs降脂效应的影响
3 讨 论
本研究中,对GPs在肝HepG2 TG代谢中的作用进行了深入的研究,发现GPs具有明显降低肝HepG2 TG的作用,提示其在防治肝细胞脂肪沉积中的应用前景。肝细胞作为体内脂代谢的中心枢纽,是连接血脂平衡和肝脏脂代谢平衡的关键,本研究的结果也提示GPs能够减少血中TG,其可能的原因是通过抑制肝脏的脂质合成来起作用。前期的研究中发现GPs可显著降低高脂肪高胆固醇饮食大鼠的血脂[6],如降低血中的TG、TC、游离脂肪酸及低密度脂蛋白,并且能够显著地减少大鼠肝脏的脂质沉积,这一现象与本研究结果一致,即GPs可能在改善脂肪肝方面有一定的潜在应用价值。
回顾近几年的文献,许多研究关注GPs在抗肿瘤中的应用,如GPs可通过促进内质网应激及线粒体凋亡通路诱导口腔鳞癌细胞SCC-4的周期阻滞及凋亡[7],还可通过下调NF-κB及基质金属蛋白酶9(MMP-9)来抑制SCC-4细胞的转移[8];GPs诱导线粒体凋亡的作用在多种肿瘤细胞中已经证实,如结肠癌细胞[9]、肺癌细胞[10-11]及肝癌细胞[12-13]。这些研究提示,GPs在一定的浓度下对肿瘤细胞有杀伤作用,因此为了排除本模型中其对HepG2的细胞毒作用带来的干扰,首先摸索了合适的剂量浓度。GPs在125 μg/mL的浓度下可显著抑制HepG2细胞的增殖活性,而在25 μg/mL浓度下虽有一定的抑制,但相对不十分明显,因此选择了25 μg/mL以下的几个剂量浓度用于研究。在这样的浓度下,发现GPs抑制TG的作用是较为直接的作用。从另一方面来看,抑制TG合成可能对其抗肿瘤作用有一定的帮助,因为脂质合成是肿瘤细胞增殖分裂的物质基础。
为了研究GPs降细胞内TG的机制,本研究对脂肪酸代谢中关键酶的基因进行了分析,如ACAC的两个亚基ACACA和ACACB,ACAC催化乙酰辅酶A生成丙二酰辅酶A,是脂肪酸从头合成的限速酶,也是降脂药物开发的潜在靶点[14-15],然而GPs对其无影响。FASN是促进脂肪酸长链合成的主要催化酶,对于脂肪酸的合成至关重要。本研究结果显示,GPs可显著抑制FASN的基因表达,提示其重要的降脂机制。本研究也考察了脂肪酸合成过程中的ACAT1,发现对其无明显调节作用。另外,也对脂肪酸β氧化代谢的酶进行了分析,如ACOX1,它是脂肪酸β氧化的第一个催化酶,然而GPs亦对其表达无明显作用;CPT1是脂肪酸β氧化代谢的关键限速酶,GPs在较高的浓度下可促进其表达,提示GPs可能也促进脂肪酸的氧化代谢。本研究在蛋白水平进行验证,结果与基因的表达一致,即GPs显著抑制FASN的表达及在较高浓度下促进CPT1的表达。以上结果提示GPs可能通过抑制脂肪酸合成及促进其氧化来降低TG水平。
为了进一步验证FASN在GPs降TG的作用,本研究观察在干扰FASN的情况下GPs降TG的效应。结果显示,干扰FASN可显著降低肝细胞TG水平;与非干扰FASN的条件下GPs降TG的效应相比,HepG2细胞在干扰FASN后GPs降TG的幅度显著减少,结果表明FASN是GPs降TG的主要机制,即GPs通过抑制FASN表达而降低TG的效应。虽然GPs也可能存在促进脂肪酸β氧化代谢,本研究结果提示其可能的主要作用是通过抑制FASN来介导。但是GPs是如何来抑制FASN的表达,并不清楚,有待于今后进一步的深入研究。
综上所述,本研究首次报道了GPs对培养肝HepG2细胞的降脂效应,其降TG效应主要是通过抑制FASN的表达来抑制脂肪酸的合成,另一方面可能在一定程度上具有促进脂肪酸β氧化代谢的作用。本研究结果为阐释GPs降脂效应提供了理论基础,并为其今后在临床上的应用提供实验依据,具有重要的科学意义。然而目前对于GPs在降脂中的作用及机制仍十分有限,需要进一步系统全面的深入研究,才能为其临床应用提供良好的研究基础。
[1]金亭亭,孙兆林,江蔚新.绞股蓝化学成分及药理作用研究进展[J].亚太传统医药,2014,10(16):30-32.
[2]沈楠,许文频,李敏,等.绞股蓝皂苷对高脂血症大鼠脂代谢的影响[J].中西医结合心脑血管病杂志,2011,9(9):1081-1083.
[3]贺琴,谭华炳,赵琴.绞股蓝总皂甙抗高脂血症致动脉粥样硬化的机制研究进展[J].中西医结合心脑血管病杂志,2009,7(4):464-465.
[4]汪鋆植,胡格,翟文海.绞股蓝总皂苷外用对高血脂小鼠的降血脂作用研究[J].中国民族民间医药杂志,2007,16(1):41-43.
[5]王亚利,范春雷,窦晓兵.绞股蓝总皂苷对肝细胞低密度脂蛋白受体表达的影响[J].中国药理学通报,2010,26(1):138-139.
[6]Qin R,Zhang J,Li C,et al.Protective effects of gypenosides against fatty liver disease induced by high fat and cholesterol diet and alcohol in rats[J].Arch Pharm Res,2012,35(7):1241-1250.
[7]Chen JC,Lu KW,Tsai ML,et al.Gypenosides induced G0/G1arrest via CHk2 and apoptosis through endoplasmic reticulum stress and mitochondria-dependent pathways in human tongue cancer SCC-4 cells[J].Oral Oncol,2009,45(3):273-283.
[8]Lu KW,Tsai ML,Chen JC,et al.Gypenosides inhibited invasion and migration of human tongue cancer SCC4 cells through down-regulation of NFkappaB and matrix metalloproteinase-9[J].Anticancer Res,2008,28(2A):1093-1099.
[9]Yan H,Wang X,Wang Y,et al.Antiproliferation and anti-migration induced by gypenosides in human colon cancer SW620 and esophageal cancer Eca-109 cells[J].Hum Exp Toxicol,2014,33(5):522-533.
[10]Lu HF,Chen YS,Yang JS,et al.Gypenosides induced G0/G1arrest via inhibition of cyclin E and induction of apoptosis via activation of caspases-3 and -9 in human lung cancer A-549 cells[J].In Vivo,2008,22(2):215-221.
[11] Liu JS,Chiang TH,Wang JS,et al.Induction of p53-independent growth inhibition in lung carcinoma cell A549 by gypenosides[J].J Cell Mol Med,2015,19(7):1697-1709.
[12]Sun DP.Gypenosides induce apoptosis by Ca2+overload mediated by endoplasmic-reticulum and store-operated Ca2+channels in human hepatoma cells[J].Cancer Biother Radiopharm,2013,28(4):320-326.
[13]Shi L,Pi Y,Luo C,et al.In vitro inhibitory activities of six gypenosides on human liver cancer cell line HepG2 and possible role of HIF-1α pathway in them[J].Chem Biol Interact,2015,238(1):48-54.
[14]Tong L.Acetyl-coenzyme A carboxylase:crucial metabolic enzyme and attractive target for drug discovery[J].Cell Mol Life Sci,2005,62(16):1784-1803.
[15] Peng Y,Lei T,Yuan J,et al.Arachidonic acid induces acetyl-CoA carboxylase 1 expression via activation of CREB1[J].Endocrine,2009,36(3):491-497.
Effect of gypenosides on triglycerides metabolism of hepatic HepG2 cells and its mechanism*
ChenJianping1,RenXinsheng2,LiQing3,SunZhonghua4,GuoZaiyu5△
(1.DepartmentofEmergency,TianjinTedaHospital,Tianjin300457,China;2.ICU,TianjinTedaHospital,Tianjin300457,China;3.DepartmentofNephrology,TianjinTedaHospital,Tianjin300457,China;4.DepartmentofCardiology,TianjinTedaInternationalCardiovascularDiseasesHospital,Tianjin300457,China;5.DepartmentofNeurosurgery,TianjinTedaHospital,Tianjin300457,China)
Objective To explore the effect and mechanism of gypenosides (GPs) on triglycerides(TG) metabolism in cultured liver HepG2 cells.Methods The HepG2 cells were adopted as the model cells and incubated with GPs.Their effect on intracellular triglycerides was observed.The fluorescent quantitative RT-PCR was adopted to analyze the expression of key enzyme genes in lipid metabolism including acetyl-CoA carboxylase (ACACA,ACACB),fatty acid synthase (FASN),acetyl-CoA acetyltransferase 1 (ACAT1),acyl-CoA palmitoyl oxidase 1(ACOX1),carnitine palmitoyltransferase 1 (CPT1) and carnitine palmitoyltransferase 2 (CPT2).Then the effect on TG metabolism was further verified by interfering the key enzyme gene at the cellular level.Results GPs could significantly decrease the level of intracellular triglycerides in HepG2 cells,and could significantly inhibit the expression of FASN gene and promote the expression of CPT1 gene in a higher concentration,and its protein level expression was consistent with the gene expression.Moreover,the expression of FASN was transiently interfered at the cellular level,after interfering FASN,the magnitude of GPs in decreasing TG was significantly decreased,suggesting that GPs played the effect mainly by inhibiting FASN.Conclusion GPs could decrease the intracellular TG level of liver HepG2,its effect in inhibition of the synthesis of fatty acid is mainly through the inhibition of FASN.
gypenosides;triglycerides;fatty acid synthetase complex;carnitine palmitoyltransferase
10.3969/j.issn.1671-8348.2016.05.007
滨海新区卫生局联合攻关项目(2012BWKL006)。 作者简介:陈建萍(1972-),主治医师,大学本科,主要从事普通内科和急诊内科的临床与研究工作。△
,Tel:(022)25222586;E-mail:zaiyu_guo@126.com。
R575.5
A
1671-8348(2016)05-0598-04
2015-07-01
2015-11-10)
