甜瓜T-DNA插入突变体的构建
2016-07-23许荣华姜陆宁雪飞李冠
许荣华,姜陆,宁雪飞,李冠
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
甜瓜T-DNA插入突变体的构建
许荣华,姜陆,宁雪飞,李冠
(新疆大学生命科学与技术学院,乌鲁木齐830046)
摘要:【目的】构建激活标签载体并将其转入甜瓜中,获得甜瓜T-DNA插入突变体,为甜瓜功能基因组学的研究奠定基础。【方法】用PCR法扩增目的DNA片段,经EcoRI和SacI顺序酶切,将目的片段连接到pCAMBIA2301载体上,构建含4×35s Enhancer DNA片段的激活标签载体。以甜瓜品种 ‘伽师’为材料,利用农杆菌介导的转化体系转化甜瓜愈伤组织,获得甜瓜T-DNA插入突变体。【结果】获得4株T0代甜瓜转化幼苗,通过Kan筛选和PCR鉴定甜瓜转化幼苗的DNA中是否含有目的基因,证明其中3株甜瓜转化幼苗为转基因植株。【结论】获得了突变植株,为甜瓜重要性状基因发掘奠定基础。
关键词:甜瓜;激活标签;T-DNA插入突变体
0引 言
【研究意义】甜瓜(CucumismeloL.)是全球的10大水果之一[1],也是葫芦科基因组学研究的模式种。新疆作为厚皮甜瓜的次生起源中心之一,甜瓜品种类型之多、品质之佳、分布之广、栽培面积之大均居全国首位,有许多品质优良的甜瓜种质资源,然而各品种均存在抗病性差、不耐弱光等问题[2]。尽管2012年甜瓜基因组测序的完成获得了大量甜瓜基因组序列的数据[3],但是DNA或者蛋白质本身不能为基因的各项生物学功能提供足够的信息。研究基因功能最直接的方法之一是破坏基因的表达并分析由此带来的表型变化。由于除了能破坏插入位点基因的表达,插入的片段还能在分析突变体时用作分子标记,转座子和农杆菌T-DNA插入突变已经成为最广泛应用的方法。由于T-DNA插入拷贝数低,平均每一个转化植株只含1.5个拷贝,而且能在后代稳定遗传,农杆菌T-DNA插入突变已经成为研究功能基因组学应用最广泛的方法大规模构建甜瓜突变体,对表型特异突变体进行筛选与分析,明确相关基因的功能为甜瓜优良基因资源的利用奠定了基础。【前人研究进展】1992年,Hayashi等[4]创造出来激活标签(Activation tagging)技术,构建了带有四个串联花椰菜病毒35S启动子是增强子序列的T-DNA载体,转入植物中获得基因过表达的突变体。激活标签技术在基因功能组学研究中发挥着重要的作用,激活标签法构建突变体已应用到拟南芥[5],水稻[6],棉花[7],油菜[8],番茄[9],矮牵牛[10]等植物基因功能研究中,并取得较好成果。运用激活标签法,已从拟南芥中分离出lep、sturdy等30多种新的基因,并对ft、myb、yucca等基因进行了详细的功能研究。其中ft基因编码的蛋白产物是成花激素,是拟南芥诱导开花途径中的重要基因;MYB转录因子基因编码的MYB转录因子参与植物次级代谢过程,在木质部合成和分化过程中起重要调控作用;与生长素含量有关的yucca基因编码黄素类单加氧酶,YUCCA酶是色胺途径中形成吲哚-3-乙醛肟的关键酶,YUCCA基因过表达导致吲哚-3-乙醛肟过剩,生长素含量上升,表现为高激素显性[11-15]。而且Tani等发现,拟南芥中的激活标签载体不仅可用于研究植物的生长发育,也可用于发现抗病基因[16]。【本研究切人点】目前国内外主要采用EMS化学诱变的方法获得甜瓜突变体,结合高通量测序的方法点突变进行检测[17]。而插入突变的方法在甜瓜构建突变体研究中并未见相关报道。通过T-DNA激活标签法获得甜瓜突变体,可实现对甜瓜基因功能的深入研究。【拟解决的关键问题】构建激活标签载体并转化甜瓜愈伤组织,获得再生植株,为甜瓜重要性状基因的发掘奠定基础,为分子标记辅助改良甜瓜品种提供理论依据。
1材料与方法
1.1材 料
1.1.1植物材料
甜瓜品种为卡拉克赛(又名伽师瓜),种子购自于新疆哈密瓜种业有限责任公司。该品种的特点是晚熟(生育期110~119 d)、耐贮藏和耐运输,高产,品质中等,致命弱点是抗病性差。
1.1.2菌种和质粒
E.coliDH5α,农杆菌菌株Gv3101为实验室保存;pCAMBIA2301质粒为实验室保存;pBinGlyRed3-35S质粒(含4×35s Enhancer)由华中农业大学的张椿雨先生所赠。
1.1.3工具酶和主要试剂
限制性内切酶(EcoRI和SacI)、T4DNA连接酶、Taq酶、DNA marker购自TaKaRa公司;质粒小提试剂盒、DNA回收试剂盒购自上海宝生物工程公司;卡那霉素(Kanamycin)、头孢(Cephalosporins)、利福平(Rifampicin),其余常用试剂均为国产分析纯。
1.2方 法
1.2.1PCR引物设计
根据pBinGlyRed3-35s质粒所含的4×35s Enhancer DNA序列,设计含有EcoRI(下划线部分)上有引物:5’-GGAATTCCGCAGCGTATGGAT-3’和SacI(下划线部分)下游引物:5’-CGAGCTCGATATAGAGGAAGGGTCT-3’。引物由上海生物工程公司合成。
1.2.2激活标签载体的构建
以pBinGlyRed3-35s为模板进行PCR扩增,扩增条件为94℃预变性4 min ,94℃变性45 s,56℃退火45 s,72℃延伸90 s,共35个循环, 72℃延伸10 min。1%的琼脂糖凝胶电泳进行PCR 产物检测、测序。利用EcoRI和SacI顺序酶切目的片段和pCAMBIA2301,切胶回收,16℃过夜连接,在T4DNA连接酶作用下构建激活标签载体pCAMBIA2301-35s,热激法将激活标签载体转化到大肠杆菌E.coli中,经菌液PCR和酶切鉴定、测序。
1.2.3农杆菌Gv3101感受态细胞及转化
制备农杆菌Gv3101感受态细胞,利用冻融法[18]将构建好的激活标签载体转入农杆菌Gv3101感受态细胞中,并保存于 -80℃备用。
1.2.4农杆菌介导甜瓜转化及培养
取无菌培养条件下萌发的甜瓜子叶,切取子叶中段,接种于预培养基(MSB+1.0mg/L 6-BA)上预培养3~5 d;取出外植体置于含有农杆菌菌液(OD600=0.5~0.7)的YEB液体培养中浸泡10 min,用无菌滤纸吸干外植体表面过多菌液,置于培养基(MSB+1.0 mg/L 6-BA)上暗培养 3~5 d;用200 mg/LCef水洗外植体后转接到筛选分化培养基(MSB+1 mg/L 6-BA+500 mg/L Cef+50 mg/L Kan)上培养;待芽长至2 cm左右,切取小芽,转入伸长培养基(MSB+0.1 mg/L 6-BA+0.1 mg/L GA3+500 mg/L Cef+50 mg/L Kan);最后置于生根培养基中(MSB+MSB+0.01 mg/L NAA)中生根。
1.2.5转化苗PCR鉴定
DNA提取参照陆璐等[19]CTAB 法进行,以转化苗DNA为模板,用4×35s Enhancer基因序列扩增的引物按照如下程序扩增:94℃预变性4 min后,94℃变性45 s,56℃退火45 s,72℃延伸90 s,共35个循环,最后72℃延伸10 min,扩增产物进行1%的琼脂糖凝胶电泳检测。
2结果与分析
2.14×35 s Enhancer基因克隆
以pBinGlyRed3-35s为模板,设计带有酶切位点(EcoRI,SacI)的引物,PCR扩增4×35 s Enhancer DNA片段,扩增产物经琼脂糖凝胶电泳检测与预期大小相符。将扩增产物送至北京六合华大基因测序,测序表明PCR扩增目的基因序列正确。图1
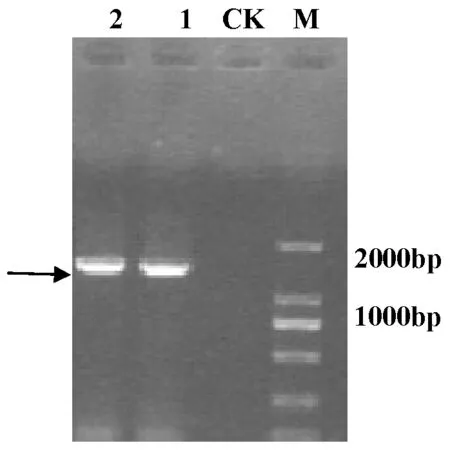
M:DL2000 marker;CK:阴性对照;1,2:4×35s Enhancer PCR结果
M:DL2000 marker;CK:negative control;1,2:PCR products of 4×35s Enhancer
图1带有酶切位点的4×35s Enhancer PCR扩增
Fig.1 The amplification of 4×35s Enhancer with the two restricted sites ofEcoRI andSacI
2.2激活标签载体的构建
用EcoRI和SacI顺序酶切目的片段和pCAMBIA2301,切胶回收并过夜连接,后转化到DH5α中,挑取具Kan抗性的阳性克隆,试剂盒提取重组质粒DNA,经EcoRI和SacI顺序酶切鉴定酶切鉴定和测序验证表明激活标签载体pCAMBIA2301-35s构建成功,该载体含有4×35s EnhancerDNA片段。构建好的激活标签载体经冻融法转化到农杆菌Gv3101中,在筛选培养基(含Kan和Rif)上培养,挑取克隆在含有Kan和Rif的YEB液体培养基中28℃培养48 h,菌落PCR检测,结果显示有目的片段,表明已得到含有4×35s Enhancer DNA片段的Gv3101工程菌,可以用于愈伤组织的侵染。图2,3
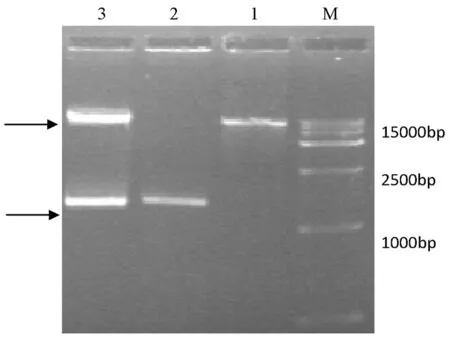
M:DL15000 marker;1:pCAMBIA2301;2:4×35s Enhancer;3:EcoRI和SacI顺序酶切结果
M:DL15000 marker;1: pCAMBIA2301;-:4×35s Enhancer;3:EcoRI andSacI enzyme digestion
图2重组质粒pCAMBIA2301-35s的EcoRI和SacI顺序酶切鉴定
Fig.2Recombinant plasmid pCAMBIA2301-35s byEcoRI

M:DL2000 marker;+:阳性对照;-:阴性对照;1-8:菌落PCR
M:DL2000 marker;+:positivecontrol;-:negative control;1-8:PCR product of 8 transformedAgrobacteriumclons
图3Gv3101工程菌菌落PCR扩增
Fig.3PCR product of transformedAgrobacteriumclons
2.3农杆菌介导甜瓜转化及培养
在无菌条件下培养卡拉克塞种子3~5 d获得无菌苗,切取子叶中段接种于预培养基上培养3~5 d,经农杆菌侵染后接种于MS培养基上共培养3~5 d,共培养后的外植体置于筛选培养基上筛选培养,21 d左右外植体长出从生芽,切取外植体上的从生芽并接种到不定芽伸长培养基上继续培养,获得再生苗,待再生苗长至3~5 cm时,自其基部切下并转接到生根培养基,生根。图4

A:伽师瓜幼苗;B:预培养的外植体;C:农杆菌侵染外植体;D:抗性愈伤组织预分化;E:转化植株幼苗;F:转化植株的生根练苗
A:Jiashi melon seeding;B:explants of pre-culture;C:Agrobacteriumtumef aciens infected explants ;D:pre-differentiation of resistant callus;E:seeding of transgenic plants;F:rooting and strengthening of transformed plantlets
图4甜瓜遗传转化过程
Fig.4The process of genetic transformation in melon
2.4转基因甜瓜苗的PCR鉴定
研究共获得3株正常生长的阳性植株,用目的基因的引物对筛选出的T0代转基因甜瓜幼苗进行PCR扩增检测。结果表明,有3 株转化苗可扩增出与目的片段大小一致的目的条带,初步表明4×35s Enhancer DNA片段已转入甜瓜基因组中。图5
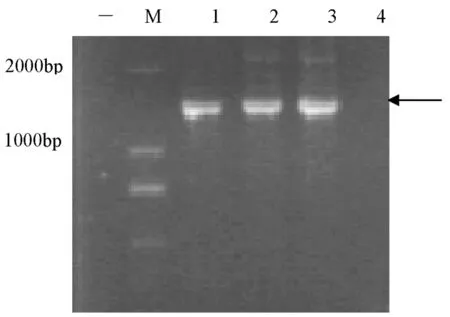
M:DL2000 marker;-:阴性对照;1-4:4株转化苗PCR结果
M:DL2000 marker;-:negative control;1-4:PCR product of 4 transgenic melons
图5转基因植株PCR扩增结果
Fig.5The PCR results of the transgenic plants
3讨 论
根癌农杆菌介导甜瓜的转化和组织培养过程中必须保证全程无其他杂菌,因此需要做好种子消毒工作。甜瓜种子带有内生菌,消毒不彻底会使再生苗受到污染而不能使用,经实验发现放置时间较久的种子带有的内生菌较多,因此,应选择当年获得的种子作为合适的实验材料[20]。
激活标签法是引入增强子或强启动子,通过改变临近基因的表达模式与表达水平,使其过量表达或异时空表达,而产生功能获得型突变,从而对该基因进行分离和鉴定的方法[21]。构建含4×35s Enhancer的激活标签载体,并插入到植物基因组中,附近的基因表达活性可能大大增强,这可用于拟南芥,甜瓜等植物突变体库的创建和筛选。激活标签法在植物基因的分离、鉴定和植物基因功能的研究中发挥重要的作用。
4结 论
克隆了4×35s Enhancer目的片段,通过EcoRI和SacI顺序酶切目的片段和载体pCAMBIA2301后,成功构建了激活标签载体pCAMBIA2301-35s,用于甜瓜的遗传转化。通过农杆菌侵染甜瓜愈伤组织,进行甜瓜的遗传转化,获得甜瓜T-DNA插入突变体,经PCR检测,初步证明4×35s Enhancer已导入甜瓜基因组中。待甜瓜转基因幼苗成长并在当代产生显性突变,后通过基因定位技术确定基因的位置,确定该基因的功能,为发掘和利用甜瓜优良基因奠定基础。
参考文献(References)
[1] 苏芳,郭绍贵,宫国义,等.甜瓜基因组学研究进展[J].分子植物育种,2007,(4):540-547.
SU Fang,GUO Shao-gui, GONG Guo-yi, et al.(2007).Progress in Research on Melon Genomics [J].MolecularPlantBreeding, (4): 540-547. (in Chinese)
[2] 王贤磊.甜瓜遗传图谱的构建与抗病基因遗传分析[D].乌鲁木齐:新疆大学博士论文,2011.
WANG Xian-lei.(2011).GeneticMapConstructionandDiseaseResistanceGeneAnalysisofCucumisMeloL.[D]. PhD Dissertation. Xinjiang University, Urumqi. (in Chinese)
[3] 马荣良.西班牙科学家完成甜瓜基因组测序[N].中国食品安全报, 2012.
MA Rong-liang.(2012).Spanish Scientists Completed Melon Genome Sequencing [N].ChniaFoodSafetyNews,(in Chinese)
[4] Hayashi, H., Czaja, I., Lubenow, H., Schell, J., & Walden, R. (1992). Activation of a plant gene by t-dna tagging: auxin-independent growth in vitro.Science, 258(5086):1,350-1,353.
[5] 关艳龙,李婉莎,殷奎德,等.激活标签法构建拟南芥突变体库及其表型分析[J].植物分类与资源学报,2010,32(1):53-59.
GUAN Yan-Long, LI Wan-sha, YIN Kui-de, et al.(2010).Constructing and Phenotypic Analyzing an Activation Tagging Arabidopsis Mutant Pool [J].PlantDiversityandResources, 32(1):53-59. (in Chinese)
[6] 陈志辉. 水稻T-DNA插入突变体库构建与利用及miRNA基因功能研究 [D]. 武汉:华中农业大学博士论文,2015.
CHEN Zhi-hui.(2015).GenerationandUtilizationofRiceT-DNAInsertionalMutantLibraryandFunctionStudiesofmiRNAGenes[D]. PhD Dissertation. Huazhong Agricultural University,Wuhan . (in Chinese)
[7] 杨作仁. 棉花T-DNA激活标签突变体pag1分子机制的研究与应用 [D].北京:中国农业科学院,2014.
YANG Zuo-ren. (2014).ThemolecularmechanismofaT-DNAactivating-taggedcottonmutantanditsapplication[D]. PhD Dissertation. Chinese Academy of Agricultural Sciences, Beijing. (in Chinese)
[8] 黄琪,郑香峰,马忠岩,等.激活标签法初步构建甘蓝型油菜(Brassica napus)突变体库[C]//.2013全国植物生物学大会论文集.2013.
HUANG Qi, ZHENG Xiang-feng, MA Zhong-yan, et al. (2013).PreliminaryConstructiontheMutantPoolwithActivatorTagApproachinBrassicanapus[C]//. National Congress of Plant Biology, NCPB-2013. (in Chinese)
[9] 苏彩霞,李君明,霍秀文.激活标签法及其在番茄功能基因组的应用[J].华北农学报, 2007,(8):172-176.
SU Cai-xia, LI Jun-ming, HUO Xiu-wen.( 2007). Activation Tagging and Its Application in Tomato Functional Genomics [J].ActaAgriculturaeBoreali-Sinica, (8):172-176. (in Chinese)
[10] Zubko, E., Adams, C. J., Macháèková, I., Malbeck, J., Scollan, C., & Meyer, P. (2002). Activation tagging identifies a gene from petunia hybrida, responsible for the production of active cytokinins in plants.PlantJournal, 29(6):797-808.
[11] Graaff, E. V D, Dulk-Ras, A. D., Hooykaas, P. J., et al.( 2000) . Activation tagging of the LEAFY PETIOLE gene affects leaf petiole development in Arabidopsis thaliana.Development, 127(22):4,971-4,980.
[12] Huang S, Sm. B D B, Re. C. (2001). Cloning of an Arabidopsis patatin-like gene, STURDY, by activation T-DNA tagging.PlantPhysiology, 125(2):573-584
[13] Suzuki, T., Itoh, K., Hagiwara, T., Nakayama, H., Honjyo, K., & Hirota, Y., et al. (2000). Activation tagging of the floral inducer FT.CurrentMicrobiology, 286(5446):1,962.
[14] Borevitz, J. O., Xia Y, Blount. J., Dixon,R. A., Lamb, C. (2001). Activation Tagging Identifies a Conserved MYB Regulator of Phenylpropanoid Biosynthesis [J].PlantCell, 12(12):2,383-2,394.
[15] Henz, S. (2006). A role for flavin-containing monooxygenases in auxin biosynthesis. Science, (291):306-309.
[16] Tani H, Chen X, Nurmberg, P., Nurmberg, P., Grant,t J. J., & Santamaria, M.(2004). Activation tagging in plants: a tool for gene discovery.Functional&IntegrativeGenomics, 4(4):258-266.
[17] 宋燕妮,杜黎黎,王学征,等.甜瓜突变体库的构建M2群体表型变异的研究[J].植物遗传资源学报,2015,(6):1 338-1 344.
SONG Yan-ni, DU Li-li, WANG Xue-zheng, et al.(2015).Construction of Mutant Library and Research on Phenotypic Variation of Me Population in Melon [J].JournalofPlantGeneticResources, (6):1,338-1,344. (in Chinese)
[18] 张边江,陈全战.质粒导人不同种农杆菌冻融法的探讨[J].湖北农业科学,2007, 46(3):329-331.
ZHANG Bian-jiang, CHEN Quan-zhan. (2007). Study on the Freeze- thaw Method of Transforming Plasmid DNA into Two Different Agrobacterium tumefaciens [J].HubeiAgriculturalSciences, 46(3): 329-331. (in Chinese)
[19] 陆璐,赵长增,陶兴林.从甜瓜子叶中提取总DNA[J].果树学报,2005, 22(6):748-750.
LU Lu, ZHAO Chang-zeng, TAO Xing-lin. (2005). Extraction of total DNA from cotyledons of melon (CucumismeloL.) [J].JournalofFruitScience, 22(6): 748-750. (in Chinese)
[20] 张铁刚,宁雪飞,王贤磊,等.新疆甜瓜"皇后"再生体系的建立[J].北方园艺,2012,(15):122-125.
ZHANG Tie-gang, NING Xue-fei, WANG Xian-lei, et al.(2012). Comparison of Three Optimized Method for Isolating Total RNA from Grapevine Tissues [J].NorthernHorticulture, (15):122-125. (in Chinese)
[21] 郑继刚,李成梅,肖英华,等.激活标签法及其在植物基因工程上的应用[J].遗传,2003, 25(4):471-474.
ZHENG Ji-gang, Ll Cheng-mei, XIAO Ying-hua, et al. (2003). Activation Tagging and the Application in Plant Genetic Engineering [J].Heredity, 25(4):471-474. (in Chinese)
Fund project:Supported by national college students innovation and entrepreneurship training project and NSFC (Grant No.3126025)
doi:10.6048/j.issn.1001-4330.2016.06.010
收稿日期(Received):2016-02-26
基金项目:国家大学生创新创业实训项目;国家自然科学基金项目(3126025)
作者简介:许荣华(1994-),女,重庆人,本科,研究方向为植物生理生化与分子生物学,(E-mail)952138547@qq.com 通讯作者(Cotresponding author):李冠(1949-),男,湖北人,教授,博士生导师,研究方向为植物生理生化与分子生物学,(E-mail)guanli@xju.edu.cn
中图分类号:S652
文献标识码:A
文章编号:1001-4330(2016)06-1048-06
The Construction of T-DNA Insertional Mutants in Melons
XU Rong-hua, JIANG Lu, NING Xue-fei, LI Guan
(CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China)
Abstract:【Objective】 In order to gain the T-DNA insertional mutants in melons and provide references for further research on the functional genetics of melons, the activation tagging carrier was constructed and transformed into melons.【Method】The target DNA was amplified from Saussurea involucrate Kar. & Kir by PCR, after EcoR I and Sac I digestion, the target enhancer was sub-cloned to pCAMBIA2301 vector. The activation tagging carrier was constructed. And the vector was transformed into the callus of Jiashi melons by using Agrobacterium tumefaciens. T-DNA insertional mutants were obtained.【Result】There were three regenerative plants that were transgenic plants identified by Kanamycin(Kan)screening and PCR.【Conclusion】The T-DNA insertional mutants were obtained, and the transgenic melons are likely to be used for the discovery of melon important trait gene.
Key words:melon; activation tagging;T-DNA insertional mutants
