新疆部分小麦材料籽粒硬度基因等位变异的分子鉴定及其分布
2016-07-23哈力旦依克热木芦静周安定曾潮武曹俊梅梁晓东刘联正范贵强张新忠黄天荣高永红吴新元
哈力旦·依克热木,芦静,周安定,曾潮武,曹俊梅,梁晓东,刘联正,范贵强,张新忠,黄天荣,高永红,吴新元
(新疆农业科学院粮食作物研究所,乌鲁木齐 830091)
新疆部分小麦材料籽粒硬度基因等位变异的分子鉴定及其分布
哈力旦·依克热木,芦静,周安定,曾潮武,曹俊梅,梁晓东,刘联正,范贵强,张新忠,黄天荣,高永红,吴新元
(新疆农业科学院粮食作物研究所,乌鲁木齐830091)
摘要:【目的】明确小麦籽粒硬度基因Puroindoline基因的等位变异组成与分布,比较新疆当地小麦材料与外引小麦材料硬度基因之间的差别,为改良新疆小麦品种奠定基础。【方法】用Pina-D1b、Pinb-D1b和候补基因非Pinb-D1b等位基因的分子标记,对新疆种植小麦材料的籽粒硬度基因PINA和PINB的分布情况进行分子鉴定。【结果】在鉴定的263份材料中,含Pina-D1b基因的为19.77%,含Pinb-D1b的为29.28%,含互补基因非Pinb-D1b为70.72%;Pina-D1b与Pinb-D1b基因类型在冬春小麦材料中分布不尽相同,Pina-D1b突变基因类型中,春小麦与冬小麦分别为52.68%与1.76%;在Pinb-D1b突变基因类型中,为12.9%与38.23%;Pina-D1b突变基因在新疆当地材料、其他国内材料和国外材料中的频率分别为28.57%、1.89%和33.96%,而Pinb-D1b基因类型的分布,不同来源材料出现的频率差异不明显。【结论】新疆小麦材料中含有突变类型Pina-D1b基因与Pinb-D1b基因的分布。Pina-D1b、Pinb-D1b和候补基因非Pinb-D1b基因标记引物,可作为小麦籽粒硬度基因鉴定的有效工具,提高小麦品质的选择效率。
关键词:新疆小麦;Puroindoline基因;分子标记;等位变异
0引 言
【研究意义】小麦籽粒硬度是影响小麦品质的重要性状,对磨粉和加工品质有较大的影响,也是国内外小麦市场原粮分级和定价的重要依据。因此,研究新疆小麦材料的籽粒硬度基因(puroindoline)类型的组成与分布对新疆麦区的品质改良具有重要意义。【前人研究进展】研究表明,Puroindoline蛋白包括puroindoline a(PINA)和Puroindoline b(PINB)蛋白,是决定小麦籽粒硬度的主要因素,小麦籽粒硬度的差异是有Pina 和 Pinb基因的不同变异类型造成的,在普通小麦中Pina不表达或Pinb基因位点发生突变都可能会导致小麦胚乳质地变硬,对磨粉品质和食品加工品质有正向作用[1-2]。近几年来,国内外学者陆续发现了多种puroindoline基因型,目前Pina位点共发现11种基因型,而Pinb位点则有20种基因型[3-6],其中Pinb-Dlb基因型在大多数国家和地区的硬质麦中占主导地位[5]。Chen等[8]研究表明控制小麦籽粒硬度的主效基因Pina 和Pinb位于5DS上,可解释总变异的63.2%[8],Pinb-D1b基因型比Pina-Dlb出粉率高、灰分低、具有更好的磨粉品质,同时前者的馒头、面条和面包加工品质也均略为优于Pina-Dlb和野生型。随着对puroindoline基因研究的不断深入,国内外学者相继开发了鉴定puroindoline基因型分子标记[5,7],加快了小麦籽粒硬度的研究进程。新疆为冬春麦兼种区,以白粒硬质、中强筋小麦品种作为选育目标。新疆育种工作者对于新疆小麦材料籽粒硬度和puroindoline基因等位变异组成类型与分布尚不清楚,在小麦育种过程中,存在着一定的盲目性。【本研究切入点】新疆在小麦籽粒硬度的遗传多样性研究基础较为薄弱。研究通过对新疆小麦育成品种与资源材料籽粒硬度主效基因Pinb-DIa和Pinb-DIb进行鉴定与评价,发掘该地区的优异种质资源和基因资源,为新疆麦区小麦籽粒硬度改良提供信息。【拟解决的关键问题】研究利用已开发籽粒硬度分子标记,对263份新疆小麦材料进行硬度基因型鉴定,明确新疆小麦材料硬度主效基因的变异类型,为新疆小麦品质改良提供有用的信息,为有效利用Pina和Pinb不同类型品种资源提供理论依据。利用Pina和Pinb的分子标记,分析puroindoline蛋白在新疆小麦资源的分布,对新疆小麦品质遗传改良具有重要意义。
1材料与方法
1.1材 料
试验所用小麦材料来自新疆农业科学院粮食作物研究所小麦课题组,共263份(新疆春小麦品种93份 ,国外引进冬小麦品种29份,新疆冬小麦品种43份,国内冬小麦品种98份)。涵盖新疆小麦(冬小麦和春小麦)的主栽品种。
1.2方 法
1.2.1基因组DNA提取
取小麦幼嫩叶片1~2 g充分研磨后分别放入2.0 mL离心管;加入1.0 mL CTAB提取液(20 g CTAB,1M Tris-HCl(pH 8.0)100 mL,0.5M EDTA(pH 8.0)100 mL,5 M NaCl 280 mL,用蒸馏水定容至1 000 mL,灭菌后加 β-巯基乙醇至10 mM),置于65℃水浴30 min,水浴过程中混匀数次;然后在4℃下12 000 r/m离心15 min;移上清至一新的2.0 mL离心管中,加入等体积的酚/氯仿(1∶1),轻摇5~10 min;4℃下12 000 r/m,离心15 min;移上清至一新的1.5 mL离心管中,加入等体积的氯仿/异戊醇(24∶1),轻摇5~10 min;4℃下12 000 r/m,离心10 min;移上清至一新的1.5 mL离心管中,加入0.6倍体积的异丙醇沉淀DNA,置于-20℃冰箱30 min;4℃下12 000 r/m,离心15 min,去上清,加0.5 mL 乙醇(70%),静置5 min;4℃下12 000 r/m,离心5 min,去乙醇(70%),室温干燥后,溶于400 μL的1×TE中备用,用于基因位点检测。
1.2.2特异性分子标记
利用Chen等[7]开发的Pina-D1b标记,引物序列(5’-3’), F-AATACCACATGGTTCTAGATACT,R-GCAATACAAAGGACCTCTAGAT;Giroux等[79]开发的非Pinb-D1b标记F-ATGAAGACCTTATTCCTCCTA,R-CTCATGCTCACAGCCGCC;与Pinb-D1b标记F-ATGAAGACCTTATTCCTCCTA, R- CTCATGCTCACAGCCGCT。
PCR体系20 μL,含模板80 ng DNA 1 μL,Taq酶(2.5 U/μL)0.4 μL,上、下游引物(5 μmol / L)各1.0 μL,dNTP 0.3 μL,10×PCR缓冲液2 μL,用ddH2O补充反应体系至20 μL。扩增程序为94℃预变性5 min;94℃变性130 s,58℃退火1 min,72℃延伸1 min,35个循环;72℃延伸7 min。
PCR扩增产物经1.5%琼脂糖凝胶电泳分离,采用缓冲体系1×TAE溶液,180~200 V电压电泳25 min,0.5%溴化乙锭(ethidium bromide,EB)染色10 min,蒸馏水漂洗后在GelDoc XR System成像系统上用紫外灯扫描成像并存入计算机,分析特异性条带。
2结果与分析
2.1Pina-D1b基因的鉴定
Pina-D1b标记为显性标记,利用Pina-D1b标记,检测PINA位点,扩增可获得一条为776 bp的片段,说明携带Pina-D1b基因,无扩增片段说明不携带Pina-D1b基因。对263份供试材料进行检测,有52份材料扩增出此片段,表明这52份材料属于Pina-D1b基因型,为19.77%。说明在这批材料含有突变类型Pina-Dlb基因并不多,其它材料均无此条带出现,则不含有Pina-Dlb基因类型。图1

注:M:DL 2000,1: CY-127,2:CY-143,3:CY-104,4:新春6号,5:新春37号,6:新春2号
图1特异性PCR标记Pina-D1b对供试材料的扩增结果
Fig.1PCR products amplified by the specific PCR markerPina-D1bin the materials tested
2.2Pinb-D1b基因的鉴定
鉴定Pinb-D1b基因,利用一对非Pinb-D1b标记与Pinb-D1b标记互补引物对供试材料进行分子检测,显示部分材料的PCR扩增条带。可以看出,用特异的Pinb-D1b引物扩增时,有新冬7号、伊农18号等77份材料在250 bp处出现条带,表明这些材料属于Pinb-D1b突变基因类型,为供试材料的29.28%;相反利用Pinb-D1b引物扩增出条带的材料未扩增条带,用非Pinb-D1b标记扩增时,则材料均发现在相应位置出现了250 bp条带,表明材料属于非Pinb-D1b类型。图2
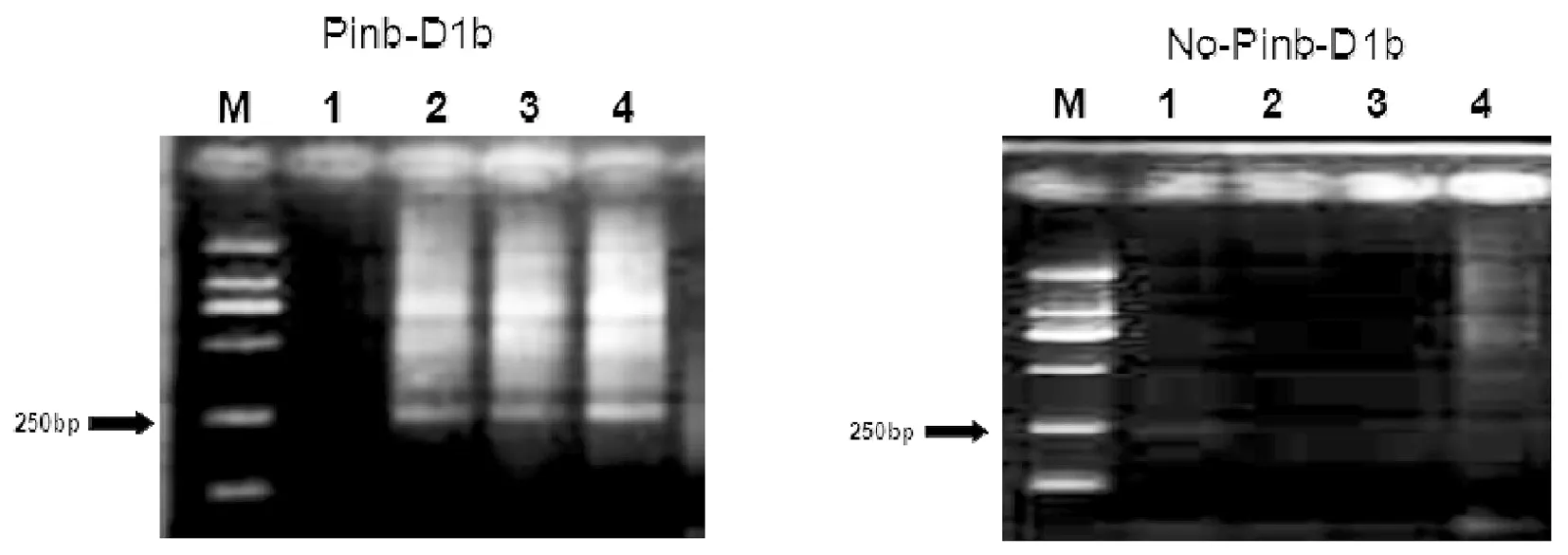
注:M:DNA Ladder 2000 1:新冬35号,2:新冬6号,3:新冬7号,4:伊农18号
图2特异性PCR标记Pinb-D1b与非Pinb-D1b对供试材料的扩增结果
Fig.2PCR products amplified by specific PCR labeledPinb-D1band nonPinb-D1bintle tested materials
2.3冬春小麦材料Pina-D1b与Pinb-D1b基因类型分布规律
在263份供试材料中,春小麦93份,冬小麦170份;Pina-D1b与Pinb-D1b基因类型在冬春小麦材料中分布不尽相同,Pina-D1b基因类型中,春小麦材料远高于冬小麦,为52.68%与1.76%;表明春小麦材料中以Pina-D1b突变类型基因为主,而冬小麦材料中Pina-D1b突变类型基因分布比例较少;在Pinb-D1b突变基因类型中,含有Pinb-D1b突变基因类型的春小麦材料为12.9%。冬小麦材料为38.23%,可见,在冬春小麦中含有Pina-D1b与Pinb-D1b突变基因类型分布频率差异较大。图3
2.4不同材料来源Pina-D1b与Pinb-D1b基因类型分布规律
263份供试材料中,扩增出776 bp的含有Pina-D1b突变基因的材料只有52份,在新疆当地材料、其他国内材料和国外材料中的频率分别为28.57%、1.89%和33.96%。不同来源品种(系)有一定差异,其他国内材料远低于新疆当地材料、国外材料。对于Pinb-D1b基因类型的分布,不同来源的材料出现的频率差异不明显。新疆材料、国内材料与国外材料的分布频率分别为24.49%、29.24%和31.48%。表1

图3 新疆冬春小麦材料中Pina-D1b与Pinb-D1b基因分布频率比较
表1供试材料籽粒硬度puroindoline相关基因标记的分布频率
Table 1Allelic frequencies for puroindoline genes in the materials tested by molecular markers

来源Origin材料数AccessionnumberPina-D1b(%)Pinb-D1b(%)非Pinb-D1b(%)新疆当地品种Xinjianglocalcultivars4928.5724.4975.51其他国内品种OtherChinesecultivars1061.8929.2470.76国外品种Overseacultivars10833.9631.4868.52合计Total26319.7729.2870.72
3讨 论
籽粒硬度作为重要的小麦品质性状己成为国内外育种家进行品质改良的重要指标之一,利用双引物对Pinb-D1b类型的基因型鉴定[10],并利用新开发的Pina-N标记进行Pina-D1b类型的基因型鉴定[11],快速准确地鉴定小麦籽粒硬度的基因类型,可有效加速小麦硬度选择的效率。Pinb-D1b、Pina-D1b类型是我国目前小麦品种中最常见的puroindoline基因型,有研究表明,Pinb-D1b类型的磨粉、面包烘焙品质以及面条和馒头的加工品质均优于Pina-D1b类型[12-13]。研究利用这三对引物对种新疆种植的小麦材料进行基因型分析;含有Pinb-D1b基因型的材料为29.28%;表明新疆在小麦新材料选育中对籽粒硬度性状的选择重视不够,导致其中含有非Pinb-D1b基因类型的材料较多。同时,在新疆春小麦材料以Pina-D1b基因类型为主导地位为52.68%,冬小麦材料中含Pinb-D1b类型远多于春小麦,总体来说Pinb-D1b基因类型在新疆小麦材料中占的比例较低,国外引进小麦材料相对较高,而基因对小麦籽粒硬度产生很大影响,借助puroindoline基因鉴定,有助于改良和提高新疆小麦材料的硬度基因类型,从而改善小麦面粉及制品的磨粉品质、出粉率、与加工品质、灰粉率等因素。
4结 论
通过对新疆小麦材料籽粒硬度基因型进一步鉴定,发现在新疆小麦材料中以不含Pina-Dlb基因类型和非Pinb-D1b类型为主;在新疆春小麦材料中以Pina-D1b(PINA缺失)基因类型为主导地位,冬小麦材料中含Pinb-D1b类型远多于春小麦;Pina-D1b与Pinb-D1b基因类型在冬春小麦材料中分布频率差异较大;在未来的育种中,应充分利用含Pinb-Dlb基因型的材料,用相关标记早代进行跟踪辅助筛选,从基因水平改善小麦品质。
新疆在小麦品质改良未利用籽粒硬度基因型来进行选育,明确了新疆小麦材料籽粒硬度Pina-D1b与Pinb-D1b基因类型分布特点,为新疆小麦品质遗传改良和推广提供一定的理论依据。
参考文献(References)
[1]Koksel, H, Kahraman, K., Sanal, T., Ozay, D. S., & Dubat, A. (2009). Potential utilization of Mixolab for quality evaluation of bread wheat genotypes.CerealChemistry, 86(5):522-526.
[2] 权文利,刘永安, 陈志国. 小麦子粒硬度与Puroindoline基因关系研究进展 [J]. 作物杂志,2013,(1):8-12.
QUAN Wen-li, LIU Yong-an, CHEN Zhi-guo. (2013). Research Progress on Effects of Puroindoline Genes on Wheat Grain Hardness [J]Crops, (1):8-12. (in Chinese)
[3] Bhave, M., & Morris, C. F. (2008). Molecular genetics of puroindolines and related genes: allelic diversity in wheat and other grasses.PlantMolecularBiology, 66(3):205-219.
[4] 丁茂予, 马传喜, 夏先春, 等. 普通小麦籽粒硬度的分子标记研究 [J]. 麦类作物学报,2006,26(5):24-26.
DING Mao-yu,MA Chuan-xi,XIA Xian- chun,et al. (2006). Molecular Markers of Grain Hardness in Chinese Common Wheat [J].JournalofTriticeaeCrops, 26( 5 ) : 24 -26. (in Chinese)
[5] 陈锋,董中东,程西永,等.小麦puroindoline及其相关基因分子遗传基础研究进展 [J]. 中国农业科学,2010,43(6):1 108-1 116.
CHEN Feng, DONG Zhong-dong, CHENG Xi-yong, et al. (2010). Advances in Research of Molecular Genetics of puroindoline and its Related Genes in Wheat[J].ScientiaAgriculturaSinica, 43(6):1,108-1,116. (in Chinese)
[6] Ikeda, T. M., Cong, H., Suzuki, T., & Takata, K. (2010). Identification of new pina, null mutations among asian common wheat cultivars.JournalofCerealScience, 51(3):235-237.
[7] Chen, F., Zhang, F., Morris, C., He, Z., Xia, X., & Cui, D. (2010). Molecular characterization of the puroindoline a-d1b allele and development of an sts marker in wheat (triticum aestivum l.).JournalofCerealScience, 52(1):80-82.
[8] Morris, C. F. (2002). Puroindolines: the molecular genetic basis of wheat grain hardness.PlantMolecularBiology, 48(5-6):633-647.
[9]Giroux, M. J,, & Morris, C. F. (1997). A glycine to serine change in puroindoline b is associated with wheat grain hardness and low levels of starch-surface friabilin.Theoretical&AppliedGenetics95(6):857-864.
[10] Chen, F., Chen, D. S., Qian, S. H., Zhang, Y., Xia, X. C., & Zhong Hu, H. E. (2006).Influenceofpuroindolinegeneonmillingperformance,steamedbreadandnoodlequalitiesinspringwheat.ActaAgronomicaSinica. (45):59-66.
[11] Chen F, He Z H, Xia X C, Xia L Q, Zhang X Y, Lillemo M, Morris C F. Molecular and biochemical characterization of puroindoline a and b alleles in Chinese landraces and historical cultivars.TheoreticalandAppliedGenetics, 112(3):400-409.
[12] Martin, J.M., Frohberg, R. C., Morris, C. F., Talbert, L. E., & Grioux, M. J. (2001). Milling and bread baking traits associated with Puroindoline sequence type in hard red spring wheat.CropScience, 41(1):228-234.
Fund project:The basic research funds of the Autonomous Region Public Welfare Research Institute (KY2014029); The special funds for major research and technology development plan projects of Xinjiang Uyghur Aotonomouse Region (201230116-1)
doi:10.6048/j.issn.1001-4330.2016.06.001
收稿日期(Received):2016-01-08
基金项目:新疆维吾尔自治区公益性科研院所基本科研业务费专项(KY2014029);新疆维吾尔自治区研究与技术开发计划重大专项(201230116-1)
作者简介:哈力旦·依克热木(1985-),女,新疆人,研究方向为小麦育种,(E-mail)halida9@163.com 通讯作者(Cotresponding author):芦静(1963-),女,甘肃人,研究员,研究方向为小麦品质育种,(E-mail)lujing-321@163.com 吴新元(1962-),男,河北人,研究员,研究方向为小麦遗传育种,(E-mail)xinyuanwu@126.com
中图分类号:S512;S503.53
文献标识码:A
文章编号:1001-4330(2016)06-0981-06
Distribution and Molecular Identification of Kernel Hardness Gene Alleles in Part of Wheat Germplasms of Xinjiang
Halidan Yikeremu,LU Jing,ZHOU An-ding,ZENG Chao-wu,CAO Jun-mei,LIANG Xiao-dong,Liu Liang-zhen,FAN Gui-qiang,ZHANG Xin-zhong,HUANG Tian-rong,GAO Yong-hong,WU Xin-yuan
(ResearcgInstituteofGrainCrops,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China)
Abstract:【Objective】 The study is to research the allelic composition and distribution of kernel hardness gene(Puroindoline gene)and difference of kernel hardness gene between local wheat materials of Xinjiang and introduced wheat materials in the hope of laying the foundation for improvement of wheat variety in Xinjiang.【Method】Using molecular markers Pina-D1b, Pinb-D1b, and non-Pinb-D1b of complemental gene to identify distribution of kernel hardness gene PINA and PINB in cultivated wheat germplasms of Xinjiang.【Result】The results showed that 19.77% of materials had allele Pina-D1b, 29.28% of materials had allele Pinb-D1b and 70.72% of materials had allele non-Pinb-D1b in 263 germplasm; the alleles Pina-D1b and Pinb-D1b had a different distribution in winter and spring wheat germplasm, and spring and winter wheat materials respectively were 52.68% and 1.76% in mutant gene type Pina-D1b and 12.9% and 38.23% in mutant gene type Pinb-D1b; the distribution frequency of local materials of Xinjiang, other domestic materials and foreign materials were respectively 28.57%, 1.89% and 33.96% in mutant gene type Pina-D1b; but in mutant gene type Pinb-D1b, the distribution frequency did not have obvious difference.【Conclusion】The study concluded that wheat materials in Xinjiang had mutant gene type Pina-D1b and Pinb-D1b and using molecular markers Pina-D1b, Pinb-D1b, and non-Pinb-D1b of complemental gene could be acted as effective way to identify kernel hardness of wheat for enhancing efficiency of selection in wheat quality breeding.
Key words:Wheat in Xinjiang; puroindoline gene; molecular markers; alleles
