根系分泌物对土壤中有机氯农药降解的强化效应及其作用机制
2016-07-22潘声旺黄方玉
潘声旺, 刘 灿, 黄方玉
(成都大学 建筑与土木工程学院, 四川 成都 610106)
根系分泌物对土壤中有机氯农药降解的强化效应及其作用机制
潘声旺, 刘灿, 黄方玉
(成都大学 建筑与土木工程学院, 四川 成都610106)
摘要:借助盆栽模拟实验,研究了黑麦草根系分泌物对有机氯农药的降解效应及其对土壤微生物群落特征的影响.结果显示,添加根系分泌物促进了污染土壤(TR2)中OCPs的去除:修复平衡15 d后,TR2组土壤中OCPs去除率高达77.57%,比对照组(CK)高出33.49%,比微生物活性被抑制的TR1组高出58.16%;相同污染水平下,TR2土样中微生物生物量碳量也明显高于CK、TR1组.实验期间,细菌的磷脂脂肪酸在OCPs污染土壤中占主导地位,其次为真菌,其在土壤微生物群落中变化趋势与OCPs降解变化一致,说明OCPs降解过程中,根系分泌物主要通过影响细菌、真菌的种群数量及其群落结构,进而影响OCPs降解.
关键词:有机氯农药;黑麦草;根系分泌物;根际微生物;磷酸脂肪酸(PLFA)分析法
0引言
有机氯农药(Organochlorine pesticides,OCPs)是高残留、生物富集性强的农药,性质稳定、可溶性差,容易吸附在土壤中,并通过食物链对生态环境和人体健康产生潜在威胁[1-2].我国虽从1983年开始禁止使用OCPs,但目前仍可在多种利用类型土壤中检出OCPs残留[3-4].随着全球范围内对环境保护和食品安全的日益重视,如何安全、有效地去除环境中的OCPs残留已成为环境毒理学研究的热点.降解有机氯的方法有很多种,如化学法、物理法和植物—微生物联合修复,其中物理法和化学法等都普遍存在着处理成本高,易造成二次污染,去除效果差等缺点,而植物—微生物联合修复则主要利用微生物对OCPs的特异性降解及其根际效应进行降解,该方法操作简便、环境友好、修复效果明显,已成为治理残留农药的重要手段.本研究拟以成都市区蔬菜地土壤中OCPs复合污染状况[5]为参照,以研究较多的黑麦草为实验材料,系统研究受OCPs复合污染状态下,黑麦草的根系分泌物对根际微生物降解效能的影响,探讨其影响机制,以期为植物修复技术的研究与实践提供参考.
1材料与方法
1.1实验材料
1.1.1土壤.
供试土壤为中性紫色土,采自成都大学十陵校区旱地表层,取样深度为5~15 cm.新鲜土样去除石子和植物残体后,分为2部分:一部分直接过9 mm筛后混合均匀,供盆栽培养植物用;另一部分风干后研磨过2.5 mm筛,用于土壤基本性质测定.经检测,土样的理化性质如下:pH值为7.19,有机质含量为2.14×104mg·kg-1,阳离子交换量为20.43 cmol·kg-1,速效N、P、K分别为31.62、24.74、94.81 mg·kg-1;砂粒、粉粒和黏粒的质量分数分别为71.27%、9.59%和19.14%.土样风干后过2 mm筛,备用.
1.1.2植物.
选取修复效果较好的黑麦草为供试植物,其幼苗采自成都大学无OCPs污染的草坪及其周边地区,选择株体大小相当的植株,清水去泥、3%H2O2除菌后,用蒸馏水清洗其根部后作移栽、备用.
1.1.3仪器.
实验所用的仪器包括:Agilent1100型气相色谱仪(Agilent Technologies Inc.,USA); 电子捕获检测器(GC-μECD);Agilent1100系列自动进样器;TOC-500型自动分析仪(Hitachi Ltd.,Japan);GC-MS(G1530N/G3172A,Agilent Technologies Inc.,USA);DHP-9080B型电热恒温培养箱(江苏省金坛市友联仪器研究所)等.
1.1.4试剂.
OCPs混标:HCHs (α-HCH、β-HCH、γ-HCH、δ-HCH)、DDTs(p,p′-DDT、o,p′-DDT、p,p′-DDE、o,p′-DDE、p,p′-DDD)、六氯苯(HCB)、艾氏剂、狄氏剂、异狄氏剂、α-氯丹、γ-氯丹、硫丹I、硫丹II、硫丹硫酸盐、异狄氏剂醛、异狄氏剂酮、七氯、环氧七氯、甲氧滴滴滴,均为色谱纯,购自Supelco公司;无水硫酸钠、丙酮、正己烷等为分析纯,购自成都市科农化工试剂厂.
1.2实验设计
1.2.1收集根系分泌物.
采用土培法进行黑麦草根系培养,40 d后,水培法对黑麦草植株进行OCPs胁迫处理、收集根系分泌物[6].将根系分泌物慢速过滤(0.45 μm微孔滤膜)后,定容至1.5 L,低温(-20 ℃)保存,备用.
1.2.2配置受OCPs污染土样.
参照成都市区蔬菜地土壤中OCPs的污染特征[7],按一定比例称取适量的OCPs组分溶于丙酮溶液中,均匀洒在土壤表层,待丙酮挥发后,多次搅拌、混匀后,室温下平衡7 d.GC/MS-MS法测定土壤中OCPs的初始浓度为343.61 mg·kg-1(C5),其中,∑DDT、∑HCH、HCB、艾氏剂、狄氏剂、狄氏剂、毒杀芬、灭蚁灵、硫丹Ⅰ、环氧七氯、γ~氯丹的质量浓度分别为299.52、14.49、8.13、1.05、1.89、3.21、1.98、1.65、3.42和8.27 mg·kg-1;将已制得的标准土样(C5)用未污染土样多次稀释、搅拌,制得土样C1~C4,室温下平衡7 d后测得其浓度分别为:66.67 mg·kg-1(C1)、138.47 mg·kg-1(C2)、205614 mg·kg-1(C3)、282.07 mg·kg-1(C4).
1.2.3土壤模拟修复实验.
土壤模拟修复采用3个处理、5个重复.处理1(对照组,CK),OCPs污染土样;处理2(TR1),加入0.05% NaN3(抑制微生物活性[9])的OCPs污染土样;处理3(TR2),加入黑麦草根系分泌物的OCPs污染土样.室温下平衡15 d后,检测土壤中OCPs残留浓度、微生物生物量碳及其磷酸脂肪酸组分.
1.3检测方法
1.3.1OCPs检测.
土样前处理参照GB/T14550-1993相关要求.
1)GC-ECD分析[7].DM-5层析柱(30 m×0.32 mm×0.25 μm),程序升温:初温90 ℃,保持1 min;40 ℃·min-1升至170 ℃,23 ℃·min-1升至230 ℃保持17 min;40 ℃·min-1升至280 ℃保留5 min.进样口温度260 ℃,检测器温度300 ℃;高纯氮气为载气,流速为1 mL·min-1;尾吹为60 mL·min-1;不分流进样,进样量1 μL.
2)GC/MS-MS分析.岛津气相色谱(GC2010,Shimadzu Corp.,Japan),离子阱质谱,色谱—质谱接口温度250 ℃,离子源温度230 ℃;离子化方式,EI;电子能量:70 eV;溶剂延迟,6 min;全扫描质量范围,40~500 AMU.
按照上述方法,OCPs回收率为90%~120%,检出限为0.07~0.15 μg·kg-1.
1.3.2土壤微生物群落特征分析.
土壤微生物生物量碳用氯仿熏蒸,0.5 mol·L-1K2SO4提取,TOC-500自动分析仪测定.土壤微生物群落结构采用磷酸脂肪酸分析法(PLFA)分析[8],测定依据:不同微生物(细菌、真菌、放线菌等)具有特征的磷酸脂肪酸谱,根据质谱标准图PLFA组分的定性分析,以PLFA19∶0做内标物进行定量分析.特定脂肪酸的排列为:碳的数目、双键的数目、跟随双键的位置(甲基端起).c、t分别表示顺式和反式脂肪酸,a和i分别指反式支链脂肪酸及异式支链脂肪酸,br表示未知结构的支链脂肪酸,cy表示环状脂肪酸,10Me表示第10个碳原子的甲基(从羟基端起).具体涉及的群落结构指标和磷酸脂肪酸谱系如表1.

表1 表征微生物群落结构的磷酸脂肪酸谱系表
1.4数据处理
实验数据经Excel 2007基础处理后,用SPSS 11.5软件LSD法分析不同处理间差异显著性.其中,OCPs降解率(R)计算公式为,
式中,C0表示土壤中OCPs初始浓度,Ct表示土壤中残留浓度.
2结果与分析
2.1不同处理土壤中OCPs的降解特征
不同处理土壤中OCPs的降解特征如图1所示.可以看出,室温下平衡15 d后,土壤中OCPs的残留浓度随着初始污染水平的上升而增加.试验期间,添加根系分泌物(30 mL)污染土样(TR2)中OCPs的平均降解率为77.57%,微生物活性被抑制的TR1处理中OCPs的平均降解率为19.41%;而对照土壤(CK)中OCPs降解率为44.08%,不同处理间差异明显(p<0.05)(p<0.05).相同污染浓度下,TR2中OCPs的去除率明显高于其他处理,表现为TR2>CK>TR1,差异明显(p<0.05) (图1(a);根系分泌物的添加量不同,污染土样(TR2)中OCPs的降解率也不一样,且随着添加量的增加而增大,添加量为30 mL时增幅最大(图1(b)).图中不同字母代表同一污染水平上P<0.05水平差异显著,图柱线I为误差线.
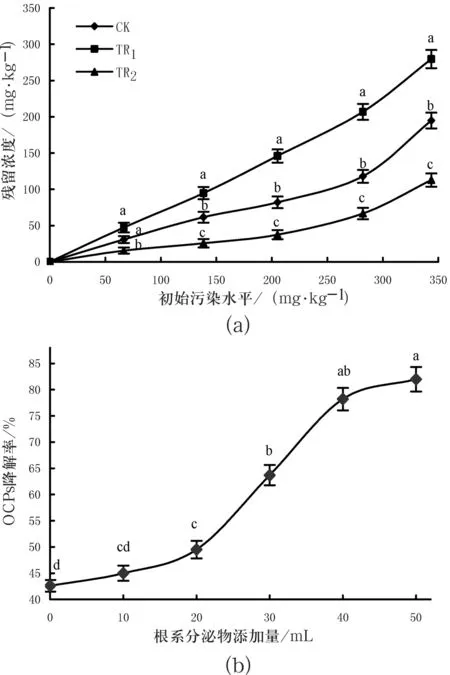
图1不同处理条件下土壤中OCPs的降解特征
2.2不同处理土壤中微生物生物量碳的变化
添加根系分泌物对土壤微生物生物量碳的变化情况见图2.可以看出,相同添加水平(30 mL)下,微生物生物量碳最多的为TR2,CK次之、TR1最少,三者差异显著(p<0.05),说明根系分泌物的存在促进了降解菌的生长(图2(a));相同污染水平(C3)下,根系分泌物添加量越多,该土壤—植物系统(TR2)中微生物生物量碳就越多,说明根系分泌物的存在激发了微生物的生长活性(图2(b)).图中不同字母代表同一污染水平上P<0.05水平差异显著,图柱线I为误差线.
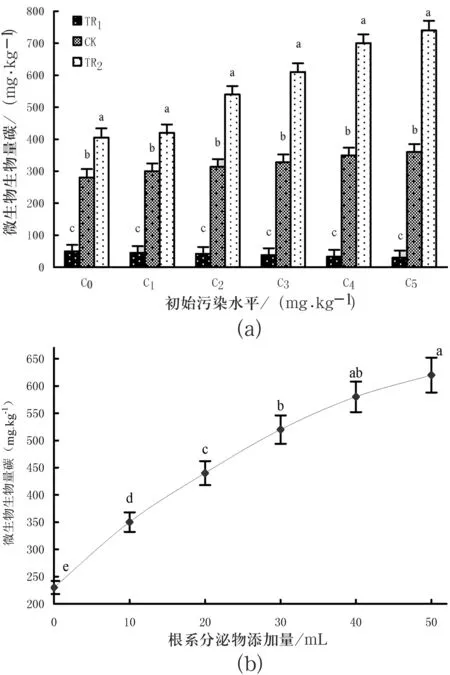
图2不同处理土壤中微生物生物量碳的变化
2.3根系分泌物添加量对土壤微生物群落特征影响
2.3.1对微生物群落磷脂脂肪酸含量的影响.
根系分泌物添加量对受OCPs污染土壤(C3)中不同类群土壤微生物磷脂脂肪酸含量的影响效应见图3.可以看出,相同添加量下,OCPs污染土壤中的磷脂脂肪酸量以细菌最多,真菌、放线菌次之,丛枝菌根最少.说明添加根系分泌物的OCPs污染土壤中,土壤微生物群落结构组成以细菌为主,其次为真菌和放线菌,最后是丛枝菌根.随着根系分泌物添加量的增加,受OCPs污染土壤中细菌的种群数量也逐渐增加,但添加在30~50 mL间时,其增加幅度并不显著(P>0.05);真菌的种群数量的变化趋势较细菌更明显,即随着根系分泌物添加量的增加,真菌的种群数量逐渐增加,不同添加量间差异显著(P<0.05).相比之下, 丛枝菌根真菌种群数量的变化趋势较为缓和,随着根系分泌物添加浓度的增加,污染土壤中丛枝菌根真菌的数量也逐渐增加,且都明显高于对照(P<0.05),但不同添加量间的种群数量无显著差异(P>0.05).实验期间,放线菌种群数量的变化较为特殊,随着根系分泌物添加量的增加,受OCPs污染土壤中放线菌的种群数量呈现先升后降的变化趋势,在添加量为30 mL时出现峰值.造成上述变化的原因可能是,根系分泌物可作为满足细菌生长所需碳源、氮源,添加少量的根系分泌物能激发微生物的生长活性;随着根系分泌物的增加,分泌物中的有机酸可能会对部分中性或嗜碱性细菌的生长产生抑制作用,不耐酸的放线菌的种群数量也会随之减少,但有机酸对耐酸性的真菌、丛枝菌根的生长影响不大.
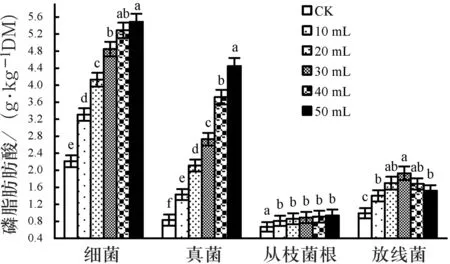
图3 根系分泌物添加量对根际微生物磷脂脂肪酸含量的影响
综合OCPs污染土壤中土壤微生物群落随根系分泌物添加浓度增加的变化可知,由于土壤中微生物群落以细菌、真菌为主,且二者的变化趋势与OCPs降解变化特征一致,说明OCPs的降解以细菌、真菌为主,根系分泌物主要通过影响细菌、真菌的种群数量,进而影响OCPs的降解特征.图中不同字母代表同P<0.05水平差异显著,图柱线I为误差线.
2.3.2对微生物群落结构的影响.
进一步分析受OCPs污染土壤(C3)中微生物种群间的变化幅度(见图4)时发现,随着根系分泌物添加量的增加,革兰氏阴性菌与革兰氏阳性菌的种群数量之比逐渐增加,除对照外,不同添加量土壤中革兰氏阴性菌与革兰氏阳性菌间的变化幅度无明显差异(P>0.05).同时,从真菌与细菌、丛枝菌根与细菌以及放线菌与细菌的种群数量之比来看,受OCPs污染土壤中细菌占绝对主导地位,而革兰氏阴性菌又占相对优势,其次为真菌和放线菌,最后是丛枝菌根.真菌与细菌的种群数量之比随着根系分泌物添加浓度的增加而急剧增加,不同添加水平间差异显著(P<0.05),说明真菌在植物修复受OCPs污染土壤过程中同样发挥着重要作用.
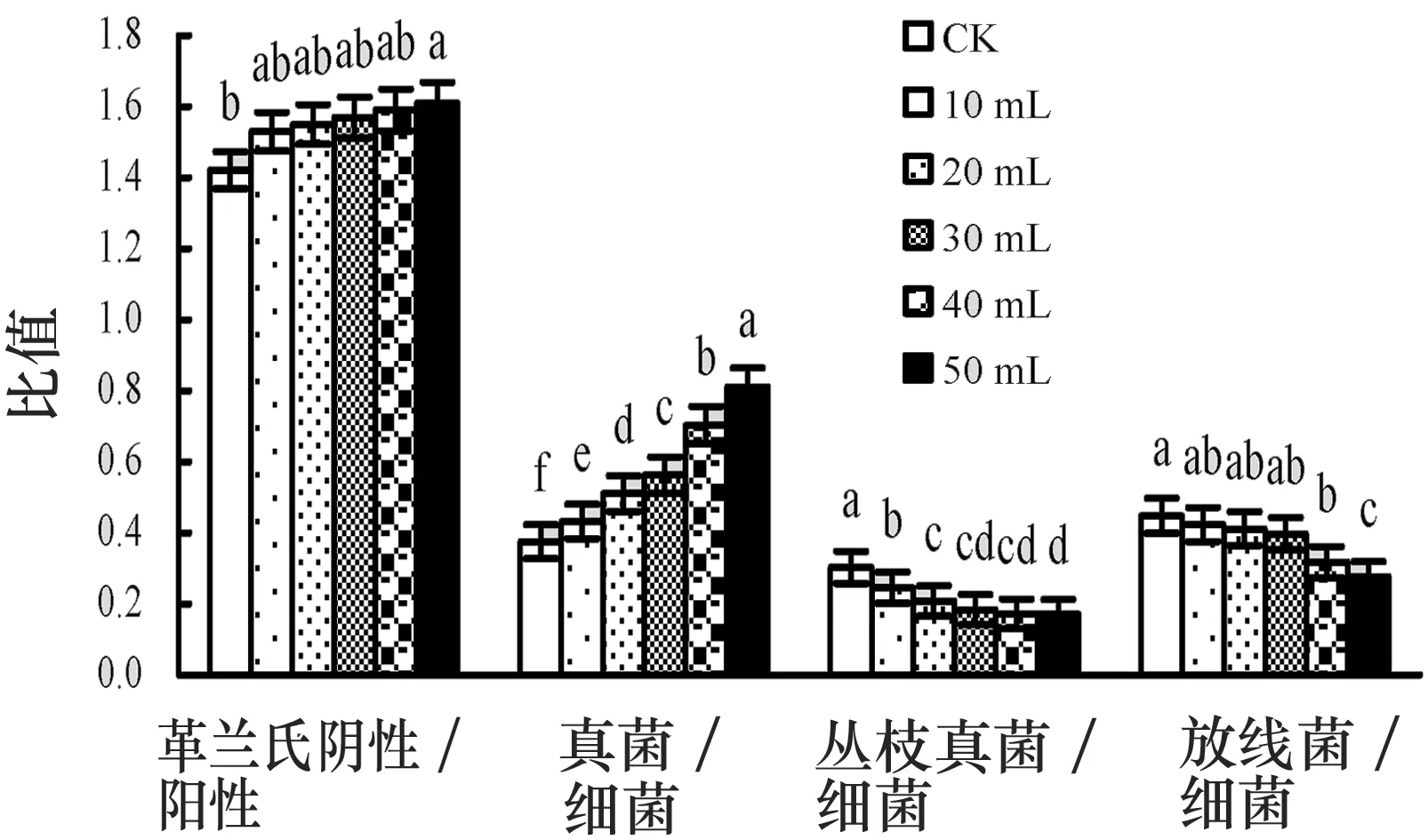
图4 根系分泌物添加量对根际微生物群落结构的影响
实验期间,丛枝菌根与细菌、放线菌与细菌的数量比随着根系分泌物添加量的增加逐渐减小,添加量较低(0~30 mL)时,对丛枝菌根与细菌之比影响较大(P<0.05),但对放线菌与细菌之比影响不显著(P>0.05);添加量较高(30~50 mL)时,对放线菌与细菌之比影响较大(P<0.05),但对丛枝菌根与细菌之比影响不显著(P>0.05).说明改变微生物群落的组成结构,是根系分泌物影响OCPs降解特征的另一重要途径,具体如图4所示.图4中不同字母代表P<0.05水平差异显著,图柱线I为误差线.
3讨论
植物的存在能加快土壤中持久性有机污染物的去除,根系分泌物营造的根际环境则是污染物快速消解的重要因素[7,9].植物修复过程中,根系分泌物在改善土壤属性、提高污染物生物可利用性、缓解环境胁迫等方面具有重要作用.一方面,根系分泌的某些胞外酶能够直接参与污染物的降解过程;另一方面,分泌物中的可溶性糖、低分子量有机酸、氨基酸等物质,为根际微生物提供充足的营养,增加微生物数量、激发微生物活性,进而加速污染物降解.同时,根系分泌物还会直接影响污染物的固定和活化,进而影响污染物在土壤—植物系统中的迁移转化,促进土壤中OCPs去除[10].本研究中,加入根系分泌物的TR2土样经15 d修复平衡后,其OCPs降解率(77.57%)明显大于CK、TR1(P<0.05);相同污染水平下,TR2土样中微生物生物量碳含量明显大于CK1(P<0.05),说明根系分泌物的存在激发了土壤微生物的生长活性,进而影响了OCPs的降解变化特征.
微生物能够降解OCPs,与降解过程中所释放的脱氯化氢酶、水解酶、脱氢酶、还原酶和双加氧酶酶密切相关.目前探明对OCPs有降解作用的微生物主要包括假单胞菌属,如鞘氨醇单胞菌、柠檬酸杆菌属,真菌类,如白腐菌、褐腐菌等,以及梭菌属、牙孢杆菌属、棒状杆菌属、微球菌属、氢单胞菌属等多种菌属[11-13].本研究中,加入黑麦草根系分泌物的TR2土样经15 d修复平衡后,受OCPs污染土壤中细菌群落,尤其是革兰氏阴性菌的磷脂脂肪酸量以最多,真菌、放线菌次之,丛枝菌根真菌最少.在不同处理的模拟修复试验中,细菌、真菌随根系分泌物添加剂量的变化趋势与OCPs降解变化特征相一致,说明OCPs的降解以细菌、真菌为主,根系分泌物主要通过影响受OCPs污染的土壤中细菌、真菌的种群数量及其群落结构,进而影响OCPs的降解特征.
4结论
植物修复过程中,根系分泌物对根际微生物的降解效能具有促进作用.在15 d的修复平衡实验中,添加根系分泌物污染土样(TR2)中OCPs的平均降解率为77.57%,对照土壤中OCPs降解率为44.08%;而微生物活性被抑制的TR1处理中OCPs的平均降解率仅为19.41%,不同处理间差异明显(P<0.05).受OCPs污染土壤中,细菌占主导地位,并以革兰氏阴性菌占相对优势,其次为真菌和放线菌,最后是丛枝菌根真菌.细菌、真菌随根系分泌物添加剂量的变化趋势与OCPs降解变化特征一致,表明OCPs的降解以细菌、真菌为主,根系分泌物主要通过影响细菌、真菌的种群数量及其群落结构,进而影响OCPs的降解特征.
参考文献:
[1]杨国义,万开,张天彬,等.广东省典型区域农业土壤中六六六(HCHs)和滴滴涕(DDTs)的残留及其分布特征[J].环境科学研究,2008,21(1):113-117.
[2]Fu J M,Mai B X,Sheng G Y,et al.PersistentorganicpollutantsinenvironmentofthePearlRiverDelta,China:anoverview[J].Chemosphere,2003,52(9):1411-1422.
[3]胡春华,周文斌,易纯,等.环鄱阳湖区蔬菜地土壤中有机氯农药分布特征及生态风险评价[J].农业环境科学学报,2011,30(3):487-491.
[4]Gao H J,Jiang X,Wang F,et al.ResiduallevelsandnewinputsofohlorinatedPOPsinagriculturalsoilsfromTaihulakeregion[J].Pedosphere,2005,15(3):301-309.
[5]潘声旺,吴云霄,罗竟红,等.成都城区蔬菜地土壤中农药残留及其分布特征[J].生态环境学报,2011,20(3):538-543.
[6]谢晓梅,廖敏,杨静.黑麦草根系分泌物剂量对污染土壤芘降解和土壤微生物的影响[J].应用生态学报,2011,22(10):2718-2724.
[7]Pan S W,Wei S Q,Yuan X,et al.Theremovalandremediationofphenanthreneandpyreneinsoilbymixedcroppingofalfalfaandrape[J].Agricult Sci Chin,2008,7(11):1355-1364.
[8]李振高,骆永明,腾英.土壤与环境微生物研究法[M].北京:科学出版社,2008.
[9]Sumia K,Muhammad A,Samina I,et al.Plant-bacteriapartnershipsfortheremediationofhydrocarboncontaminatedsoils[J].Chemosphere,2013,90(4):1317-1332.
[10]Abhilash P C,Powell J R,Singh H B,et al.Plant-microbeinteractions:novelapplicationsforexploitationinmultipurposeremediationtechnologies[J].Cell,2012,30(8):416-420.
[11]Nagata Y,Miyauchi K,Takagi M.Completeanalysisofgenesandenzymesforγ-hexachlorocyclohexanedegradationinSphingomonaspaucimobilisUT26[J].J Ind Microbiol Biotechnol,1999,23(4-5):380-390.
[12]Jagnow G,Haider K,Ellwardt P C.Anaerobicdechlorinationanddegradationofhexachlorocyclohexaneisomersbyanaerobicandfacultativeanaerobicbacteria[J].Arch Microbiol,1977,115(3):285-292.
[13]Adi S P,Ichiro K,Ryuichiro K.Degradationof1,1,1-trichloro-2,2-bis(4-chlorophenyl)ethane(DDT)bybrown-rotfungi[J].J Biosci Bioeng,2008,105(6):614-621.
Effects of Ryegrass Root Exudates on Degradation of Organochlorine Pesticides in Soils and their Enhancing Mechanisms
PANShengwang,LIUCan,HUANGFangyu
(School of Architecture and Civil Engineering, Chengdu University, Chengdu 610106, China)
Abstract:Pot experiments are carried out to investigate the degradation effects of ryegrass(Lolium perenne) root exudates on organochlorine pesticides(OCPs) and on soil microflora characteristics.The results show that ryegrass root exudates stimulated the elimination of OCPs in the polluted soil(TR2) 15 days after the redressed balance.The removal rate of OCPs in the soil(TR2) is the highest,at an average of 77.57%,33.49% higher than that of the control group(CK) and 58.16% higher than that of TR1.During the experiment,the phospholipid fatty acid dominates in the polluted OCPs soil and followed by fungi that have the same variation trend as the OCPs degradation.This indicates that during the degradation of OCPs,the root exudates mainly influence the degradation by disturbing the population quantity and community structure of bacteria and fungi.
Key words:organochlorine pesticides(OCPs);ryegrass;root exudates;rhizosphere microorganism;phospholipid fatty acid analysis method
文章编号:1004-5422(2016)02-0196-05
收稿日期:2016-05-02.
基金项目:2015年国家级大学生创新创业实验课题(201511079008)、 四川省大学生创新创业训练计划(201411079026; 201511079008)资助项目.
作者简介:潘声旺(1973 — ), 男, 博士, 副教授, 从事环境生态与生态修复技术研究.
中图分类号:X131.3;X172
文献标志码:A
